В последнее время все большее внимание в регенеративной медицине стало уделяться децеллюляризированным биологическим тканям и их производным [1]. И если раньше в хирургии в основном использовали такие материалы в форме заплаток или объемных структур, например применимо к сердцу [2], печени [3], трахее [4] и т.д. то в последнее время стало появляться все больше исследований и разработок связанных с использованием гелеобразных материалов. Преимущество последних заключается в том, что они сами принимают необходимую форму, а также могут быть доставлены в необходимое место минимально инвазивным способом.
Основой децеллюляризированных тканей является внеклеточный матрикс (ВКМ), который представляет собой сложный трехмерный комплекс из фибриллярных белков и других биополимеров и является каркасом и средой, в которой существуют клетки многоклеточных животных организмов [5–7]. ВКМ обеспечивает не только структурную функцию, но также участвует во многих клеточных процессах, включая коммуникацию и взаимодействие между клетками, их миграцию и дифференцировку, что отчасти обусловлено содержанием в ВКМ различных ростовых факторов и других сигнальных молекул [8, 9]. Так как белки и другие компоненты, входящие в состав межклеточного матрикса, практически идентичны среди млекопитающих, это позволяет использовать ВКМ животного происхождения для его применения по отношению к человеку, ввиду сведения к минимуму (или практически исключения) иммунного отторжения организмом человека материалов, созданных на основе животного ВКМ [7].
Внеклеточный матрикс в форме гидрогелей и их производных является идеальной средой для клеток, поэтому применение именно гелевых форм регенеративных материалов наиболее оптимально при таких поражениях, как термические ожоги, инфаркт и др. Для эффективного результата использования гидрогелей в регенеративной медицине они должны обладать определенными свойствами и характеристиками, такими как вязкость, адгезия, плотность, pH и т.д. В данной работе мы попытались изменить адгезивные свойства ВКМ гидрогеля при помощи полисахаридных добавок агара и альгината натрия.
Целью данного исследования являлось улучшение адгезивных свойств и вязкости гидрогелей на основе внеклеточного матрикса при помощи добавок для их более надежной фиксации на раневой поверхности.
Материалы и методы исследования
Внеклеточный матрикс получали из свиных мочевых пузырей, которые были собраны непосредственно после убоя животных. Органы были тщательно промыты дистиллированной водой, а излишки жировой ткани были удалены. Очищенные мочевые пузыри были взвешены и заморожены при -80 °С до дальнейшего использования. Замороженный мочевой пузырь размораживали в дистиллированной воде и тщательно промывали 3 раза. Далее органы погружали в фосфатный буфер на 15 мин. Внутренний слой рыхлой соединительной ткани мочевого пузыря (lamina propria) отделялся механически, при помощи ножниц и скальпеля. Ткань промывалась 4 раза дистиллированной водой, затем 2 раза фосфатным буфером. Промытую ткань помещали в 1М раствор NaCl и инкубировали на орбитальном шейкере при 200 об/мин в течение суток. Раствор меняли три раза в ходе инкубации по мере отмывки. После инкубации, ткань промывали 3 раза дистиллированной водой на шейкере при тех же условиях в течение 15 мин на каждую промывку. Отмытая ткань помещалась на полтора часа в раствор 0,1 % надуксусной кислоты и 4 % этанола для обеззараживания. После обеззараживания, ткань промывали дистиллированной водой на шейкере 4 раза по 15 мин. На этом этапе обработки были взяты образцы ткани для дальнейшего гистологического исследования и электронной микроскопии.
После промывки ткань лиофилизировали в течение суток до полного удаления влаги при помощи лиофильной сушки FreeZone 1L (Labconco). Высушенный внеклеточный матрикс стерилизовали ультрафиолетовым излучением внутри ламинарного бокса в течение 1 ч, после чего нарезали при помощи ножниц на небольшие куски размером 3–5 мм. Все подготовительные манипуляции с внеклеточным матриксом проводились внутри ламинарного бокса. Нарезки материала помещались в заранее подготовленные стерильные размольные стаканы, куда также добавляли 2 стальных шара. Подготовленные закрытые размольные стаканы с предварительно размельченным материалом и шарами погружались на 3 минуты в жидкий азот, для предотвращения нагрева измельчаемого материала. Затем размольные стаканы фиксировались в зажимах вибрационной мельницы GT200 (Grinder). Образцы измельчали при 1800 об/мин в течение 10 мин. Измельченный порошок (рис. 1, А) переносили в стерильную пробирку внутри ламинарного бокса для дальнейшей обработки.

Рис. 1. А) Порошкообразный ВКМ. В) Растворенный ВКМ до момента гелеобразования
Для оценки качества децеллюляризации lamina propria и её морфологии использовали стандартное окрашивание гематоксилин-эозином с последующим анализом фиксированных препаратов с использованием светового микроскопа. По-видимому, ввиду изначального малого содержания клеток в данной ткани мы не наблюдали интенсивного окрашивания ядер на срезах необработанных образцов (рис. 2, а), образцы после интенсивной отмывки полностью теряли клеточные элементы и давали очень слабое окрашивание (рис. 2, b).
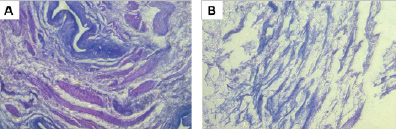
Рис. 2. Гистологические срезы, окрашенные гематоксилином и эозином, до (А) и после децеллюляризации (В)
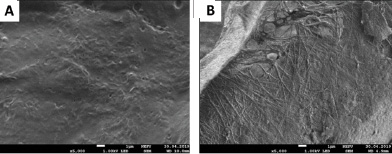
Рис. 3. Микрофотографии, сделанные при помощи метода сканирующей электронной микроскопии при 5000-кратном увеличении, до (A) и после децеллюляризации (B)
Для визуализации структуры ткани до и после обработки применяли растровую (сканирующую) электронную микроскопию с использованием микроскопа JEOL JSM 7800F с разрешающей способностью 1,2 нм при ускоряющем напряжении 1 кВ с термоэлектронным катодом Шоттки и с системой Gentle Beem, позволяющую сканировать объекты нанометрового размера без проводящих покрытий образцов в режиме низких ускоряющих напряжений (1–2 кВ). На полученных микрофотографиях отчетливо видна волокнистая структура, характерная для очищенного внеклеточного матрикса (рис. 3).
Результаты исследования и их обсуждения
Гидрогель из сухого ВКМ был получен по методике, описанной ранее [10] с небольшими модификациями. Вкратце 400 мг порошкообразного ВКМ растворяли в 40 мл раствора пепсина 1 мг/мл в 0,01N HCl. Смесь инкубировали на орбитальном шейкере при комнатной температуре течение 48 ч. После инкубации пре-гель (рис. 1, b) пропускали через нейлоновый фильтр с размером ячейки 100 микрон, для удаления нерастворенных частиц. Далее, пепсин, содержащийся в растворе, инактивировали добавлением 0,1 N NaOH до достижения pH 7,4. Гелеобразование было индуцировано нагреванием раствора на водяной бане до 37 °С в течение 45 мин. Готовый гель доводили до нужной концентрации при помощи фосфатного буфера для использования в дальнейших экспериментах.
Полученный нами ВКМ гидрогель имел нестабильную консистенцию. Это выражалось достаточно твердой желеобразной структурой непосредственно после гелеобразования, однако после хранения в холодильнике или резкой встряски он необратимо переходил в жидкое состояние. Мы предположили, что это могло быть вызвано избытком жидкости в его составе. Поэтому часть жидкости была удалена из геля при помощи центрифугирования в течение 5 мин при 14000 об/мин. В результате объем гидрогеля уменьшился вдвое, однако он стал более плотным.
Характеристики ВКМ гидрогеля в зависимости от состава
|
Компонент/состав |
Адгезивные свойства |
Плотность |
Гомогенность |
Стабильность |
|
2 % агар |
низкие, смесь не проявляла адгезивных свойств |
высокая |
высокая |
низкая, смесь расслоилась на фракции спустя некоторое время |
|
4 % альгинат натрия |
средние, легкое прилипание к поверхности |
низкая |
высокая |
высокая |
|
4 % альгинат натрия в присутствии ионов Ca2+ |
низкие, смесь не проявляла адгезивных свойств |
средняя |
низкая |
высокая |
|
6,4% альгинат натрия |
средние |
средняя |
высокая |
высокая |
|
1,6 % агар и 3,2 % альгинат натрия в фосфатном буфере |
высокие |
средняя |
высокая |
высокая |
Стоит отметить, что внеклеточный матрикс, подвергшийся измельчению в вибрационной шаровой мельнице, давал более гомогенный раствор после обработки пепсином нежели измельчённый при помощи режущей мельницы в предыдущих экспериментах.
Адгезивные свойства полученного гидрогеля были очень низкими, в связи с чем нами была предпринята попытка изменить консистенцию и адгезию гидрогеля добавлением дополнительных веществ.
Для этой цели были выбраны два кандидата, нейтральных, безопасных и широко используемых в косметологии, пищевой промышленности и медицине, а именно агар (#141792.1208, Panreac) и альгинат натрия (#A3249, AppliChem). Компоненты нагревали до 80 °С и перемешивали на шейкере при 1200 об/мин до полного растворения. Затем полученную смесь охлаждали до комнатной температуры и смешивали с ВКМ гидрогелем. Готовую смесь доводили до нужной концентрации фосфатным буфером.
Нами было опробовано несколько комбинаций состава и концентраций агара и альгината натрия, из которых смесь с объемным соотношением 1,6 и 3,2% соответственно показала наилучшие результаты по сравнению с другими вариантами (таблица). Мы также протестировали различные концентрации обоих загустителей. Также, согласно литературным данным, присутствие ионов кальция улучшает кинетику гелеобразования альгината натрия посредством сшивания его молекул между собой [11, 12]. Поэтому в одном из вариантов мы добавили небольшое количество хлорида кальция в раствор альгината натрия.
Как и ожидалось, концентрированные растворы (≥ 2 %) приводили к образованию плотных хрупких гелей, которые весьма затруднительно наносить на раневую поверхность, а более низкая концентрация приводила к очень текучим гелеобразным растворам, которые просто стекали с поверхности.
Мы считаем, что разработанный нами состав может стать основой для гелеобразных регенеративных материалов и может облегчить применение внеклеточного матрикса в медицине и ветеринарии.
Заключение
В данной статье мы описали быстрый и недорогой способ модификации гидрогелей на основе внеклеточного матрикса для придания им необходимых свойств, необходимых для их удобного и эффективного применения в ветеринарии и медицине. Нами было опробовано несколько комбинаций состава и концентраций агара и альгината натрия, среди них смесь с объемным соотношением 1,6 и 3,2 % соответственно показала наилучшие адгезивные свойства по сравнению с другими вариантами. В своих будущих экспериментах мы планируем протестировать другие возможные добавки и загустители, а также планируем проведение серии экспериментов с использованием клеточных культур и лабораторных животных, для выявления наиболее оптимальной формулы разрабатываемого регенеративного гидрогеля.
Библиографическая ссылка
Алексеев В.А., Мамаева С.Н., Павлова Н.И. ВЛИЯНИЕ ДОБАВОК НА АДГЕЗИВНЫЕ СВОЙСТВА ГИДРОГЕЛЕЙ НА ОСНОВЕ ВНЕКЛЕТОЧНОГО МАТРИКСА // Международный журнал прикладных и фундаментальных исследований. 2022. № 6. С. 7-11;URL: https://applied-research.ru/ru/article/view?id=13389 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13389

