Создание научно-технологических решений, обеспечивающих разработку высокотехнологичной и ускоренной, экологически безопасной, энергоэффективной технологии переработки органической фракции (ОФ) ТБО или БЧТБО в полезный продукт в виде биоорганического удобрения путем биотермокомпостирования на основе смешанной популяции микроорганизмов для уменьшения антропогенной нагрузки полигонов ТБО на окружающую среду, обусловлено снижением содержания разлагаемой органической фракции и использованием их для повышения плодородия почвы [1–5].
Учитывая, что в процессе компостирования принимают участие множество микроорганизмов из различных физиологических групп [6–8], выделение активных штаммов микроорганизмов, перспективных для утилизации органической фракции ТБО, проводили из разных экологических ниш (сточные воды, иловые осадки, почвы, перегнившие листья деревьев и молочнокислые продукты, навоз, свежие и ферментированные овощные и фруктовые продукты и т.п.). Также для проведения исследований отобраны штаммы из лабораторной коллекции микроорганизмов ТОО «Экостандарт.kz».
Материалы и методы исследования
Выделение микроорганизмов проводили из сточной воды, иловых осадков, навоза методом накопительных культур с применением различных видов жидких селективных и универсальных питательных сред (СПБ, MRS-1, Гетчинсона, Хоттингера, Эшби) с последующим пересевом на агаризованные среды методом Коха для изолирования отдельных клеток с целью получения чистых культур. Инкубацию культур производили в термостате при температурных режимах 22, 37 и 45 °С в течение 48–72 ч.
Результаты исследования и их обсуждение
Общее количество выделенных чистых культур составило 32 изолята, из них 4 – желтого цвета, 8 культур белого цвета и остальные – бежевого и кремового цвета.
С целью отбора активных культур, способных разлагать углеводы, белки и жиры, проводили изучение ферментативных свойств выделенных микроорганизмов по амилолитической, протеолитической, целлюлолитической и липазной активностям.
По результатам экспериментов способностью катализировать гидролиз крахмала обладали 11 выделенных изолятов. Культуры СПА СС-45 и Саб СС-45 показали высокую амилолитическую активность, образовав большие зоны гидролиза крахмала (табл. 1).
Наибольшей протеолитической активностью обладали следующие изоляты: СПА СС-45, СПА л-3-45, СПА л-2-37, MRS л-37, ЦБ1. Максимальные зоны гидролиза жиров наблюдали у изолята Саб-л-1-37.
Высокие показатели целлюлозолитической активности отмечены у изолята СПА СС-45. На основе проведенных исследований изоляты с наибольшей ферментативной активностью были отобраны для дальнейших исследований – СПА СС-45, СПА л-3-45, СПА л-2-37, MRS л-37, САБ СС-45, САБ л1-37 и ЦБ1. Также отобран изолят ЖКм, обладающий липазной, амилазной и протеазной активностями.
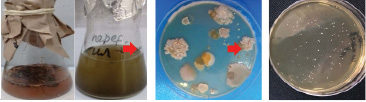
а) б) в)
Рис. 1. Выделение культур: а) накопительная культура б) высев на плотные среды в) чистая культура
Таблица 1
Биологические свойства изолятов и коллекционных штаммов
|
Изоляты |
Ферментативная активность (d, мм) |
Антагонистическая активность (d, мм) |
||||||
|
липаза |
амилаза |
протеаза |
целлюлоза |
E. coli |
Salmonella |
St. aureus |
Ser. marcescens |
|
|
СПА СС-45 |
2±0,6 |
16±1,4 |
18±1,6 |
8±0,8 |
6±1,4 |
6±1,4 |
0 |
8±0,8 |
|
СПА л-3-45 |
2±0,08 |
0 |
16±1,4 |
0 |
6±0,4 |
0 |
0 |
2±0,6 |
|
СПА л-2-37 |
0 |
3±0,8 |
18±0,8 |
0 |
5±0,8 |
0 |
0 |
0 |
|
MRS л-37 |
0 |
5±0,14 |
20±0,8 |
3±0,4 |
12±1,4 |
10±1,6 |
6±1,4 |
0 |
|
САБ СС-45 |
0 |
15±0,10 |
8±1,6 |
0 |
8±0,4 |
5±0,6 |
9±1,6 |
0 |
|
САБ л1-37 |
9±0,8 |
12±0,21 |
10±0,8 |
0 |
4±0,8 |
0 |
0 |
0 |
|
ЦБ1 |
4±1,6 |
9±0,12 |
17±1,4 |
0 |
0 |
5±08 |
0 |
3±0,8 |
|
ЖКм |
3±0,4 |
6±0,11 |
5±0,08 |
0 |
7±1,4 |
0 |
5±0,4 |
0 |
Таблица 2
Биологические свойства коллекционных штаммов
|
Коллекционные штаммы |
Ферментативная активность (d, мм) |
Антагонистическая активность (d, мм) |
||||||
|
липаза |
амилаза |
протеаза |
целлюлоза |
E. coli |
Salmonella |
St. aureus |
Ser. marcescens |
|
|
B. amyloliquefaciens И15 |
15±0,8 |
8±0,08 |
10±0,14 |
0 |
6±1,6 |
7±0,8 |
4±0,8 |
0 |
|
Bacillus coagulans П-1-5 |
0 |
19±0,11 |
19±2,2 |
0 |
8±1,4 |
10±0,8 |
11±1,4 |
4±0,4 |
|
B. licheniformis П-1-6 |
0 |
0 |
0 |
11±0,8 |
6±0,4 |
0 |
10±1,6 |
4±0,8 |
|
B. megaterium 3х сах-2/1 |
0 |
12±0,14 |
10±1,2 |
3±0,8 |
0 |
5±0,6 |
0 |
0 |
|
Lb. plantarum 21 |
0 |
10±0,16 |
0 |
0 |
15±1,4 |
10±1,4 |
10±1,4 |
6±1,4 |
|
Lb. plantarum 414 |
0 |
9±0,08 |
15±0,6 |
0 |
10±1,6 |
6±0,4 |
8±1,4 |
4±0,8 |
|
Lb. brevis 807 |
0 |
12±0,14 |
17±0,12 |
0 |
6±1,4 |
10±0,14 |
12±0,17 |
6±0,11 |
|
Weissela confusа Ш2-20 |
0 |
13±0,34 |
16±0,24 |
0 |
0 |
9±0,18 |
0 |
0 |
|
Enterococcus faecium 804 |
0 |
16±0,34 |
11±0,28 |
0 |
10±0,14 |
6±0,16 |
8±0,18 |
7±1,4 |
|
Ochrobactrum sp. 846 |
18±0,16 |
0 |
14±0,28 |
0 |
6±0,15 |
0 |
0 |
0 |
|
Ochrobactrum intermedium Ил-5 |
0 |
18±0,32 |
0 |
18±0,26 |
10±0,24 |
0 |
0 |
0 |
|
Rhodococcus erythropolis Ф1 |
14±0,18 |
12±0,23 |
8±0,31 |
3±0,18 |
8±0,14 |
0 |
0 |
4±0,21 |
Так как в ТБО могут содержаться болезнетворные микроорганизмы, нами проведены исследования по изучению способности отобранных изолятов к подавлению роста патогенных бактерий к тест-штаммам (Е. coli, St. aureus, Sal. typhimurium, Ser. marcescens). У всех оцениваемых культур за исключением изолята ЦБ1 антагонистические свойства были выражены по отношению к E. coli, к Salmonellа антагонистическую активность проявляли 4 изолята СПА СС-45, MRS л-37, САБ СС-45, ЦБ1. Рост штамма St. aureus подавляли изоляты MRS л-37, САБ СС-45 и ЖКм. По отношению к штамму Serratia антагонизм проявляли СПА СС-45, СПА л-3-45, ЦБ1.
Далее нами была произведена инвентаризация и отбор еще 12 коллекционных ферментативно активных штаммов (табл. 2) из лабораторной коллекции с целью улучшения состава разрабатываемого биологического препарата, который будет не только перерабатывать отходы, но и в результате позволит получить биоорганические удобрения хорошего качества, содержащие комплекс полезных микрооргнизмов.
Отбор коллекционных штаммов производили по наличию широкого спектра ферментативной активности. При этом отобранные культуры обладали хорошей протеолитической, амилолитической, жироокисляющей, целлюлолитической и антагонистической активностями.
Все отобранные выделенные чистые культуры и коллекционные штаммы были заложены на долгосрочное и краткосрочное хранение по ранее отработанным методам с целью проведения дальнейших работ.
С целью определения родовой и видовой принадлежности активных выделенных культур микроорганизмов были изучены их культурально-морфологические и биохимические свойства общепринятыми методами в соответствии с определителем Берджи, а также проведено определение нуклеотидных последовательностей генов по консервативному локусу 16S rDNA.
Микроморфология изолятов выявила наличие 4 грамотрицательных и 6 грамположительных крупных и мелких прямых палочек размером 0,5–2,5 х 1,2–10 мкм, с закругленными или обрубленными концами, расположенных одиночно, попарно или в цепочку. Кроме того, у всех изолятов клетки были подвижными, за исключением изолята Сабл1-37.
Одной из ключевых сторон фенотипирования является изучение культурально-морфологических свойств по признакам и по характеру роста культур на твердых агаризованных и жидких питательных средах. Также была изучена способность изолятов усваивать углеводы: арабиноза, галактоза, мальтоза, маннит, мелибиоза, трегалоза, фруктоза, адонит и сорбитол. Определена оксидазо-каталазная активность.
По фенотипическим признакам бактериальные изоляты были отнесены к следуюшим родам Bacillus, Brevibacillus, Lactobacillus, Saccharomyces, Acinetobacter, Pseudomonas. Один изолят был отнесен к дрожжам Saccharomyces.
Для определения видовой принадлежности изолятов была осуществлена идентификация методом определения прямой нуклеотидной последовательности фрагмента 16S rRNA гена, с последующим сравнением нуклеотидной идентичности с последовательностями, депонированными в международной базе данных Gene Bank (табл. 3).
Результаты генетической идентификации свидетельствуют о видовой принадлежности штаммов с гомологией нуклеотидной последовательности 98–100 %.
Таким образом, из различных источников (г. Нур-Султан) было выделено 32 культуры микроорганизмов. Для дальнейших исследований нами отобраны наиболее активные из выделенных изолятов, проявивших наибольшую ферментативную активность: СПА СС-45, СПАл 3-45, СПА л2-37, MRS л-37, САБ СС-45, САБ л1-37, ЦБ-1 и ЖКм. По результатам идентификации культуры были отнесены к разным родам и видам и идентифицированы как Brevibacillus borstelensis, Bacillus pumilis, Bacillus thermoamylovorans, Acinetobacter guillouiae, Pseudomonas stutzeri, Lactobacillus fermentum, Bacillus subtilis и Saccharomyces cerevisiae.
На следующем этапе исследований была проанализирована биосовместимость выделенных культур методом отсроченного антагонизма по отношению друг к другу, так как для создания консорциумов очень важно учитывать тип взаимоотношений между микроорганизмами.
Проведённые исследования показали отсутствие ингибирующего влияния исследуемых культур в отношении друг друга. Размер зоны задержки роста между штаммами находился в пределах 0,0–1,3 мм, что указывает на нормальное развитие микроорганизмов при совместном культивировании (рис. 2).
Все биосовместимые культуры были объединены в одну группу № 1: Bacillus thermoamylovorans Жкм, Acinetobacter guillouiae Сабл 1-37, Pseudomonas stutzeri ЦБ-1, Lactobacillus fermentum MRS л-37, Bacillus subtilis СПА СС-45 и Saccharomyces cerevisiae СабСС-45, Bacillus amyloliquefaciens И15, Bacillus coagulans П-1-5, Bacillus licheniformis П-1-6, Bacillus megaterium 3хсах-2/1, Lactobacillus plantarum 21, Lactobacillus plantarum 414, Lactobacillus brevis 807, Weissela confuse Ш2-20, Enterococcus faecium 804, Ochrobactrum intermedium Ил-5, Rhodococcus erythropolis Ф1.
Таблица 3
Идентификация выделенных изолятов
|
№ |
Изолят |
Наименование по фенотипу |
Наименование по генотипу 16S rRNA гена |
Процент гомологии, % |
|
1 |
СПА СС-45 |
Bacillus sp. |
Bacillus subtilis |
100 |
|
2 |
СПАл3-45 |
Brevibacillus sp. |
Brevibacillus borstelensis |
98 |
|
3 |
MRS л-37 |
Lactobacillus sp |
Lactobacillus fermentum |
99 |
|
4 |
СПАл2-37 |
Bacillus sp. |
Bacillus pumilis |
98 |
|
5 |
Сабл 1-37 |
Acinetobacter sp. |
Acinetobacter guillouiae |
100 |
|
6 |
ЦБ-1 |
Pseudomonas sp. |
Pseudomonas stutzeri |
99 |
|
7 |
ЖКм |
Bacillus sp. |
Bacillus thermoamylovorans |
98 |
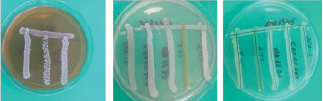
Рис. 2. Антагонистические отношения микроорганизмов

а) б) в) г)
Рис. 3. Опыт по переработке биологических отходов:а – компостер; б – до переработки; в – температура в процессе переработки; г – после компостирования
В группу № 2 вошли отдельные штаммы: Acinetobacter guillouiae Сабл 1-37, Pseudomonas stutzeri ЦБ-1, Lactobacillus fermentum MRS л-37, Bacillus subtilis СПА СС-45, Saccharomyces cerevisiae СабСС-45, Bacillus amyloliquefaciens И15, Bacillus coagulans П-1-5, Lactobacillus plantarum 414, Enterococcus faecium 804, Ochrobactrum Intermedium Ил-5 и Rhodococcus erythropolis Ф1. Таким образом, сформировано два консорциума микроорганизмов.
Оценку способности составленных консорциумов утилизировать органические субстраты, состоящие из пищевых и растительных остатков, проводили методом компостирования биологических отходов на приусадебном участке (рис. 3).
Степень и эффективность переработки органических отходов оценивали по изменению температуры компоста, кислотности, запаху и визуальному уровню разложения отходов.
Заключение
В результате проведенных исследований были выделены микроорганизмы для переработки твердых бытовых отходов методом компостирования. Скрининг активных культур бактерий проводили на основе изучения ферментативной способности. По результатам генетической идентификации культуры были отнесены к разным родам и видам и идентифицированы как Brevibacillus borstelensis, Bacillus pumilis, Bacillus thermoamylovorans, Acinetobacter guillouiae, Pseudomonas stutzeri, Lactobacillus fermentum, Bacillus subtilis и Saccharomyces cerevisiae.
Из отобранных штаммов микроорганизмов было составлено два консорциума из различных таксономических групп. В результате компостирования ОФТБО наилучшие показатели по визуальной оценке выявлены при использовании консорциума № 1, состоящего из 18 культур микроорганизмов, при этом продолжительность переработки составила 5 суток, повышение температуры компостной кучи отмечали на вторые сутки после внесения консорциума. Тогда как при использовании консорциума № 2 температура компоста повышалась на четвертые сутки и продолжительность переработки увеличивалась до 10 суток. По визуальной оценке переработанная консорциумом № 1 масса имела рыхлую однородную структуру, без запаха, темно-коричневого цвета и без неразложившихся остатков органической фракции. Исходя из полученных данных, по предварительной оценке, отобран консорциум № 1, состоящий из комплекса 18 полезных микроорганизмов.
Библиографическая ссылка
Хасенова Э.Ж., Уланкызы А., Токушев А.А., Данлыбаева Г.А., Тунгышбаева З.Б., Молдагулова Н.Б., Курманбаев А.А. ВЫДЕЛЕНИЕ И СКРИНИНГ АКТИВНЫХ ШТАММОВ БАКТЕРИЙ ДЛЯ ПЕРЕРАБОТКИ ТВЕРДЫХ БЫТОВЫХ ОТХОДОВ // Международный журнал прикладных и фундаментальных исследований. 2022. № 6. С. 22-26;URL: https://applied-research.ru/ru/article/view?id=13392 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13392

