Среди многочисленных известных композиций сплавы на основе никеля имеют ряд преимуществ. Кроме хорошей технологичности они обладают высокой жаропрочностью и коррозионной стойкостью в различных агрессивных средах, а также структурной устойчивостью в условиях радиационного воздействия. Отмеченное позволяет применять сплавы на основе никеля в существующих и перспективных конструкциях химического, авиакосмического и электронного машиностроения, а также для изготовления компонентов активной зоны термоядерных реакторов, использующих в качестве теплоносителей щелочные металлы в жидком состоянии [1, 2]. Обязательным легирующим элементом в таких сплавах является хром, обеспечивающий высокое сопротивление материалов окислению. Некоторые данные об этих элементах приведены в таблице.
Эволюционное развитие кластерной теории расплавов позволяет объяснять некоторые особенности изменения физических свойств металлических жидкостей, в частности расплавов никеля, хрома, их двойных и многокомпонентных композиций. Важно не просто определить параметры кластерной структуры жидкого металла в определенных условиях, необходимо учесть влияние температуры нагрева на них, рассмотреть взаимосвязь параметров и их изменения с поведением физических свойств сплавов. Именно эту задачу, установление взаимосвязи параметров кластерной структуры сплавов никеля с хромом в жидком состоянии и особенностей поведения физических свойств этих систем, ставят авторы работы, предпринимая попытку количественно описать наблюдаемые эффекты влияние состояния расплава на свойства готового твердого металла.
Материалы и методы исследования
В периодической системе Д.И. Менделеева никель и хром относятся к группе переходных элементов, отличительной чертой которых является частичное заполнение электронных d-орбиталей. Между собой они отличаются количеством валентных электронов, необходимых для обеспечения межатомного взаимодействия.
Кроме того, вследствие неизоморфности решёток (Cr – ОЦК), (Ni – ГЦК) при их сплавлении образуют ограниченные твёрдые растворы: γ-твёрдый раствор на основе никеля и α-твёрдый раствор на основе хрома. Диаграмма состояния сплавов на основе системы Ni − Cr относится к эвтектическому типу с температурой эвтектического равновесия 1345 °C.
Фазовый состав эвтектических композиций определяется условиями равновесия: Ж (расплав) = γ−фаза + α−фаза, т.е. из расплава кристаллизуются две обособленные фазы. Достоинство таких композиций в том, что фазовые составляющие материала близки к термодинамическому равновесию и на поверхностях раздела образуются прочные связи. Недостаток заключается в отсутствии возможностей регулирования объёмного соотношения фаз в формируемом сплаве [3].
Исключительно интересной и важной особенностью переходных металлов является их склонность к образованию интерметаллических соединений между собой и с другими металлами. Формирующиеся при этом фазы характеризуются упорядоченным расположением атомов и наличием областей гомогенности [4, 5].
Растворимость хрома в никеле при комнатной температуре близка к 20–22 мас. % Cr. Дальнейший рост концентрации хрома до 37 мас. % сопровождается выделением фазы Ni2Cr и связанным с этим изменением электронной плотности на границе атомных ячеек, что оказывает влияние на уровень физических и специальных свойств. Поэтому при разработке никель-хромовых композиций, обладающих структурой γ-твёрдого раствора при температурах эксплуатации изделий, возникает необходимость учета возможной гетерофазности.
Хром обладает высшим валентным состоянием +6, но слабые связи с остовом атомов способствуют их переходу в коллективизированное состояние. Поэтому атомные остовы хрома имеют внешние Р6-оболочки. Часть d-электронов никеля сохраняется на атомном остове, и у него нет внешней Р6-конфигурации.
При плавлении никеля и хрома характер химических связей не меняется, ближний порядок остаётся постоянным, а дальний исчезает из-за ослабления связей и возрастания роли тепловых колебательных движений. В атомном ряду Cr…Ni температура плавления, характеризующая сопротивление кристаллической решётки тепловым колебаниям, и теплота плавления снижается в соответствии с уменьшением химической валентности элементов, а следовательно, и количества коллективизированных электронов. Кроме того, при нагреве расплава до температур значительно превышающих температуру плавления tпл (~1850 ÷ 1900 °С) внешние s-электроны под влиянием теплового воздействия могут перейти в возбужденное состояние и изменить форму орбиталей, что способствует переходу расплава в устойчивое метастабильное состояние.
Известно, что полная энергия межатомного взаимодействия межатомных связей в металлах характеризуется, в частности, температурой кипения и теплотой испарения [6, 7]. По данным, приведённым в таблице, энергия межатомного взаимодействия выше у никеля, т.е. возможная атомизация элементов при кипении в отличие от процесса плавления определяется не их валентностью, а уровнем межатомного взаимодействия. Исчезновение дальнего атомного упорядочения при плавлении никеля и хрома происходит в результате сравнительно небольшого энергетического вклада в систему (ΔН ≈ 4 – 5 ккал/г∙ат∙град). Однако процесс испарения этих элементов осуществляется при увеличении энтальпии примерно в 20 раз. Последнее свидетельствует о высокой устойчивости ближнего упорядочения в широком интервале температур существования никеля и хрома в конденсированном состоянии, т.е. в виде расплава. Поэтому информация о том, что при нагреве металлических жидкостей до температур, превышающих tпл на 300–400 °C, происходит атомизация, и ионизация их структуры противоречит термодинамическим характеристикам, а также опубликованным данным масс-спектрометрического анализа различных веществ.
Эволюционное развитие представлений о структурировании металлических жидкостей изложено в различных обзорах (например [6, 8]). Важным аналитическим следствием является признание иерархической структуры расплавов, состоящей из взаимодействующих элементов: электронов, атомов и кластеров. Однако корпускулярно-волновая природа атомов и электронов, а именно принцип неопределённости не позволяет одновременно точно определить их координаты и импульс. В квантовой механике существует правило о неразличимости квантовых объектов, в соответствии с которыми атом не является твёрдой, жидкой и газообразной частицей, не несёт признаков агрегатного состояния, но обладает химическими признаками любого вещества [9]. Поэтому структурной единицей металлических расплавов является кластер, но его структура и свойства в значительной степени зависят от физико-химических особенностей атомной и электронной составляющих [8].
Кроме того, состояние систем частиц, при котором их относительное движение осуществляется в ограниченном пространстве, является объектом внимания учёных и специалистов в различных разделах макро- и микрофизики. По мнению академика В.Я. Файнберга и других, образование таких связанных систем осуществляется благодаря наличию сил притяжения на некоторых расстояниях между частицами. Известно, что в стабильных связанных состояниях масса образованной системы меньше суммы масс составляющих ее частиц. Разность Δm между ними определяет энергию связи системы εсв = Δm ∙ c2.
Таким образом, кластер как система частиц обязан своим существованием не только физико-химической природе ее элементов (атомов, электронов), но и энергетически выгодным условиям существования систем в связанном состоянии. Структурной единицей твёрдого вещества принято считать кристаллическую решётку или элементарную ячейку (Е.С. Фёдоров). В жидком состоянии, начиная с работ Г. Стюарта, в качестве структурных единиц рассматриваются микрогруппировки атомов, отличающиеся названием, но близкие по физическому смыслу. В 1940-х гг. появился часто цитируемый в настоящее время термин «кластер». Не претендуя на оригинальность и продолжая развитие квазихимической модели макронеоднородного строения металлических жидкостей профессора Б.А. Баума [8, 10] под термином кластер понимаем следующее: кластер – это единый в природе элемент конденсированного состояния вещества, представляющий собой ассоциацию упорядоченных атомов, связанных межчастичным взаимодействием и совершающих согласованные тепловые колебания.
Термодинамическая оценка состояния веществ осуществляется путём анализа термодинамического потенциала Гиббса, связанного с энтальпией и энтропией уравнением G = H – T ∙ S. Однако практически изучается их изменение, например, в процессе плавления или испарения. Данные о потенциалах большинства металлов приводятся в различных изданиях, а о никеле и хроме и в нашей таблице.
Характер изменения энтальпии при плавлении и испарении рассмотрен выше. Что же касается энтропии, то ее изменение при плавлении Ni и Cr отличается незначительно, тогда как при испарении атомное разупорядочение никеля по сравнению с хромом оказалось существеннее.
Экспериментальные определения термодинамических параметров веществ весьма трудоёмки, да и погрешности велики. Поэтому большое развитие получили методики анализа и расчета, а также методы машинного моделирования. В поисках источника информации, необходимой для изучения концентрационной зависимости термодинамических показателей сплавов системы Ni – Cr, выполнили глубокую проработку профильных изданий и остановились на методике, изложенной в [11, 12]. Необходимые компоненты для расчета: химический состав, координационное число и параметр взаимодействия или энергия взаимодействия пар атомов (W). Рассчитанные значения привели к уровню значений сплава Ni + 1 мас. % Cr. Такой приём в термодинамике известен и используется для ускоренного наглядного понимания тенденции протекающих процессов и позволяет избежать ряда процедурных ошибок.
Основные характеристики Ni и Cr
|
Элемент |
Изменение теплоты, ккал/г∙ат∙град |
Tпл, °C |
Tисп, °C |
Плотность D20, кг/м3 |
Атомный радиус, Ȧ |
Электро- отрица- тельность |
Шкала Луи Бенсона |
Теплоемкость при 1600 °C Cp, ккал/моль∙град |
||
|
ΔHпл |
ΔHисп |
электро- отрица- тельность |
ковалентный радиус, Ȧ |
|||||||
|
Ni |
4,2 |
94 |
1455 |
2897 |
8963 |
1,27 |
1,8 |
1,92 |
1,04 |
9,2 |
|
Cr |
4,6 |
83 |
1875 |
2680 |
7190 |
1,24 |
1,4–1,6 |
1,72 |
1,16 |
9,4 |
Результаты исследования и их обсуждение
Графически зависимость энтальпии и энтропии имеет экспоненциальный вид, возрастающей по абсолютным значениям функцией с увеличением концентрации в сплавах хрома до 45 мас. %. В этих же координатах функция ΔG увеличивается, а ΔW уменьшается линейно с изменением угла наклона к оси абсцисс в точке, соответствующей содержанию хрома в сплаве ~20 мас. % (рис. 1).
Таким образом, с увеличением доли атомов хрома в сплавах системы Ni – Cr заполняемость электронами d-оболочек уменьшается, снижается и энергетический потенциал межатомного взаимодействия, растёт энтропия системы, так как повышается хаотичность в размещении атомов по объёму. Особенность взаимодействия атомов никеля и хрома вблизи аномальных точек на рис. 1 соответствует рассмотренным выше концентрационным ситуациям, способствующим, в частности, уменьшению растворимости хрома в никеле и появлению фазы Ni2Cr.
Термодинамика консервативна, и ее постулат (Гиббса закон), что любая система должна состоять как минимум из двух фаз, во все времена остаётся непоколебимым. Возражающих нет, но есть два направления развития этого положения.
Во времена И. Ньютона роль пространства в строении вещества рассматривалась на уровне макромира. Затем появилось понятие свободного объема, но уже внутри вещества, и использовалось это понятие как вспомогательный структурный элемент. В частности, А. Эйнштейн считал, что пространство – это физический объект, составляющий неразрывное единство с веществом, и предполагал их взаимодействие и взаимовлияние в любых агрегатных состояниях. По мнению А.И. Вернадского, взаимосвязь вещества и пространства состоит в том, что каждому состоянию вещества неизбежно соответствуют определённые пространственные структуры [9].
Однако, несмотря на отсутствие конкретной информации, идея о взаимосвязи вещества и пространства оказалась фундаментальной для дальнейшего развития теории фазового перехода при плавлении и затвердевании, а также понимания естественных аспектов взаимосвязи элементов структуры металлов, находящихся в «твёрдом – жидком – твердом» состояниях.
Результаты экспериментальных исследований дефектов в кристаллах дали основание В. Шоттки, Я.Н. Френкелю, Б.Я. Пинесу и Я.Е. Гегузину рассматривать вакансии в кристаллической решетке как термодинамически равновесный пространственный компонент структуры. При нагреве вещества вакансии генерируют, и их объём при температурах плавления приближается к 1,5 %.
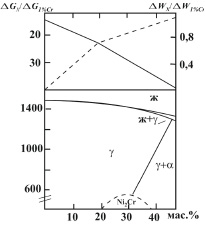
Рис. 1. Влияние концентрации хрома в Ni, Cr расплавах на относительные величины изменения энергии Гиббса (ΔGx / ΔG1%Cr) и энергии межатомного взаимодействия (ΔWx / ΔW1%Cr) при температуре 1600 ºС
Другое научное направление моделирования структуры расплавов рассматривает межкластерное пространство как фазу, состоящую из таких же атомов, что и кластер, но невзаимодействующих между собой. Однако такой подход нарушает правило фаз, сформулированное Гиббсом: одни и те же атомы не могут образовывать две разные фазы в одном агрегатном состоянии.
Оригинальная модель структуры металлических жидкостей, предложенная профессором И.В. Гаврилиным, в которой второй структурной составляющей предполагается рассматривать межкластерные разрывы, образующиеся в результате тепловых колебаний кластеров [9]. Математический аппарат модели, позволяющий изучить влияние температуры и химического состава на параметры структуры, разработан на основе данных о геометрии ближнего порядка, сведений о теплоёмкости, изменений теплоты плавления и испарения веществ.
Параметрами кластерной структуры является его радиус – rкл, среднее количество атомов в кластере – nат, количество атомов в грамм-атоме или моле – Nкл, единичные Sе и суммарные ΣSе площади межкластерных разрывов, объём межкластерного пространства – ΔVр и количество активированных атомов – Ca, имеющих как минимум одну степень свободы и входящих в состав кластеров на границе раздела «кластер – межкластерное пространство». Благодаря такому параметру осуществляется постоянная взаимосвязь между кластерами по всему объёму расплава.
Температурные зависимости рассчитанных структурных параметров жидкого никеля приведены на рис. 2. Аналогичный вид имеют политермы параметров сплавов никеля с хромом. Оказалось, что особенности электронной структуры никеля и хрома существенно влияют на формирование структуры их сплавов. Так, например, после плавления наибольшим радиусом обладают кластеры никеля ~14Ȧ.
Такой результат хорошо согласуется с данными наших дифракционных исследований и расчётов, выполненных по методике Гурова – Боровского.
С повышением концентрации хрома в сплавах энергия межатомного взаимодействия и радиусы кластеров уменьшаются, снижается и интенсивность изменения параметров при нагреве (рис. 3). При этом в температурном интервале от tпл до (tпл+250 °C) величина drкл / dt уменьшается в ряду Ni +….. + 45 масс % Cr практически в два раза.
Особый интерес, по нашему мнению, представляют отклонения политерм параметров структуры, от линейных либо другого вида зависимостей, построенных в логарифмических координатах, к оси абсцисс выше 190 °C т.е. при величине радиусов кластеров ≤ 7Ȧ. По данным авторов работ [13–16] нанокристаллические вещества с такой размерностью обладают иными свойствами.
Легирование никеля атомами хрома, сопровождающееся заполнением электронами 3d-оболочек, приводит к нестабильности взаимодействия S- и d-электронных уровней. В результате реально существует переход атомно-электронной системы в энергетически возбужденное, т.е. метастабильное состояние. Этому способствует повышение температуры и связанное с ним увеличение частоты и амплитуды колебаний элементов системы, а также возрастание роли трансляционных процессов. Последнее повышает вероятность равновесного распределения атомов в кластерах и кластеров по объёму расплава. Следствием отмеченного является выравнивание полей напряжений и уменьшение их влияния на структуру ближнего упорядочения [4–6, 13].
При температурах выше 1900 °C и минимизации радиуса кластеров ниже 7 – 10Ȧ продолжительность существования системы в метастабильном или возбужденном состоянии увеличивается и возрастает температурный интервал при охлаждении.
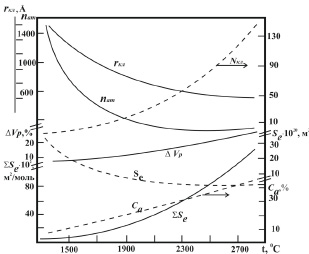
Рис. 2. Политермы кластерной структуры жидкого никеля
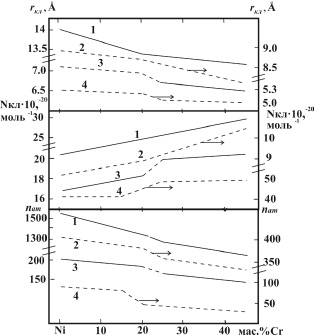
Рис. 3. Влияние концентрации хрома в сплавах системы Ni – Cr на величину кластеров (rкл), их количество в одном моле (Nкл) и среднее количество атомов в кластере (nат) при температурах плавления (1), 1700 (2), 1900 (3) и 2200 ºС (4)
Заключение
В научных публикациях такие изменения состояния системы нередко связывают с фазовым переходом второго рода «жидкость – жидкость» (LLT), и такое мнение не вызывает сомнений и возражений.
Аналогичные структурные особенности мы многократно наблюдали при исследовании промышленных сталей и сплавов, в том числе и сплавов на никель-хромовой основе [8, 17, 18]. Однако наше внимание в большей степени привлекали проблемы взаимосвязи твёрдого и жидкого металлических состояний. В результате выполненных исследований удалось установить исключительное влияние структурных изменений расплава на процесс затвердевания и формирование эксклюзивных свойств специальной металлопродукции. Таким образом, создавалась научно обоснованная технология плавки с элементами термовременной обработки жидкого металла, получившая признание в мировой практике.
Библиографическая ссылка
Тягунов Г.В., Тягунов А.Г., Барышев Е.Е., Вандышева И.В., Зайцева Н.А., Шмакова К.Ю., Вандышев Д.Н. О НИКЕЛЕ И ХРОМЕ И ИХ СПЛАВАХ // Международный журнал прикладных и фундаментальных исследований. 2022. № 8. С. 56-62;URL: https://applied-research.ru/ru/article/view?id=13427 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13427

