Современные достижения в терапии злокачественных новообразований позволили существенно увеличить продолжительность жизни пациентов. Такая ситуация способствует росту риска развития долгосрочных осложнений, таких как вторичные опухоли [1]. Известно, что из всех специальных методов лечения лучевая терапия вносит основной вклад в развитие различных по гистогенезу вторичных злокачественных опухолей, включая саркому мягких тканей [2].
Радиационно-индуцированная саркома определяется как ятрогенное заболевание, связанное с предшествующей лучевой терапией, с частотой встречаемости менее 1 %. Латентный период с момента окончания лечения по поводу первичной опухоли до развития вторичной саркомы колеблется от 7 до 16 лет [3, 4]. Однако, по данным других авторов, это время может колебаться от нескольких месяцев до 60 лет [5]. Среди радиационно-ассоциированных сарком наиболее распространенным гистологическим вариантом является недифференцированная/неклассифицированная саркома мягких тканей, а затем ангиосаркома [6]. Ангиосаркома – редкая опухоль мягких тканей эндотелиального клеточного происхождения с плохим прогнозом [7]. Большинство ангиосарком возникают спонтанно. Изначально клинические симптомы обычно представлены появлением отека и болезненности мягких тканей в области облучения и пурпурно-красных папул, которые могут быть ошибочно приняты за доброкачественные новообразования. Это приводит к поздней диагностике.
Цель – представить редкий случай радиационно-индуцированной саркомы средостения после лучевой терапии по поводу лимфомы Ходжкина.
Материалы и методы исследования
Под наблюдением находилась 40-летняя пациентка, которой в 2004 г. по поводу лимфомы Ходжкина IIIA стадии с поражением шейных и подключичных лимфатических узлов справа, лимфоузлов брюшной полости проведено химиолучевое лечение с достижением полной клинико-гематологической ремиссии на протяжении 17 лет.
Результаты исследования и их обсуждение
Пациентка М., 40 лет, с января 2021 г. стала отмечать боли в крупных суставах, деформацию грудины, быструю утомляемость. Появилась отечность мягких тканей в области шеи справа с переходом на переднюю поверхность грудной клетки. Из анамнеза известно, что в 2004 г. больная получала лечение по поводу болезни Ходжкина стадия IIIA с поражением шейных и надключичных лимфатических узлов справа, средостения с лимфоидным преобладанием. Проведено три цикла полихимиотерапии по схеме ABVD с последующей лучевой терапией на лимфоузлы шеи и средостение. СОД 40 Гр. По достижении клинико-гематологической ремиссии длительно находилась под динамическим наблюдением.
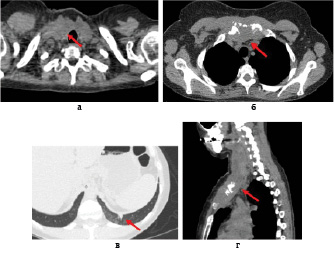
Рис. 1. Больная Б., 40 лет. СКТ органов грудной клетки. На аксиальных (а, б) и сагиттальной (г) КТ проекциях определяется мягкотканное образование неоднородной структуры за счет гиподенсивных участков, литически разрушающее рукоятку грудины с распространением на мягкие ткани шеи и передней грудной стенки справа. На аксиальной КТ проекции (в) в нижней доле левого легкого выявлено очаговое образование размером 9х5 мм
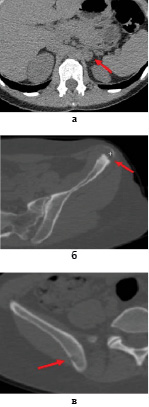
Рис. 2. Больная Б., 40 лет. СКТ органов брюшной полости (а) и органов малого таза (б, в). На аксиальной проекции (а) в медиальной ножке левого надпочечника определяется мягкотканное образование размером 16х13 мм, однородной плотности. На аксиальных КТ проекциях (б, в) в крыле подвздошной кости слева и в теле подвздошной кости справа определяются очаги литической деструкции с мягкотканным компонентом
При объективном исследовании в надключичной области справа с переходом на переднюю поверхность шеи и грудную стенку, с деформацией рукоятки грудины, имеется отечность мягких тканей с участками гиперемии. При пальпации в мягких тканях которой определяется округлое болезненное образование размером 3х4 см без четких границ. Справа выявлены увеличенные передние шейные лимфатические узлы метастатического характера.
Выполнена СКТ органов грудной клетки. Кроме того, в передне-верхнем средостении выявлено мягкотканное образование, общим размером 42х91х63 мм, без четких контуров, распространяющееся от щитовидного хряща справа до верхней границы тела грудины. Кроме того обнаружены вторичные поражения – очаг в левом легком, а также в Th10, поперечном отростке Th5 справа и головке правой плечевой кости (рис. 1).
С целью морфологической диагностики была выполнена шейная лимфаденэктомия. При гистологическом исследовании выявлено злокачественное новообразование без уточнения гистогенеза. Для чего препараты были пересмотрены в федеральном центре. При гистологическом и иммуногистохимическом исследовании установлено, что опухоль имеет строение эпителиоидной ангиосаркомы G3, ассоциированной с лучевой терапией.
Для уточнения распространенности опухолевого процесса была выполнена СКТ органов брюшной полости и малого таза. В медиальной ножке левого надпочечника определяется мягкотканное образование размером 16х13 мм, однородной плотности, метастатического характера. Наряду с этим были выявлены метастазы в забрюшинных лимфоузлах и костях скелета: крыле левой и правой подвздошной костях, большом вертеле левой бедренной кости (рис. 2).
Пациентка консультирована в Федеральном центре. Установлен диагноз – эпителиоидная саркома ст. IV сT2N1M1G3 с поражением средостения, мягких тканей и лимфоузлов шеи, метастазами в кости скелета, левый надпочечник и левое легкое. Ввиду распространенности опухолевого процесса назначена полихимиотерапия по схеме: доксорубицин + ифосфамид с остеомодифицирующими препаратами.
Результаты исследования и их обсуждение
За последние несколько десятилетий, благодаря достижениям в лечении, лимфома Ходжкина стала одной из наиболее излечимых злокачественных опухолей. При этом пятилетняя выживаемость превышает 85 %. Тем не менее эта когорта пациентов составляет один из самых высоких рисков развития вторых и последующих злокачественных опухолей, которые являются основной причиной смертности.
К факторам риска развития радиационно-индуцированных злокачественных опухолей относят: предшествующее лечение (лучевая и химиотерапия), возраст, воздействие окружающей среды и образа жизни (курение), а также генетическую предрасположенность. При этом лучевая терапия является основным фактором риска [8]. Существует тесная взаимосвязь между увеличением дозы облучения до 40 Гр и более, с последующим ростом частоты вторичных опухолей. При этом рак легкого у них является наиболее распространенной опухолью с длительностью латентного периода 5–9 лет [9].
По данным литературы, продолжительность жизни пациентов при радиационно-индуцированных саркомах низкая. Так, по данным P. Chang и соавт. (2017) пятилетняя выживаемость больных, получавших лечение по поводу различных сарком, значительно меньше таковой при спорадических вариантах (составляя 38,6 % и 52,6 % соответственно). Различия статистически достоверны. Такая ситуация, по мнению авторов, обусловлена невозможностью повторного применения лучевой терапии [10].
Саркомы, ассоциированные с лучевой терапией, могут возникать не только в облучаемой кости, но и в мягких тканях. Среди гистологических вариантов наиболее распространенными являются ангиосаркомы и неклассифицированная или недифференцированная плеоморфная саркомы, а также другие варианты, такие как остеосаркомы, рабдомиосаркомы. Причем чаще всего ангиосаркомы локализуются в области конечностей, туловища и головы и шеи [11].
Радиационно-индуцированные саркомы развиваются у 1 % пациентов, получавших лечение с применением лучевой терапии [4]. Латентный период, исчисляемый как время от окончания лечения первичной опухоли до диагностики второй, при радиационно-индуцированных саркомах составляет от 8 до 15 лет [12].
Различные методы визуализации важны для диагностики, определения степени распространенности опухолевого процесса и диспансерного наблюдения при злокачественных новообразованиях, ассоциированных с лучевой терапией.
После лечения первичной, особенно распространенной опухоли, роль КТ и МРТ неоспорима в процессе динамического наблюдения. Появление любой опухоли, как в зоне облучения, так и в других тканях и органах, следует расценивать как подозрение на второй рак, поскольку специфические признаки, характерные для вторых опухолей, отсутствуют. Применение гибридных технологий – ПЭТ/КТ с 18-фтордезоксиглюкозой позволяет выявить минимальные скрытые опухолевые проявления, которые невозможно идентифицировать с помощью КТ и МРТ [13].
Радиационно-индуцированные саркомы обладают агрессивным течением, а также низкой чувствительностью к химиотерапии. В связи с этим основным методом лечения является радикальное хирургическое вмешательство с достижением отрицательных краев. Однако анатомическая локализация опухоли, как правило, в области лучевой мишени, инфильтративный характер роста и глубина залегания не всегда позволяют осуществить эту опцию. Кроме того, в случае возможности таковой требуется выполнение широких и атипичных резекций, порой сопровождающихся косметическими дефектами и функциональными нарушениями [14]. В связи с изложенным предлагается разумный мультимодальный терапевтический подход, включающий комбинацию этих методов, в том числе и адекватное повторное облучение, включая неоадъювантный вариант [15].
Заключение
Радиационно-индуцированные злокачественные опухоли возникают как поздние ятрогенные осложнения применения лучевой терапии после различного по длительности латентного периода – от 3 до 60 лет. Эти опухоли имеют различную клиническую картину и гистогенез, что создает определенные трудности для диагностики и особенно рационального лечения. Саркомы, ассоциированные с лучевой терапией, обычно имеют плохой прогноз, особенно при опухолях высокой степени злокачественности и глубоком их расположении.
Хирургическое лечение радиационно-индуцированных опухолей является предпочтительным методом, однако возможности его ограничены из-за анатомических особенностей тканей, обусловленных предшествующим лечением. Кроме того, чувствительность данных образований к химиотерапии весьма ограничена.
Методы медицинской визуализации играют важную роль в диагностике, установлении распространенности процесса и последующем диспансерном наблюдении за саркомой. Среди них наибольшее значение принадлежит РКТ, МРТ и гибридной технологии ПЭТ/КТ.
Библиографическая ссылка
Огнерубов Н.А., Антипова Т.С., Караваева Г.С. РАДИАЦИОННО-ИНДУЦИРОВАННАЯ АНГИОСАРКОМА СРЕДОСТЕНИЯ ПОСЛЕ ЛЕЧЕНИЯ ЛИМФОМЫ ХОДЖКИНА // Международный журнал прикладных и фундаментальных исследований. 2022. № 10. С. 35-39;URL: https://applied-research.ru/ru/article/view?id=13453 (дата обращения: 14.01.2026).
DOI: https://doi.org/10.17513/mjpfi.13453

