Позитронная эмиссионная томография (ПЭТ) – наиболее информативный метод медицинской визуализации, основанный на использовании радиофармпрепаратов (РФП), содержащих в своем составе короткоживущие радиоактивные изотопы с позитронным типом распада (15O, 11C, 13N, 18F) [1]. В настоящее время ПЭТ является незаменимым методом для диагностики различных типов опухолей, а также используется в кардиодиагностике, неврологии и при оценке эффективности терапии. Большинство клинически используемых РФП представляют собой простые молекулы (сахара, аминокислоты, нуклеотиды и др.) [2], меченные фтором-18 – наиболее широко используемым ПЭТ радионуклидом, что обусловлено его практически «идеальными» характеристиками. Малый пробег испускаемых позитронов в ткани (2,4 мм) обеспечивает максимальное пространственное разрешение ПЭТ изображения. Относительно большой период полураспада 18F (110 мин) совместим с длительными протоколами ПЭТ исследования. Кроме того, ввиду большого периода полураспада возможен сложный многостадийный синтез самых разных РФП, поставляемых на достаточно большие расстояния. Методы синтеза этих РФП, в основном предназначенных для онкодиагностики, разрабатывались в течение многих лет, что привело к созданию эффективных радиохимических технологий их производства в десятках клинических доз за один синтез в коммерчески доступных автоматизированных модулях синтеза [3]. Вместе с тем для расширения диагностических возможностей метода необходимы новые РФП на основе сложных биологически активных соединений. Синтез таких меченых соединений, как пептиды, протеины, биополимеры и др., невозможен с помощью классических радиохимических методов, основанных на прямом введении радионуклида реакцией нуклеофильного радифторирования, требующей жестких условий. Тенденцией последних лет является разработка методов так называемого «непрямого» введения метки фтор-18 в определенное положение сложных биологически активных молекул [4]. Это достигается процессами конъюгации радиоактивных синтонов (получение которых является первым этапом радиохимического синтеза) с целевой молекулой, протекающими в мягких условиях. Несмотря на достаточно большое количество уже известных радиосинтонов [4] разработка новых меченых фтором-18 молекул является активной областью исследований. Так, перпективными синтонами являются нитрилоксиды, которые по реакции [3+2]-циклоприсоединения к биомолекулами с двойной и тройной связью обеспечивают возможность получения целого ряда РФП [5]. Основной проблемой применения радиосинтонов на основе нитрилоксидов является сложный радиохимический синтез, плохо поддающийся автоматизации.
В данной работе нами был разработан эффективный метод синтеза нового радиосинтона – 6-[18F]фторникотиннитрил оксида ([18F]FNNO). Преимуществом разработанной нами методики является возможность проведения этого трехстадийного синтеза в одном реакторе, минуя промежуточные очистки и выделения, что существенно упрощает автоматизацию и сокращает время радиоактивного процесса. В свою очередь, использование предложенного метода позволит более широко использовать [18F]FNNO в последующем синтезе различных РФП.
Материалы и методы исследования
Исходное соединение N,N,N-триметил-5-(карбонил)пиридин-2-аммоний трифторметансульфонат (I) и стандарт для идентификации 6‐[18F]фторникотинальдегида были предоставлены Б.Д. Златопольским, Институт радиохимии и экспериментальной молекулярной визуализации, Германия. Безводный трет-бутанол и Iodo-Gen (1,3,4,6-тетрахлор-3α,6α-дифенилглюкорил) были приобретены в Sigma-Aldrich (США). Безводный не содержащий следов кислоты ацетонитрил (max 10 ppm H2O) был приобретен в «Криохром» (Россия). Картриджи Chromafix 30PS-HCO3 были приобретены в Macherey-Nagel (Германия) и использованы без кондиционирования.
Для аналитической ВЭЖХ использовали хроматограф Dionex ISC-5000 (США), снабженный градиентным насосом с возможностью смешения четырех элюентов, дозатором Rheodyne с петлей объемом 20 мкл, УФ-детектором (254 нм) и последовательно соединенным с ним детектором по радиоактивности Carrol and Ramsey Associates, CA, USA, model 105-S. Идентичность, радиохимическая и химическая чистота продуктов реакции были установлены при использовании следующих условий: ВЭЖХ колонка – X-Bridge C18, 150 × 4,6 мм (Waters), элюент: смесь трифторуксусной кислоты (0,1 %) с ацетонитрилом, градиентное элюирование, скорость потока 2,0 мл/мин. Градиент: 0–8,0 мин линейное увеличение CH3CN от 5 до 95 %; 8,0–11.0 мин 95 % CH3CN; 11,0–11,2 мин линейное уменьшение CH3CN от 95 до 5 %; 11,2–15,0 мин 5 % CH3CN. Времена удерживания Rt для 6‐[18F]фторникотиновогоальдегида (18F]FNA), [18F]фторникотиноксима ([18F]FNO) и [18F]фторникотинимидоил хлорида ([18F]FNImCl) составляли 2,9; 3,1 и 4,4 мин соответственно.
Анализ продуктов первой стадии процесса выполняли методом радиотонкослойной хроматографии (радио-ТСХ) с помощью радио-ТСХ сканера Scan-RAM (LabLogic, Sheffield, Великобритания) на пластинах с силикагелем 60 F254 («Сорбфил», «Ленхром», Россия), ТСХ элюент – этилацетат. Rf для [18F]фторида и [18F]FNA составили 0,05 и 0,55 соответственно.
[18F]Фторид был получен ядерной реакцией 18O(p,n)18F при облучении [18O]H2O (97 % обогащения, «Глобальные научные технологии», Сосновый Бор, Россия) в серебряной водной мишени (1,4 мл) циклотрона PETtrace 4 с энергией протонов 16.4 MeV (GE Healthcare, Швеция). По окончании облучения облученная [18O]H2O, содержащая [18F]Фторид, была доставлена током гелия из мишени в модуль синтеза, где радионуклид сорбировался на анионообменном картридже.
Результаты исследования и их обсуждение
Впервые меченное фтором-18 производное нитрилоксида, 4-[18F]фторнитрил оксид (4-[18F]FNNO), было предложено группой немецких ПЭТ-радиохимиков [5]. Данный подход был основан на многостадийном синтезе, где в качестве исходного меченного фтором-18 соединения предлагался 4-[18F]фторбензальдегид (4-[18F]FBA). Однако ввиду большого количества стадий, включая и промежуточные стадии очистки и выделения продуктов реакции, метод не был автоматизирован и не получил практического применения. Ввиду высоких уровней радиоактивности при работе с фтором-18 автоматизация синтеза является обязательным условием производства РФП. Идеальным для автоматизации вариантом является проведение всех стадий в одном сосуде – реакторе, без выделения продуктов реакции, что не всегда представляется возможным.
В цитируемой работе [5] 4-[18F]FBA получали по традиционной методике, реакцией нуклеофильного радиофторирования предшественника с триметиламмоний трифлатной уходящей группой. Согласно стандартному протоколу для выделения фтора-18 из облученной воды-18O радионуклид сорбировали на анионообменной смоле (картридже) и элюировали раствором основания – K2CO3 и криптофикса (межфазного катализатора – МФК) в смеси MeCN-H2O. Поскольку реакция нуклеофильного фторирования требует безводных условий, после удаления растворителей реакционную смесь подвергали азеотропной осушке, обеспечивающей удаление следов воды. Этот процесс сопровождается потерями радиоактивности не только за счет распада радионуклида (10–15 мин), но и в результате необратимых потерь на стенках реакционного сосуда. Необходимость азеотропной осушки увеличивает время синтеза и создает проблемы в автоматизации процесса. В связи с этим в последние годы огромные усилия направлены на создание методов, исключающих эту стадию путем подбора различных МФК, растворителей, типов анионообменной смолы и картриджа и др., с учетом конкретных условий и химической природы предшественника, участвующего на следующей стадии нуклеофильного фторирования.
В качестве исходного соединения для синтеза меченного фтором-18 нитрил оксида нами впервые был предложен 6-[18F]фторникотинальдегид ([18F]FNA), получаемый реакцией радиофторирования предшественника, N,N,N-триметил-5-(карбонил)пиридин-2-аммоний трифлата (I, рис. 1).
Для введения фтора-18 в молекулу I нами был использован так называемый «минималистический подход» [6], не требующий применения МФК и позволяющий элюировать сорбированный на одноразовом аниононобменном картридже [18F]фторид раствором предшественника I. Благодаря структурным особенностям исходного I, где в орто-положении находится азот, активирующий замещение уходящей триметиламмониевой группы, реакция радиофторирования может проводиться непосредственно на анионообменном картридже, в режиме онлайн в процессе элюирования. Метод радиофторирования на картридже впервые был предложен в 2016 г. [7] для синтеза, широко используемого радиосинтона, 2,3,5,6 – тетрафторфенил 6-[18F]фторникотината. Метод также применим и к синтезу радиофторникотинового бензальдегида [8]. В нашем случае высокая эффективность радиофторирования (радиохимическая конверсия – РХК – 99 %) в синтезе [18F]FNA (рис. 1, стадия 1) достигалась в процессе элюирования [18F]фторида, сорбированного на анионообменном картридже PS-HCO3 (45 мг), раствором I в смеси tBuOH/MeCN. Высокая степень конверсии была подтверждена методом радиоТСХ (рис. 2).
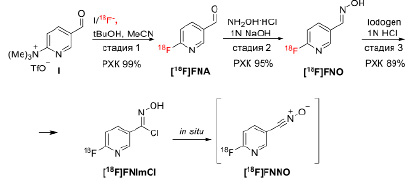
Рис. 1. Синтез радиоактивного синтона – 6-[18F]фторникотиннитрил оксида
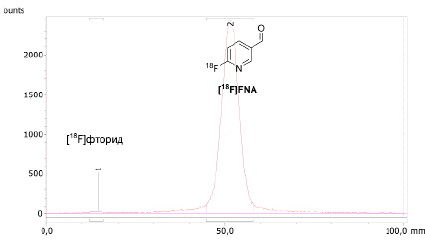
Рис. 2. РадиоТСХ анализ реакционной смеси на стадии радиофторирования (получение [18F]FNA); элюент – этилацетат
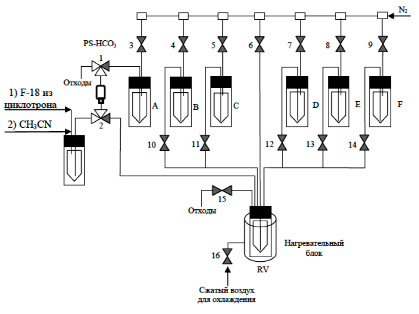
Рис. 3. Блок-схема дистанционно управляемого модуля. A: раствор предшественника (32 мкмоль) в tBuOH/MeCN (0,2/0,8 мл); B: NH2OH*HCl (40 мкмоль) в MeOH (0,25 мл) и 1N NaOH (мкл); C: 1N HCl (15 мкл) in MeCN (0,2 мл); D: Iodo-gen (12 мкл) в MeCN (0,3 мл).
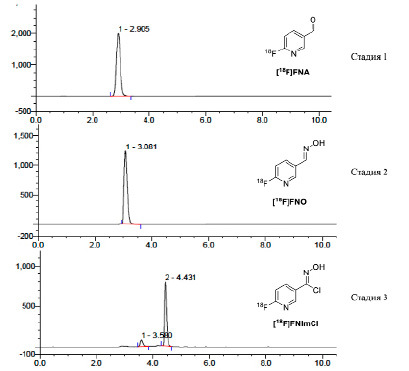
Рис. 4. РадиоВЭЖХ анализ реакционной смеси на первой, второй и третьей стадиях синтеза
Важно, что процессы сорбции [18F]фторида и элюирования [18F]FNA осуществлялись в противоположных направлениях, что обеспечивало дополнительное увеличение эффективности элюирования (ЕЕ) [9]. Критичным для данной стадии является то, что для достижения высокой ЕЕ продукта радиофторирования необходимо обеспечить медленный поток элюента через картридж регулировкой скорости подачи газа-носителя (азота). Синтез проводили на дистанционно управляемом модуле (рис. 3) собственной разработки; в этом случае ЕЕ составляла около 80 %.
Следует отметить и роль анионообменного картриджа (тип смолы и ее количество; конструкция картриджа). Проведенное нами исследование показало, что в отличие от используемого нами картриджа PS-HCO3 (45 мг), эффективность элюирования с применением «классических» картриджей QMA (46 мг или 130 мг) [3] не превышала 20 %. Таким образом, использование предложенного нами никотинового альдегида I на первой стадии получения целевого нитрилоксида позволило существенно упростить процедуру радиоактивного синтеза за счет возможности проведения элюирования предшественником I, а также проведению радиофторирования на картридже. Кроме того, при таком подходе нет необходимости в проведении длительной стадии азеотропной осушки.
Вторая стадия, конверсия [18F]FNA в соответствующий оксим [18F]FNO (рис. 1, стадия 2) реакцией с гидроксиламин гидрохлоридом (40 °С, 10 мин), протекает в том же реакторе с РХК > 95 %. Для проведения третьей стадии – получения радиофторированного имидоилхлорида [18F]FNImCl реакцией [18F]FNO с йодогеном (рис. 3, стадия 3) необходимо перед добавлением последнего нейтрализовать реакционную массу добавлением водного раствора соляной кислоты. Следует отметить, что обычно реакцию с йодогеном проводят в гетерогенных условиях, для чего его наносят на стенки реакционного сосуда или используют специальные одноразовые сосуды (пробирки). Поскольку в автоматизированном one-pot синтезе РФП это невозможно, нами было впервые предложено использовать раствор йодогена в ацетонитриле. Это обеспечило образование [18F]FNImCl с высокой эффективностью (РХК 89 %, 55 °С, 10 мин) и, что особенно важно, при проведении реакции в том же реакционном сосуде. Высокая степень конверсии на второй и третьей стадиях синтеза была подтверждена методом радиоВЭЖХ (рис. 4).
Полученный [18F]FNImCl в режиме in situ переходит в соответствующий искомый нитрилоксид, [18F]FNNO. Это соединение невозможно выделить в чистом виде, оно используется непосредственно в дальнейшей реакции циклоприсоединения к алкенам и алкинам, открывая путь к новым методам получения РФП на основе сложных биологически активных молекул. Проведение реакции конъюгации с модельными пептидами и дипептидами является следующим этапом в продолжении данной работы.
Заключение
Таким образом, предложен эффективный метод синтеза нового перспективного радиосинтона – 6-[18F]фторникотиннитрил оксида для использования в синтезе РФП на основе сложных биологически активных молекул реакцией [3+2]циклоприсоединения. Разработанная методика позволяет провести все стадии радиоактивного синтеза в одном реакторе с высокой радиохимической конверсией, без промежуточного выделения продуктов реакции, что дает возможность ее адаптации к современным автоматизированным модулям синтеза РФП для ПЭТ. Преимуществом метода является его быстрота и простота за счет элиминирования стадии азеотропной осушки и проведения ключевой стадии радиофторирования в режиме онлайн на анионообменном картридже.
Работа выполнена в рамках государственного задания Министерства образования и науки, тема 0133-2019-0004 (ИМЧ РАН).
Библиографическая ссылка
Орловская В.В., Федорова О.С., Красикова Р.Н. ЭФФЕКТИВНЫЙ СИНТЕЗ 6-[18F]ФТОРНИКОТИН НИТРИЛ ОКСИДА ([18F]FNNO), РАДИОСИНТОНА ДЛЯ ВВЕДЕНИЯ ФТОРА-18 В БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ // Международный журнал прикладных и фундаментальных исследований. 2022. № 11. С. 91-96;URL: https://applied-research.ru/ru/article/view?id=13473 (дата обращения: 28.12.2025).
DOI: https://doi.org/10.17513/mjpfi.13473

