Растущие темпы развития нанотехнологий и их биомедицинского применения актуализируют задачу всесторонней оценки влияния создаваемых наноматериалов на организм человека. В организме постоянно поддерживается определенный уровень свободных радикалов, необходимых для нормальной жизнедеятельности. В этом аспекте важной составляющей таких исследований является изучение наноматериалов как участников свободнорадикальных реакций [1]. Ярким представителем нового класса биомиметиков, нанозимов (наноэнзимов), неорганических материалов, обладающих ферментоподобной активностью, являются наночастицы диоксида церия [2]. Наночастицы СеО2 способны выполнять функции аналогично ряду природных энзимов, что расширяет перспективы их биомедицинского применения для профилактики, диагностики и терапии социально значимых заболеваний, в том числе связанных с окислительным стрессом и онкологических [3]. Одними из основных источников свободных радикалов в организме являются нейтрофильные гранулоциты (нейтрофилы) крови, осуществляющие функцию иммунной защиты путем фагоцитоза и секреции цитокинов. При попадании наночастиц в кровоток первичный контакт происходит с нейтрофилами, мигрирующими в очаг воспаления. Несмотря на то, что в ряде исследований сообщается об увеличении числа нейтрофилов в ответ на введение наночастиц, работ, посвященных изучению прямой активации клеток последними, а именно нанодисперсным диоксидом церия, довольно мало [4, 5]. Кроме того, следует отметить, что по большей части эти исследования проведены на изолированной популяции клеток.
Цель исследования – анализ влияния одного из наиболее перспективных представителей класса нанозимов, наночастиц диоксида церия, на радикал-продуцирующую функцию нейтрофильного звена лейкоцитов при двухстадийной стимуляции клеток.
Материалы и методы исследования
Синтез и физико-химическая характеристика наночастиц СеО2. Нестабилизированный коллоидный раствор СеО2 получали термогидролизом гексанитратоцерата (IV) аммония (#215473, Sigma) [6]. Концентрацию золя СеО2 определяли термогравиметрическим методом. Коллоидный раствор наночастиц СеО2 стабилизировали декстраном (#31388, ~ 6.000 г/моль, Sigma) в мольном соотношении 1:1.1 (СеО2:декстран). Рентгенограммы образцов нанодисперсного СеО2 были получены с помощью дифрактометра Bruker D8 Advance (CuKα-излучение, геометрия θ–2θ). Идентификацию дифракционных максимумов осуществляли с использованием банка данных ICDD PDF2.
Хемилюминесцентный анализ радикал-продуцирующей активности нейтрофилов крови. Оценку функциональной активности нейтрофильного звена лейкоцитов проводили хемилюминесцентным методом с использованием протокола двухстадийной последовательной стимуляции клеток [7]. В качестве источника нейтрофилов использовали цельную венозную кровь практически здоровых доноров (Д.1, Д.2, Д.3) в возрасте 22 ± 1 лет. Кровь была отобрана из локтевой вены натощак в вакутейнеры с гепарином лития (17 МЕ/мл). Хемилюминесценцию клеток регистрировали в растворе Хенкса + Hepes (среда, рН 7,4) на 12-канальном хемилюминометре (Lum-1200). В кювету, содержащую среду (450 мкл) и люминол (45 мкМ), вносили 25 мкл исследуемого образца (цельная кровь до и после инкубации с золем СеО2, стабилизированным декстраном) и регистрировали спонтанную хемилюминесценцию (10 мин). Затем добавляли праймирующий агент форбол-12-миристат-13-ацетат (ФМА, 50 нг/мл) и после 20 мин инкубации вводили основной стимул N-формилметионил-лейцил-фенилаланин (фМЛФ, 10 мкМ). Все реагенты фирмы Sigma (США). Хемилюминограммы регистрировали при комнатной температуре не менее 2 ч.
Результаты исследования и их обсуждение
В результате термолиза водного раствора гексанитратоцерата (IV) аммония был получен электростатически стабилизированный золь диоксида церия (0,125 М) с размером частиц, равным 3 нм [6]. По данным рентгенофазового анализа, синтезированный золь содержал однофазный диоксид церия (PDF2 34-0394). Для функционализации поверхности наночастиц СеО2 был выбран декстран – полисахарид, являющийся перспективным биосовместимым лигандом благодаря широкому спектру применения как в качестве самостоятельного фармакологического агента, так и в составе комбинированных препаратов для инфузионной терапии [8, 9]. Спектры поглощения водного золя СеО2, стабилизированного декстраном, демонстрировали появление полосы поглощения в области 275–310 нм, характерной для нанокристаллического диоксида церия (данные не приведены).
После модификации декстраном коллоидный раствор диоксида церия инкубировали с образцами цельной крови (не менее 30 мин). Хемилюминесцентный ответ (ХЛ-ответ) клеток регистрировали в присутствии люминола, являющегося зондом, чувствительным к пероксиду водорода и активным формам хлора [10]. Были зарегистрированы спонтанная (собственная) хемилюминесценция нейтрофилов и стимулированная в результате последовательного применения праймирующего агента (ФМА) и основного стимула (фМЛФ) [7]. Двойная стимуляция (ФМА+фМЛФ) предполагает активацию клеток двумя веществами с разным механизмом действия, что приводит к наиболее полному ХЛ-ответу клеток. Хемилюминограммы, типичные для образцов крови практически здоровых доноров (n = 3), представлены на рис. 1. Контрольные измерения с индивидуальным раствором декстрана продемонстрировали отсутствие влияния на функциональную активность нейтрофилов (данные не приведены).
Как видно, в присутствии наночастиц СеО2 в случае пробы Д.1 происходит усиление собственного ХЛ-ответа клеток (рис. 1, А). При этом предварительная инкубация крови с золем СеО2, стабилизированным декстраном (1:1.1), не оказывала влияния на вид кинетики, развивающейся при двухстадийной стимуляции нейтрофилов (рис. 1, Б). Для количественной оценки радикал-продуцирующей активности клеток в присутствии наночастиц СеО2 для всех участков кинетической кривой (спонтанная ХЛ, ФМА-индуцированная ХЛ, фМЛФ-индуцированная ХЛ) были рассчитаны такие параметры, как интенсивность (амплитуда ответа) и интегральный показатель, площадь под ХЛ-кривой, пропорциональная концентрации образующихся свободных радикалов (рис. 2–4).
На основании полученных данных в качестве наиболее показательного параметра при анализе не менее трех параллельных измерений была выбрана площадь под кинетической кривой (Sсп, SФМА и SфМЛФ). Получено, что для образцов Д.1 и Д.3 присутствие наночастиц диоксида церия вызывает усиление спонтанной (собственной) ХЛ клеток, для пробы Д.2 – уменьшение интенсивности свечения (рис. 2). При этом наиболее выраженный эффект наблюдается для образца Д.1. Установлено, что при ФМА-индуцированной ХЛ нейтрофилов нанодисперсный диоксид церия может оказывать как супрессорное (Д.1, Д.2), так и активирующее (Д.3) действие (рис. 3). Показано, что предварительная инкубация проб с золем СеО2, стабилизированным декстраном, вызывает разнонаправленный характер изменения ХЛ-ответа клеток, индуцированного фМЛФ (рис. 3): эффект снижения ХЛ (Д.1 незначительный эффект, Д.2 – выраженный) и увеличение интенсивности свечения (Д.3).
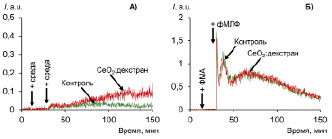
Рис. 1. (А) Спонтанная (собственная) и (Б) стимулированная (последовательная двойная стимуляция ФМА+фМЛФ) хемилюминесценция нейтрофилов крови практически здорового донора (Д.1) до и после инкубации с золем СеО2 (0,25 ммоль/л), стабилизированным декстраном в мольном соотношении 1:1.1
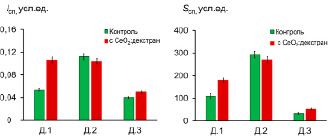
Рис. 2. Гистограммы распределения интенсивности (Iсп) и светосуммы (Sсп, площадь под ХЛ-кривой) спонтанной (собственной) ХЛ нейтрофилов для исследуемых образцов крови до и после инкубации с наночастицами СеО2, стабилизированного декстраном (1:1.1)
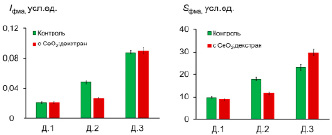
Рис. 3. Гистограммы распределения интенсивности (Iфма) и светосуммы (Sфма, площадь под ХЛ-кривой) ФМА-индуцированной ХЛ нейтрофилов для исследуемых образцов крови до и после инкубации с наночастицами СеО2, стабилизированного декстраном (1:1.1)
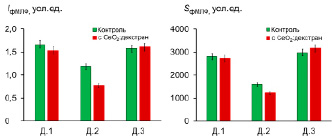
Рис. 4. Гистограммы распределения интенсивности (IфМЛФ) и светосуммы (SфМЛФ, площадь под ХЛ-кривой) фМЛФ-индуцированной ХЛ нейтрофилов для исследуемых образцов крови до и после инкубации с наночастицами СеО2 , стабилизированного декстраном (1:1.1)
Влияние наночастиц диоксида церия, стабилизированного декстраном (1:1.1), на функциональную активность нейтрофилов крови практически здоровых доноров
|
Проба |
Собственная ХЛ нейтрофилов |
ФМА-индуцированная ХЛ нейтрофилов |
фМЛФ-индуцированная ХЛ нейтрофилов |
|
Д.1 |
активация |
супрессия |
супрессия |
|
Д.2 |
супрессия |
супрессия |
супрессия |
|
Д.3 |
активация |
активация |
активация |
Таким образом, получено, что наночастицы СеО2 оказывают разное влияние на функциональную активность нейтрофилов на примере крови практически здоровых доноров. При этом эффект может иметь как ингибирующий характер (Д.1 (супрессия стимулированной ХЛ), Д.2 (супрессия спонтанной и стимулированной ХЛ), так и активирующий (Д.3) в случаях ХЛ-ответа клеток, обусловленного различными механизмами (таблица).
Для наночастиц химия поверхности является ключевым фактором, определяющим как их участие в биохимических процессах, так и характер взаимодействия с клетками, в том числе с нейтрофилами [11]. Нейтрофилы поглощают наночастицы путем фагоцитоза и пиноцитоза. Подобно патогенам или бактериям, наночастицы, взаимодействуя с мембранами нейтрофилов, запускают некоторые нейтрофильные реакции: активацию радикал-продуцирующей функции, дегрануляцию и образование внеклеточных ловушек (neutrophil extracellular traps – NETs) [12]. Несмотря на имеющиеся исследования, демонстрирующие увеличение числа нейтрофилов в ответ на присутствие наночастиц, данные о прямой активации этих клеток наночастицами, в частности нанодисперсным СеО2, практически не встречаются. Стимуляция радикал-продуцирующей активности нейтрофилов ФМА и фМЛФ происходит через разные механизмы действия: внутри- и внеклеточный соответственно. В случае праймирующего действия ФМА проникает в клетку путем пассивной диффузии и активирует протеинкиназный путь сборки НАДФН-оксидазы [13]. Внеклеточный рецепторный механизм стимуляции характерен для фМЛФ, причем происходит последовательная смена вне- и внутриклеточного синтеза активных форм кислорода [7]. Дисмутация образующихся супероксидных анион-радикалов приводит к тому, что в среде накапливается пероксид водорода, а за счет работы миелопероксидазы – активные формы хлора. Про- и антиоксидантные свойства наночастиц СеО2 тесно связаны между собой. Важным вопросом является механизм модуляции наночастицами СеО2 радикал-продуцирующей активности нейтрофилов. На данном этапе работы можно предположить, что в ряде случаев активирующее действие наночастиц СеО2 обусловлено прооксидантной активностью нанодисперсного диоксида церия по отношению к пероксиду водорода [14], в то время как супрессорное – реализуется за счет антиоксидантных свойств к гипохлориту [15].
Заключение
Получено, что наночастицы СеО2, модифицированные декстраном, модулируют функциональную активность нейтрофилов крови практически здоровых доноров. Нанодисперсный диоксид церия оказывает активирующее или супрессорное действие как на собственную хемилюминесценцию клеток, так и на стимулированную ФМА и фМЛФ. Сделано предположение о возможном механизме наблюдаемых эффектов: усиление ХЛ нейтрофилов за счет прооксидантной активности наночастиц СеО2 по отношению к пероксиду водорода, ингибирование свечения клеток – антиоксидантные свойства нанодисперсного диоксида церия к гипохлориту. Продолжение исследований в данном направлении представляется необходимым и важным, поскольку это позволит уточнить механизмы регуляции наночастицами СеО2 неспецифического иммунного ответа.
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации (МК-2763.2021.1.3).
Библиографическая ссылка
Созарукова М.М., Савинова Е.А., Проскурнина Е.В. РАДИКАЛ-ПРОДУЦИРУЮЩАЯ АКТИВНОСТЬ НЕЙТРОФИЛОВ КРОВИ В ПРИСУТСТВИИ НАНОЧАСТИЦ ДИОКСИДА ЦЕРИЯ // Международный журнал прикладных и фундаментальных исследований. 2022. № 12. С. 37-41;URL: https://applied-research.ru/ru/article/view?id=13480 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13480

