Витамины – вещества, необходимые для полноценного здоровья. Присутствие витаминов в рационе крайне важно для поддержания жизни и здоровья человека. Кроме того, известен ряд тяжелых заболеваний, связанных с недостатком определенных витаминов [1]. Некоторые витамины могут синтезироваться в организме человека. Витамин Д синтезируется эндогенно под кожей при воздействии солнечного света. Такие витамины, как В1, В2 и биотин, производятся бактериями в кишечнике [2, 3]. Витамины – предшественники важных кофакторов белков, которые необходимы для обеспечения пищевых метаболических функций. Кроме того, некоторые витамины играют важную роль антиоксидантов [4]. В зависимости от растворимости витамины делят на две группы: водорастворимые (витамины группы В, витамин С) и жирорастворимые (витамины А, Д, Е, К) [3]. Каждая из двух групп обладает различными физиологическими и химико-биологическими функциями.
Витамин В6 – важнейшее соединение для ключевых стадий клеточного метаболизма [5], участвующее в качестве кофактора более чем в 140 биохимических реакциях [6]. Основные реакции, катализируемые витамином В6, связаны с биосинтезом аминокислот и катаболизмом, а также с участием в биосинтезе нейротрансмиттеров и органелл-специфичных соединений, таких как хлорофилл [7, 8]. Кроме того, витамин В6 может блокировать активные формы кислорода [9]. Витамин В6 может существовать в виде шести химически близких структур, содержащих в основе пиридиновое кольцо. Они отличаются друг от друга заместителями в позиции 4’-пиридинового кольца: аминометильная группа – пиридоксамин, гидроксилметильная группа – пиридоксин, альдегидная группа – пиридоксаль (рис. 1). В качестве кофакторов они выступают в виде фосфорилированных соединений.
В группе методов молекулярной визуализации позитронная эмиссионная томография (ПЭТ) занимает ведущее место. Этот неинвазивный метод, основанный на использовании короткоживущих радионуклидов с позитронным типом распада, входящих в состав различных радиофармпрепаратов (РФП), обладает исключительно высокой чувствительностью, позволяя определять количественные характеристики физиологических и биохимических процессов в норме и патологии. В клинической практике ПЭТ чаще используется в определении локализации, стадии и контроля терапии при многих заболеваниях, в том числе онкологических [10, 11].
Традиционно в ПЭТ исследованиях применяют четыре циклотронных радиоизотопа -15О, 13N, 11C, 18F, из которых наиболее широко используемым является относительно «долгоживущий» фтор-18 с периодом полураспада 110 мин. Это позволяет проводить сложные и достаточно длительные радиохимические синтезы и получать более 20 клинических доз РФП за один синтез. Благодаря небольшой энергии испускаемых позитронов (0,635 МэВ) и, соответственно, малому пробегу в ткани (2,4 мм), в случае фтора-18 обеспечивается максимальное пространственное разрешение ПЭТ изображения. За более чем 30-летний период развития ПЭТ создан ряд важнейших классов РФП, позволяющих решать самые разные диагностические задачи. Современные ПЭТ исследования дают возможность определить скорость регионарного потребления глюкозы, визуализировать метаболизм многих соединений (например, аминокислот), а также оценить степень пролиферации клеток, выявить области гипоксии, некроза и др. Используя различные РФП или их комбинации, ПЭТ является эффективным методом ранней и точной диагностики злокачественных новообразований.
Дальнейшее развитие технологий визуализации опухолей и мониторинга эффективности лечения в первую очередь определяется наличием новых высокоспецифичных РФП [12]. В течение последних двух десятилетий в качестве потенциальных радиотрейсеров исследуются и меченые витамины, и их производные. Использование витаминов как молекулярных «переносчиков» для доставки лекарств к опухоли является мощной стратегией терапии злокачественных и воспалительных заболеваний; на этой же основе возможна и разработка биомаркеров для визуализации процессов доставки методом ПЭТ. Большинство работ в этой области посвящено синтезу РФП на основе производных фолиевой кислоты, меченных фтором-18, рассмотренных в недавнем обзоре [13]. Вместе с тем получение других радиотрейсеров на основе витаминов, в частности витамина В6, тормозится прежде всего отсутствием эффективных методов радиохимического синтеза.
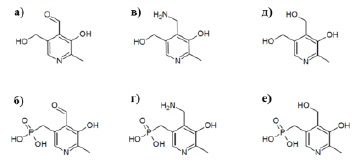
Рис. 1. Химические структуры витамина В6: а) пиридоксаль, б) пиридоксаль 5’-фосфат, в) пиридоксамин, г) пиридоксамин 5’-фосфат, д) пиридоксин, е) пиридоксин 5’-фосфат
В данной работе впервые предложен метод синтеза 2-[18F]фторметил-пиридоксина, производного витамина В6, и проведены первые исследования стабильности этого соединения в плазме крови человека.
Материалы и методы исследования
Материалы и реактивы. Коммерчески доступные растворители – N,N-диметилформамид (ДМФА) (содержание H2O менее 0,005 %, Sigma-Aldrich), ацетонитрил (MeCN) (содержание H2O менее 0,03 %, ООО «Криохим»), этанол (HPLC grade, Merck), ацетон (CH3)2CO) (ЧДА, АО «ЭКОС-1»), хлороформ (CHCl3) (ХЧ, АО «ЭКОС-1»), гидроксид аммония (NH4OH) (ЧДА, ЗАО «Вектон»), изопропанол (i-PrOH) (ХЧ, ЗАО «Вектон») использовались без дополнительной очистки; для получения фтора-18 использовалась вода [18O]H2O, обогащенная изотопом кислород-18 (≥ 97 %, ЗАО «Глобальные научные технологии», Санкт-Петербург, Россия); 4,7,13,16,21,24-гексаоксо-1,10-диазабицикло[8.8.8]гексакозан (криптофикс 2.2.2), тетрабутиламмония бромид (TBABr), тетрабутиламмония карбонат (TBAHCO3) (оба ≥ 98 %, Sigma-Aldrich) и безводный карбонат калия (K2CO3) (Sigma Aldrich); предшественники для радиоактивного синтеза были предоставлены ИНЭОС РАН (Москва). Одноразовые картриджи с анионообменной тетраметиламмониевой смолой (SepPak QMA light, Waters) активировали последовательной промывкой 10 мл 0,5 М K2CO3 и 15 мл Н2О, а картриджи для твердо-фазной экстракции SepPak С18 plus (Waters) с обращенно-фазным сорбентом – промывкой 4 мл EtOH и 10 мл Н2О. Приготовление фосфатного буферного раствора (рН 6,4): 2,5 г Na2HPO4, 2,5 г NaH2PO4 и 8,2 г NaCl (Panreac, Испания, классификации Pharm Grade) растворяли в 1 л H2O, доводили рН до 6,4 добавлением 1 М раствора NaOH.
Получение радионуклида фтор-18. Фтор-18 получали по ядерной реакции 18O(p,n)18F при облучении протонами с энергией 16,4 МэВ и током 30 мкА мишени, заполненной водой [18O]H2O. Облучение проводилось на циклотроне PETtrace 4 (GE Healthcare, Швеция). По окончании облучения вода [18O]H2O, содержащая [18F]фторид, доставлялась током гелия из мишени в модуль синтеза. Начальная активность составляла 7–11 ГБк. Радиохимический синтез 2-[18F]фторметил-пиридоксина осуществляли на сконструированном в ИМЧ РАН полуавтоматическом модуле с дистанционным управлением.
Синтез 2-[18F]фторметил-пиридоксина. Полученный в мишени [18F]фторид-анион выделяли из мишенного материала онлайн-сорбцией на картридже SepPak QMA light с последующим элюированием в реакционный сосуд обьемом 5 мл QMA элюентом – раствором, содержащим 2,0 ± 0,1 мг (12 мкмоль) K2CO3, 9,0 ± 0,1 мг (25 мкмоль) криптофикса 2.2.2 в 2 мл смеси ацетонитрил/вода (96/4 по объему). Раствор упаривали досуха в токе азота при температуре 120 °С в течение 10 мин. К сухому остатку, содержащему комплекс) [K/K2.2.2]+[18F]-, добавляли раствор предшественника (8-(ацетоксиметил)-3,3-диметил-9-(4-метилбензолсульфонилокси)-1,5-дигидро [1,3]диоксипино[5,6-c]пиридин) (6 мг, 15 мкмоль) в 0,7 мл растворителя. Реакцию нуклеофильного радиофторирования проводили 10–15 мин при 80–130 °С, затем смесь охлаждали до 50–60 °С и разбавляли 3 мл воды. Целевой продукт выделяли из реакционной смеси методом полупрепаративной обращенно-фазовой радиоВЭЖХ.
Условия анализа методами радио-ВЭЖХ и радио-ТСХ. Выход реакции радиофторирования (табл. 1) и идентификацию меченого продукта осуществляли с использованием методов радио-ТСХ и радио-ВЭЖХ. Радио-ТСХ: пластинки Сорбфил с УФ-индикатором производства ЛЕНХРОМ (Санкт-Петербург, Россия), подвижная фаза (элюент ТСХ) – (CH3)2CO/EtOH/CHCl3/NH4OH (2/2/2/0.5 объемное соотношение). Распределение продуктов радиофторирования по пластинке определяли с помощью радио-ТСХ сканера MiniGITA (Raytest, Германия). Rf для [18F]фторида и 2-[18F]фторметил-пиридоксина составили 0,05 и 0,75 соответственно. Условия полупрепаративной ВЭЖХ: насос Knauer, колонка Xbridge С18 (250*10 мм), элюент 0.05М NH4OAc/MeCN (55/45 %), поток 4 мл/мин, детектор по радиоактивности Beckman 170. Условия радио-ВЭЖХ: хроматограф Dionex ISC-5000, снабженный краном-дозатором Rheodyne 7125, УФ-детектором (254 нм) и последовательно соединенным с ним детектором по радиоактивности Carrol and Ramsey Associates, CA, USA, model 105-S; колонка Xbridge C18 (150*4.6 мм), элюент 0,05 М NH4OAc/MeCN (55/45 %), поток 1 мл/мин. Времена удерживания Rt 2-[18F]фторметил-пиридоксина и его предшественника составляли 9,2±0,1 и 10,9±0,1 мин соответственно.
Определение стабильности радиолиганда в плазме человека. Стабильность производного 2-[18F]фторметил-пиридоксина определяли в плазме человека при 37 °C при различном времени инкубации (0–40 мин). Фосфатный буферный раствор использовали в качестве контроля. Радиолиганд (10 мкл, 50 мкКи) добавляли к фосфатному буферу (300 мкл) и к плазме (300 мкл). Далее смеси встряхивали в течение 15 мин и инкубировали при 37°C. Аликвоты полученных растворов (100 мкл) отбирались в каждой временной точке (0, 10, 20 и 40 мин) и смешивались с 100 мкл ледяного ацетонитрила. Затем полученный раствор центрифугировали (5 мин, 4500 g). Полученный раствор над осадком анализировали методом радио-ТСХ.
Результаты исследования и их обсуждение
Для введения метки фтор-18 в молекулу витамина В6 мы использовали классический для ПЭТ радиохимии метод алифатического нуклеофильного замещения «уходящей» группы в молекуле структурно близкого предшественника на [18F]фторид, активированный присутствием межфазного катализатора (МФК). Первоначально, в качестве предшественника нами было предложено использовать производное витамина В6, содержащее тозильную «уходящую» группу (рис. 2).
Однако предложенный предшественник оказался крайне неустойчивым, меняя цвет с белого на темно-коричневый в течение нескольких часов после его получения в инертных условиях. После ряда неудачных попыток были синтезированы еще два предшественника (1 и 2, рис. 3). Было установлено, что эти соединения, содержащие слабые уходящие группы (трифторацетатная и ацетильная), стабильны как при хранении, так и в жестких щелочных условиях, необходимых для проведения реакции 18F-фторирования.
При использовании предшественника 1 выход радиофторирования составил всего 5–10 %. В то же время для предшественника 2 в тех же стандартных условиях реакции (К2.2.2, К2СО3, MeCN, 80 °C, 10–15 мин) эффективность радиофторирования по данным радиоТСХ (рис. 5) достигала 56±10 % (табл. 1).
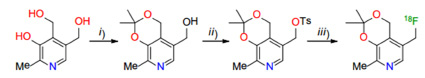
Рис. 2. Синтез тозильного предшественника и структура меченного фтором-18 аналога витамина В6 Реагенты: i) 2,2-Диметоксипропан; ii) p-толуенсульфонил хлорид, триэтиламин; iii) [K/K2.2.2]+[18F]-
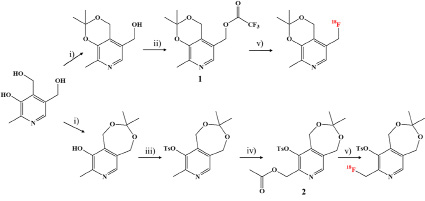
Рис. 3. Синтез предшественников 1 и 2 для получения меченных фтором-18 аналогов витамина В6 Реагенты: i) 2,2-диметоксипропан; ii) ангидрид трифторуксусной кислоты; iii) p-толуенсульфонил хлорид; iv) уксусный ангидрид, v) [K/K2.2.2]+[18F]- или [18F]TBAF
Замена стандартного К 2.2.2 на другой МФК, тетрабутиламмоний бромид (TBABr, раствор в i-PrOH) позволила увеличить выход фторирования в различных растворителях (ДМФА, MeCN) до 93±3 % (табл. 1). К сожалению, в случае TBABr наблюдались очень большие потери радиоактивного продукта на стенках реакционного сосуда. Кроме того, при анализе реакционной смеси методом ВЭЖХ (с УФ-детектором) было установлено, что при использовании TBABr в качестве МФК образуется намного больше «холодных» примесей, нежели в присутствии криптофикса К2.2.2, который и был применен в дальнейших исследованиях (рис. 4).
Таблица 1
Результаты радиофторирования предшественника 2 (6 мг, 27 мкмоль)
|
№ |
Растворитель |
МФК |
Т, °С/t, мин |
Выход фторирования, % (по ТСХ) |
|
1 |
Ацетонитрил |
К 2.2.2 (25 мкмоль) К2СО3 (12 мкмоль) |
80/15 |
56±10 (n = 5) |
|
2 |
Ацетонитрил |
TBAНCO3 (20 мкл/мл 20 % раствора pH = 8, MeCN) |
80/15 |
52 (n = 1) |
|
3 |
ДМФА |
TBABr (6 мг/мл 19 мкмоль/мл, i-PrOH) |
150/15 |
90±3 (n = 3) |
|
4 |
Ацетонитрил |
TBABr (6 мг/мл 19 мкмоль/мл, i-PrOH) |
80/15 |
90 (n = 1) |
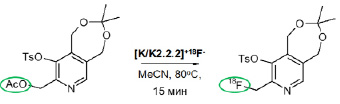
Рис. 4. Синтез 2-[18F]фторметил-пиридоксина реакцией радиофторирования предшественника 2
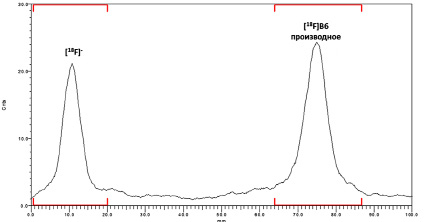
Рис. 5. ТСХ хроматограмма реакционной смеси после радиофторирования
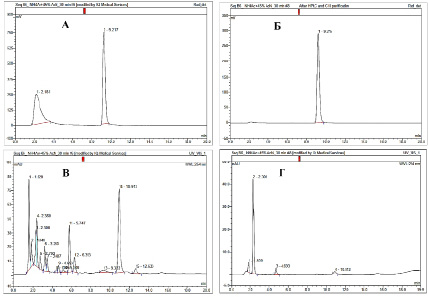
Рис. 6. Данные ВЭЖХ анализа: А – реакционной смеси до очистки (детектор по радиоактивности); Б – целевого продукта после очистки (детектор по радиоактивности); В – реакционной смеси до очистки (УФ-детектор, λ = 254 нм); Г – целевого продукта после очистки (УФ-детектор, λ = 254 нм)
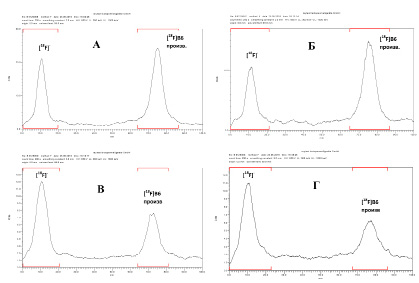
Рис. 7. РадиоТСХ-хроматограммы плазмы крови человека после введения 2-[18F]фторметил-пиридоксина Время инкубации проб: А – 0 мин; Б – 10 мин; В – 20 мин; Г – 40 мин
Таблица 2
Изучение стабильности 2-[18F]фторметил-пиридоксина в плазме крови человека (по данным радиоТСХ, рис. 7)
|
Время инкубации, мин |
2-[18F]фторметил- пиридоксин в неизмененном состоянии, % |
[18F]-, % |
|
0 |
58,10 |
41,90 |
|
10 |
65,64 |
34,36 |
|
20 |
40,82 |
59,18 |
|
40 |
43,30 |
56,70 |
По окончании радиофторирования целевой продукт выделяли методом обращенно-фазовой полупрепаративной радиоВЭЖХ. Фракцию, содержащую 2-[18F]фторметил-пиридоксин, разбавляли водой, и полученный раствор пропускали через одноразовый обращенно-фазовый картридж С18, для замены органического растворителя (ацетонитрил), содержащегося в ВЭЖХ элюенте, на фосфатный буфер. Радиохимическая чистота полученного 2-[18F]фторметил-пиридоксина составила ≥ 95 % (согласно данным ВЭЖХ анализа, рис. 6, Б).
Изучение стабильности полученного радиотрейсера в плазме крови человека проводили согласно протоколу, предложенному в работе [14]. Для определения количества «неизмененного» 2-[18F]фторметил-пиридоксина и [18F]фторида при различном времени инкубации использовали метод радиоТСХ (рис. 7).
Как видно из данных табл. 2, полученный 2-[18F]фторметил-пиридоксин обладает недостаточно высокой устойчивостью в отношении потери метки фтор-18 в плазме крови человека. В связи с этим дальнейшее изучение этого меченого соединения в качестве потенциального ПЭТ радиотрейсера на данном этапе работы не проводилось.
Заключение
В результате проведенного исследования впервые синтезированы меченные фтором-18 производные витамина В6, из которых 2-[18F]фторметил-пиридоксин получен с высоким радиохимическим выходом и радиохимической чистотой более 95 %. Проведены предварительные исследования устойчивости нового радиотрейсера в плазме крови человека, показавшие, что после 40 мин инкубации лишь около 40 % 2-[18F]фторметил-пиридоксина остается в неизменной форме. Таким образом на данном этапе не удается сделать вывод о возможности использования 2-[18F]фторметил-пиридоксина в качестве потенциального ПЭТ радиотрейсера.
Авторы выражают благодарность сотрудникам ИМЧ РАН, проф. Юрию Николаевичу Белоконю и докт. хим. наук Виктору Ивановичу Малееву, за предоставленные предшественники для радиоактивного синтеза новых производных витамина В6.
Работа выполнена в рамках Государственного задания Министерства образования и науки, тема 0133-2019-0004 (ИМЧ РАН).
Библиографическая ссылка
Ваулина Д.Д., Кузнецова О.Ф., Федорова О.С., Красикова Р.Н. СИНТЕЗ И ИЗУЧЕНИЕ IN VITRO СТАБИЛЬНОСТИ ПРОИЗВОДНОГО ПИРИДОКСИНА (ВИТАМИНА В6), МЕЧЕННОГО ФТОРОМ-18 // Международный журнал прикладных и фундаментальных исследований. 2022. № 12. С. 110-116;URL: https://applied-research.ru/ru/article/view?id=13493 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13493

