Болезни сердца являются наиболее распространенной причиной смерти в мире, и атеросклероз и тромбоз сосудов миокарда служат главными причинами их развития. Микрососудистое русло представляет собой совокупность особенных структур, находящихся между мелкими артериями и венами. Оно характеризуется особенными анатомо-топографическими взаимоотношениями с окружающими его структурами, которые в дальнейшем определяют тканевые функции органа. Элементам микрососудистого русла принадлежит главная роль в развитии воспалительных реакций, в обеспечении трофической, дыхательной, экскреторной функций сердечно-сосудистой системы. Все эти процессы регулируются вегетативной нервной системой и гормонами, которые оказывают воздействие на гладкие мышечные элементы и на эндотелий, приводя к изменениям диаметров структур микроциркуляторного русла. Учитывая неоспоримую роль структур микроциркуляторного русла в обеспечении трофических процессов, в формировании воспаления, на протяжении многих лет проводят изучение их морфологических особенностей, особенностей гемодинамики, транскапиллярного обмена в различных органах и тканях [1].
Однако остается открытым вопрос о том, как изменение диаметра одной из структур микроциркуляторного русла может повлиять на диаметры других его структур.
Проведение исследований, направленных на выявление возможных корреляций между диаметрами структур микроциркуляторного русла миокарда, может иметь большое значение для понимания функционирования сердечно-сосудистой системы. Возможно, такие исследования помогут выявить особенности регуляции кровотока и изменения диаметров структур микроциркуляторного русла в различных условиях, таких как воспаление, стресс или физическая нагрузка. Кроме того, такие исследования могут быть полезны при разработке новых методов лечения сердечно-сосудистых заболеваний, которые будут учитывать особенности микроциркуляторного русла и его взаимосвязи с другими структурами сердца. Например, такие методы могут включать использование лекарственных препаратов, которые способны регулировать диаметры структур микроциркуляторного русла и тем самым улучшать кровоснабжение сердечной мышцы.
Изучение взаимосвязи между диаметрами различных структур микроциркуляторного русла миокарда может иметь практическое значение для диагностики и лечения заболеваний сердца. Например, если было бы доказано, что изменение диаметра одной структуры микрососудистого русла влечет за собой изменение диаметра других структур, то это могло бы привести к разработке новых методов лечения заболеваний сердца, направленных на улучшение микроциркуляции в сердце.
Цель исследования – провести анализ корреляций диаметров структур микрососудистого русла миокарда.
Материалы и методы исследования
Материалом исследования послужили сердца экспериментальных животных (половозрелых беспородных белых крыс, n=45). Исследования проводились в соответствии с российскими (приказ Министерства здравоохранения СССР № 755 от 12.08.1977 г.; методические указания Министерства здравоохранения Российской Федерации «Деонтология медико-биологического эксперимента») и европейскими (директива ЕС «О защите животных, используемых в экспериментальных и научных целях» (86/609СЕ) этическими нормативами. Для изучения компонентов микроциркуляторного русла миокарда были использованы методы [2, 3], позволяющие выявить их морфологические особенности и провести оценку их взаимоотношений. Использовали методы монохромной и бихромной инъекции сосудистого русла взвесей парижской синей в хлороформе и киновари в скипидаре с последующим изучением просветленных препаратов, а также сочетание инъекционных методов с гистологической окраской препаратов гематоксилином и эозином. Для измерения диаметров структур микроциркуляторного русла проводили изготовление коррозионных препаратов сосудов, а также использовали люминисцентно-микроскопический метод, выявляющий изучить структуры микроциркуляционного русла миокарда на их достаточном протяжении (рисунок).
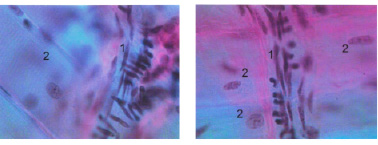
Ориентация артерий (1) по отношению к кардиомиоцитам (2) в миокарде собаки. а) поверхностный слой миокарда; б) глубокий слой миокарда. Окраска парарозанилином и толуиновым синим. Ув. х900
Статистическую обработку полученных данных проводили с использованием пакетов Statistica («StatSoft», США). Проверка распределений на нормальность осуществлялась с использованием критерия хи-квадрат. Достоверность различий между распределениями рассчитывали с использованием критерия Стьюдента [4].
Оценку корреляционных связей проводили по коэффициенту корреляции (r). При r≤0,20 корреляция считалась очень слабой, при r= <0,20 – ≤0,50 – слабой, при r=0,50 – ≤ 0,70 – средней, при r=0,71 – 0,90 – сильной, при r=0,90 ≤ 1 – очень сильной.
Результаты исследования и их обсуждение
Артериолы отходят от артерий в поверхностном слое миокарда под углом 75,0–80,0 ± 0,06°; в среднем слое – 65,0–70,0 ± 0,07°; в глубоком слое – 52,0–68,0 ± 0,08°. Дальнейшее ветвление артериол происходит по магистральному типу, а основной сосуд, постепенно уменьшаясь в диаметре, переходит в прекапилляр. Диаметр артериол миокарда составляет в среднем 40,0–45,0 мкм.
Прекапилляры миокарда в среднем имеют диаметр 10,0–15,0 мкм.
Капилляры формируются путем непосредственного перехода прекапилляров в капилляры или за счет их дихотомического деления. Диаметр капилляров миокарда равен 4,0–6,0 мкм, угол их отхождения от прекапиллярных артериол – 36,0–41,0 ± 0,04°. Наше исследование показало, что все кровеносные капилляры расположены под незначительным углом к мышечному волокну, спирально оплетая их.
Посткапилляры образуются за счет слияния кровеносных капилляров. Их диаметр в среднем составляет 10,0–12,0 мкм. Они ориентированы к кардиомиоцитам под углом 43,0–60,0 ± 0,05°.
Средний диаметр венул составляет 24,0–31,0 мкм. Они ориентированы к мышечным волокнам под углом 64,0–78,0 ± 0,03°.
Корреляционный анализ диаметров микрососудов миокарда показал наличие прямых связей различной силы между изученными параметрами (таблица).
Анализ корреляций компонентов микросусудистого русла поверхностного слоя миокарда показал, что диаметр артериол связан слабой по силе корреляцией с диаметрами посткапилляров (r = 0,5) и прекапилляров (r = 0,3). Диаметр артериол связан с диаметром капилляров и венул очень слабой корреляцией (r = 0,1–0,15). Диаметр прекапилляров формирует слабую положительную связь с диаметрами капилляров, посткапилляров и артериол (r = 0,4–0,3) и очень слабую – с диаметром венул (r = 0,1). Диаметр капилляров связан слабо с диаметрами прекапилляров, посткапилляров и венул (r = 0,5–0,4) и очень слабо – с диаметром артериол (r = 0,15).
Корреляции диаметров структур микрососудистого русла миокарда
|
Слои миокарда |
Компоненты |
А |
ПрК |
К |
ПостК |
В |
|
Поверхностный |
А |
– |
r=0,3 |
r=0,15 |
r=0,5 |
r=0,1 |
|
ПрК |
r=0,3 |
– |
r=0,4 |
r=0,3 |
r=0,1 |
|
|
К |
r=0,15 |
r=0,4 |
– |
r=0,4 |
r=0,5 |
|
|
ПостК |
r=0,5 |
r=0,3 |
r=0,4 |
– |
r=0,1 |
|
|
В |
r=0,1 |
r=0,1 |
r=0,5 |
r=0,1 |
– |
|
|
Средний |
А |
– |
r=0,75 |
r=0,18 |
r=0,1 |
r=0,1 |
|
ПрК |
r=0,75 |
– |
r=0,3 |
r=0,3 |
r=0,1 |
|
|
К |
r=0,18 |
r=0,3 |
– |
r=0,2 |
r=0,01 |
|
|
ПостК |
r=0,1 |
r=0,2 |
r=0,2 |
– |
r=0,01 |
|
|
В |
r=0,1 |
r=0,1 |
r=0,01 |
r=0,01 |
– |
|
|
Глубокий |
А |
– |
r=0,1 |
r=0,05 |
r=0,2 |
r=0,1 |
|
ПрК |
0,1 |
– |
r=0,01 |
r=0,01 |
r=0,01 |
|
|
К |
r=0,05 |
r=0,01 |
– |
r=0,01 |
r=0,01 |
|
|
ПостК |
r=0,2 |
r=0,01 |
r=0,01 |
– |
r=0,01 |
|
|
В |
r=0,1 |
r=0,01 |
r=0,01 |
r=0,01 |
– |
Примечание: А – артериола; ПрК – прекапилляр; К – капилляр; ПостК – посткапилляр; В – венула.
Диаметр посткапилляров поверхностного слоя миокарда связан слабой положительной корреляцией с диаметрами артериол, прекапилляров и посткапилляров (r=0,5–0,3) и очень слабо – с диаметром венул (r=0,1). Диаметр венул образует слабую положительную корреляцию только с диаметром капилляров (r=0,5). С остальными компонентами микрососудистого русла поверхностного слоя миокарда диаметр венул связан очень слабыми корреляциями (r=0,1).
Диаметр артериол среднего слоя миокарда формирует сильную положительную корреляцию с диаметром посткапилляров (r=0,75). С остальными компонентами микрососудистого русла диаметр артериол связан очень слабой корреляцией (r=0,18–0,1). Диаметр прекапилляров среднего слоя миокарда связан сильной положительной корреляцией с диаметром артериол (r=0,75). С остальными компонентами микрососудистого русла диаметр прекапилляров связан слабой положительной корреляцией (r=0,1–0,3). Диаметр капилляров слабо коррелирует с диаметром прекапилляров (r=0,3). С остальными компонентами микрососудистого русла диаметр капилляров связан очень слабой положительной корреляцией (r=0,01–0,2). Диаметры посткапилляров и венул среднего слоя миокарда коррелируют очень слабо со всеми изученными компонентами микроциркуляторного русла (r=0,01–0,2).
Диаметры компонентов микроциркуляторного русла глубокого слоя миокарда связаны между собой очень слабыми положительными корреляциями (r=0,01–0,2).
Заключение
Артерии миокарда представляют собой ветви субэпикардиальных артерий, от которых отходят вторичные ветви, за счет которых и формируется микрососудистое русло. Для каждого слоя миокарда характерна закономерная ориентация сосудов по отношению к мышечным волокнам. Для обеспечения оптимального кровотока в микрососудах размер просвета сосудов уменьшается при приближении к капиллярам, а затем снова увеличивается при приближении к венулам. Это обеспечивает эффективное распределение потоков форменных элементов и плазмы крови в микрососудистых ветвлениях. Однако закономерности распределения потоков крови в микрососудах до конца еще не выяснены с биомеханической точки зрения.
Циркуляция крови по элементам микрососудистого русла характеризуется целым рядом особенностей. Это связано, прежде всего, с тем, что кровь млекопитающих, в том числе и человека, не является однородной жидкостью [5, 6]. Она, подобно суспензиям, состоит из плазмы и взвешенных в ней форменных элементов, размеры которых близки к диаметру просвета капилляров. Из форменных элементов крови главную роль, с точки зрения реологических свойств крови, играют эритроциты, а лейкоциты и тромбоциты – второстепенную, так как их значительно меньше, а тромбоциты, кроме того, еще и меньших размеров [7, 8].
Кроме того, величина просвета микрососудов вначале уменьшается (от артериолы до капилляра), а затем снова увеличивается (от капилляра до венулы). В зависимости от этого поток крови в различных микрососудах отличается значительным своеобразием [9, 10]. Микрососудистое русло миокарда имеет уникальные особенности, связанные с регуляцией кровотока в сердечной мышце. В отличие от других органов, сердечная мышца имеет очень высокую потребность в кислороде и питательных веществах, чтобы обеспечить постоянную сократительную деятельность сердца. Поэтому регуляция кровотока в микрососудах миокарда является крайне важным механизмом, обеспечивающим адекватную перфузию сердечной мышцы.
Одной из ключевых особенностей регуляции кровотока в сердечной мышце является механизм авторегуляции – способность микрососудов сердца регулировать свой сосудистый тонус и тем самым поддерживать относительно постоянный кровоток при изменении артериального давления. Это достигается за счет взаимодействия между миоэнтерическими нервными клетками и гладкой мышцей стенок сосудов. Также важным механизмом регуляции кровотока в сердечной мышце является механизм метаболической авторегуляции. Он основан на изменении метаболического состояния сердечной мышцы и реализуется при изменении ее потребностей в кислороде и питательных веществах. При увеличении метаболических потребностей сердечной мышцы, например при физической нагрузке, происходят расширение микрососудов и увеличение кровотока в миокарде.
Кроме того, сердечная мышца имеет большое количество коллатералей – связей между артериями, которые позволяют обеспечить альтернативный путь кровотока в случае окклюзии основного кровотока. Это играет важную роль в сохранении жизни при инфаркте миокарда, когда кровоснабжение определенного участка миокарда прекращается.
Эндогенная вазомоторика является важным механизмом регуляции кровотока в микрососудах. Ритмические колебания просвета артериальных сосудов вызываются действием специальных нейрогуморальных факторов, которые воздействуют на гладкую мускулатуру в стенке сосуда. Эти факторы могут вызывать как сужение, так и расширение артериол, что приводит к изменению кровотока в соответствующих участках микрососудистого русла.
Поток крови постоянно меняется вследствие ритмических колебаний просвета сосудов – эндогенной вазомоторики. Это касается, прежде всего, артериальных компонентов микрососудистого русла, в стенках которых есть гладкие миоциты, реагирующие на различные нейрогуморальные воздействия. В меньшей степени это относится к венозным компонентам, в стенках которых гладкие миоциты могут отсутствовать, и еще меньше – к капиллярам, в стенке которых гладких миоцитов нет. Очевидно, что кровоток зависит от диаметра сосуда. Эти особенности кровотока в микрососудах в значительной степени влияют на реологические свойства движущейся крови и, в конечном итоге, на микроциркуляцию, особенно при патологических условиях.
Все компоненты микрососудистого русла подвержены искривлению в той или иной степени. Этот морфологический феномен в литературе иногда называют термином «начальное искривление». Конфигурация микрососудистого ветвления способна подстраиваться под оптимальную путем изменения диаметра и длины микрососуда. Изменение длины может происходить как в сторону увеличения (при этом степень искривления микрососуда будет уменьшаться), так и в сторону ее уменьшения (при этом степень искривления микрососуда будет увеличиваться).
Важно отметить, что искривление микрососудов является не только морфологическим, но и функциональным феноменом, который обеспечивает оптимальное распределение кровотока в организме. Кроме того, искривления микрососудов могут быть связаны с возникновением патологических состояний, таких как гипертония, диабет и атеросклероз. Проанализировав корреляции структур микрососудистого русла слоев миокарда, мы пришли к заключению, что в его поверхностном слое нет сильных связей. Средние корреляции выявлены между диаметрами артериол и посткапилляров и между диаметрами венул и капилляров. В среднем слое миокарда сильная корреляция связывает диаметры артериол и прекапилляров. В глубоком слое миокарда диаметры всех структур микроциркуляторного русла формируют очень слабые корреляции.
Библиографическая ссылка
Малыхина Т.В., Музурова Л.В., Фомкина О.А., Гладилин Ю.А. КОРРЕЛЯЦИИ ДИАМЕТРОВ СТРУКТУР МИКРОСОСУДИСТОГО РУСЛА МИОКАРДА // Международный журнал прикладных и фундаментальных исследований. 2023. № 4. С. 14-18;URL: https://applied-research.ru/ru/article/view?id=13524 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13524

