Операция по замене поврежденных суставов считается наиболее эффективным способом лечения поврежденных суставов, уменьшения боли, улучшения функции суставов и повышения качества жизни [1]. В действительности средний срок службы протеза составляет всего около 15 лет. Протезы также могут вызвать ряд проблем, в том числе инфекцию [1]. Это потенциально может привести к значительному физическому ущербу для пациентов и финансовым затратам [2]. Согласно исследованию в Австралии, из 10 000 операций по замене тазобедренного и коленного суставов, проведенных в 2013 году, в 13% случаев потребовалось проведение ревизионной артропластики из-за проблем с протезным суставом, из которых 20% были вызваны инфекцией протезного сустава [3]. Другое исследование, выполненное в Испании, выявило, что 17% из 6027 ревизионных эндопротезирований были обусловлены инфекцией протезного сустава [4].
Было предположено, что к 2030 году ежегодные госпитальные расходы, связанные с перипротезными инфекциями (ППИ) тазобедренного и коленного суставов, составят 1,85 млрд долларов, исходя из динамики роста числа случаев ППИ [5].
Авторами статьи было определено, что проводились лишь несколько исследований ППИ, вызванных грамотрицательными бациллами и их профилем устойчивости к антибиотикам, в то время как большинство исследователей сосредоточились на стафилококковых ППИ [6]. Хотя грамотрицательные бациллы являются относительно редкой причиной ППИ, их доля в последнее время растет. Ученые сообщили о статистически значимой линейной тенденции роста ППИ, вызванных аэробными грамотрицательными бациллами (с 25% в 2003–2004 гг. до 33,3% в 2011–2012 гг.), в то время как количество ППИ, вызванных аэробными грамположительными кокками, снизилось с 80,3% в 2003–2004 гг. до 74,3% в 2011–2012 гг. [7]. Эти результаты сопоставимы с данными предыдущих недавних исследований, проведенных в Испании, где определено, что 20,4% случаев ППИ были вызваны Enterobacteriaceae, в отличие от более ранних исследований, где утверждалось, что менее 10% ППИ были вызваны грамотрицательными бактериями [8]. Кроме того, выбор наилучшего антибиотика имеет решающее значение, поскольку он влияет на исход заболевания, а некоторые из этих инфекций вызваны полирезистентными штаммами грамотрицательных бактерий, которые очень трудно поддаются лечению [9]. Ученые из России привели данные, согласно которым 33,4% случаев ППИ были вызваны представителями грамотрицательной флоры, из них 17,3% относились к Enterobacteriaceae. Отметим, что по сравнению с 2014–2015 гг. доля Enterobacteriaceae среди представителей грамотрицательной флоры в 2016–2017 г. увеличилась на 12,7%. Особого внимания заслуживают грамотрицательные неферментирующие представители рода Acinetobacter, выявленные в 6,7% случаев, все их выделенные штаммы были полирезистентными [10].
Вторым по распространенности типом полирезистентных изолятов являются энтеробактерии, продуцирующие бета-лактамазы расширенного спектра (БЛРС). Цефалоспорины третьего и четвертого поколений гидролизуются БЛРС, что приводит к уникальной устойчивости к этим лекарствам. Бактерии, экспрессирующие БЛРС, больше не являются редкостью в ортопедической и травматологической хирургии [11]. Было обнаружено, что некоторые из основных возбудителей ППИ обладают многочисленными факторами резистентности: до 29% штаммов Pseudomonas aeruginosa устойчивы к карбапенемам, 25% штаммов Enterobacteriaceae продуцируют бета-лактамазы расширенного спектра, а 56,6% штаммов Staphylococcus epidermidis и 23,9% штаммов Staphylococcus устойчивы к метициллину [12].
Цель исследования – изучить этиологическую роль семейства Enterobacteriaceae как условно-патогенной микрофлоры в патогенезе имплантат-ассоциированного воспаления у больных с подозрением на эту инфекцию.
Материалы и методы исследования
Лабораторные исследования проведены согласно Хельсинкской декларации Всемирной медицинской ассоциации по этическим принципам проведения медицинских исследований с участием человека в качестве субъекта (принята 59-й Генеральной Ассамблеей ВМА Сеул, октябрь 2008 года). Информированное согласие в письменном виде на распространение медицинской информации получено от всех пациентов.
Микробиологическое лабораторное исследование проводилось для выявления бактерий, присутствующих в биоматериале у пациентов с перипротезной инфекцией (ППИ), с отведением особой роли семейству Enterobacteriaceae как микроорганизмов, образующих защитную пленку, которая является основной причиной полирезистентности. Все микроорганизмы данного семейство относятся к нормальной или транзиторной микрофлоре толстого кишечника, энтеробактерии присутствуют в различных отделах желудочно-кишечного тракта здорового человека. Для исследования в работе были использованы: синовиальная жидкость, пунктаты (в дооперационном периоде), биоптаты из очага воспаления, а также полученные во время основного этапа оперативного вмешательства (интраоперационно), металлоконструкции, извлеченные во время ревизионной операции, раневое отделяемое из дренажей (в послеоперационном периоде). Из свищевых ходов забор материала не производился. Исследованию подвергали весь биоматериал от пациентов, поступивших с перипротезными инфекциями в РГП на ПХВ «Национальный научный центр травматологии и ортопедии имени академика Батпенова Н. Д.» МЗ РК, г. Астана, за период 2019–2022 годы, которые обращались из всех регионов Казахстана.
Для выявления перипротезных инфекций биоматериал исследовался специальным методом. Посев биоматериала проводили классическим бактериологическим методом на различные питательные среды с обязательным исследованием на аэробы, поэтому посевы обязательно проводили на агар Шадлера (с повышенной концентрацией углекислого газа до 5%), окраску мазков осуществлялась методом по Граму. Первичную идентификацию выделенных микроорганизмов проводили с изучением морфологических, культуральных и биохимических свойств. Полученные в динамике данные обработаны методом вариационной статистики.
Результаты исследования и их обсуждение
При исследовании биоматериала пациентов с подозрением на перипротезную инфекцию после оказания ортопедической травматологической помощи в динамике 2019–2022 годов получены следующие результаты. В 2019 году проведено 372 исследования биоматериала с данной нозологической формой, из них негативных (отрицательных) результатов получено 182, что составляет 48,9%; в 2020 году проведено 257 исследований, выявлено 128 (49,8%) негативных результатов, в 2021 году проведено 479 исследований и выявлено 37,8% негативных результатов, в 2022 году – 500 исследований и 35,4% негативных результатов. За четыре исследуемых года у пациентов с периимплатной инфекцией было идентифицировано 27 видов микроорганизмов, которые авторы сгруппировали в 3 основные группы: Staphylococcus spp., семейство Enterobacteriaceae и другие микроорганизмы, что представлено на рисунке 1.
Всего за четыре года было исследовано 1750 биопроб на перипротезную инфекцию. Микроорганизмы в единичных случаях были выявлены в варианте микст-инфекции, т.е. обычно были представлены в моноварианте.
На рисунке 1 приведены данные, согласно которым можно утверждать, что в 2/3 случаев этиологическими причинами возникновения воспалительного процесса после проведенных ортопедических травматологических операций за исследуемый период явилось семейство стафилококков (Staphylococcus spp.) – 65%.
Второе место заняло семейство Enterobacteriaceae, которое явилось причиной соответственно 26,1% случаев возникновения воспалительного процесса. Третье место принадлежит редко встречающимся микроорганизмам, к которым авторы отнесли бактерии – другие микроорганизмы, их было идентифицировано 11,8%, которых выделено 8 видов – энтерококки, стрептококки, грибы рода Candida.
Далее на рисунке 2 по годам наблюдаем выделение от пациентов с подозрением на перипротезную инфекцию идентифицированных микроорганизмов семейства Enterobacteriaceae.
Стабильно прослеживается тенденция выделения штаммов микроорганизмов семейства Enterobacteriaceae в количестве 23–30,7% в течение четырех лет, с наименьшим значением в 2021 году. При этом в динамике отмечается незначительное увеличение данной группы микроорганизмов в сравнении 2019 года с 2020 годом на 2,1%, в 2021 году отмечен рост на 1,9% относительно 2022 года. При этом в 2021 году, вероятно, из-за эпидемии COVID-19, результат исследования был некорректным, поскольку не все больные Казахстана имели возможность лечиться в данном центре. Поэтому, согласно рисунку 2, колебания количества выделенных штаммов семейства Enterobacteriaceae были зафиксированы за исследуемый период стабильно с изменениями на 1,9–2,1%. Среднее значение выделенных штаммов данного семейства в течение последних четырех лет – 26,1%, благодаря чему авторы могут предположить, что у пациентов с патологией ППИ стабильно идентифицируются выделенные штаммы микроорганизмов данного семейства более чем в 1/4 всех случаев.
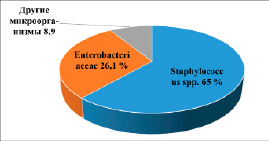
Рис. 1. Соотношение основных групп и семейств, выделяемых при перипротезных инфекциях, в процентах, за 2019–2022 годы, среднее значение
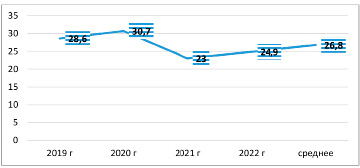
Рис. 2. Выделенное количество штаммов микроорганизмов семейства Enterobacteriaceae из всего количества идентифицированных микроорганизмов, в %, от пациентов с подозрением на перипротезные инфекции, за 2019–2022 годы
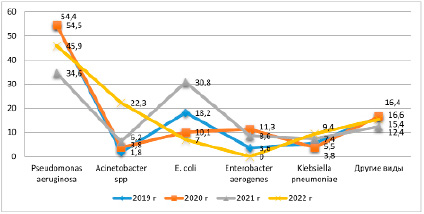
Рис. 3. Сравнительная динамика выделенных штаммов внутри группы Enterobacteriaceae в процентном соотношении, идентифицированных от пациентов с подозрением на перипротезные инфекции, 2019–2022 годы
Далее рассмотрим рисунок 3, который показывает соотношение выделенных в лаборатории штаммов внутри самого семейства Enterobacteriaceae. Наиболее часто идентифицирован (с волнообразным колебанием) Pseudomonas aeruginosa. В 2019 и 2020 годах отмечено стабильно высокое выделение данного вида – в 54,4–54,5% случаев – с дальнейшим спадом выделения в 2021 году до 34,6% и увеличением в 2022 году до 45,9%. Среднее количество Pseudomonas aeruginosa за текущий период составило 47,3%, т.е. почти половина представителей семейства — это данный микроорганизм.
Следующий представитель семейства Enterobacteriaceae по частоте встречаемости – это Escherichia сoli. Его выделение в 2019 году было на уровне 18,2% с дальнейшим снижением в 2020 году до 10,1%, повышение отмечено в 2020 году до 30,8%, снижение – в 2021 году до минимального значения 7%. Согласно представленным данным, в течение четырех исследуемых лет у пациентов при перипротезных инфекциях наблюдаем также волнообразную идентификацию данного вида со средним значением 16,5%.
Далее рассмотрим три вида данной группы микроорганизмов: Acinetobacter spp., Enterobacter aerogenes и Klebsiella pneumoniae, которые в разные годы были конкурирующими видами по отношению друг к другу при исследовании пациентов на перипротезную инфекцию. В динамике четырех лет Acinetobacter spp. выделялся с нарастанием 2019 году в 1,8% случаев, в 2020 году – в 3,8%, 2021 году – в 6,2%, 2022 году – в 22,3%, увеличение за данный период произошло значительное – в 12,3 раза.
Enterobacter aerogenes выделялся у пациентов с перипротезной инфекцией волнообразно: в 2019 году – в 3,6% случаев, 2020 году – в 11,3%, 2021 году – в 8,6%, особенностью является его отсутствие в 2022 году.
Наличие вида Klebsiella pneumoniae на протяжении четырех лет имело тенденцию к незначительному нарастанию, за исключением 2020 года, когда пациенты имели ограничения для госпитализации по эпидемиологическим показаниям (COVID-19), вследствие чего официальные данные могут не совпадать с истинной картиной. Мониторинг данного вида отражает следующие показатели: 2019 год – 5,5%, 2020 год – 3,8%, 2021 год – 7,4%, 2022 год – 9,4%.
Наиболее незначительно выделенными были следующие четыре представителя данного семейства: Providencia rettgeri, Morganella morganii, Edwardsiella tarda, Citrobacter diversus. Они были идентифицированы единично, нет стабильности выделения их ежегодно, поэтому их объединили в группу другие виды.
Заключение
Исходя из вышеизложенного, можно предположить, что манифестация инфекции COVID-19 вызвала увеличение в динамике выделения более резистентных штаммов, таких как Acinetobacter spp. с заменой Enterobacter aerogenes и E. сoli, при этом имело место стабильно высокое выделение Pseudomonas aeruginosa. Следовательно, в связи с бесконтрольным применением антибактериальных препаратов в период пандемии COVID-19 произошла смена возбудителей мало резистентных (Enterobacter aerogenes и E. сoli) на более резистентные, которые имеют тенденцию к формированию биопленок на поверхности металлоконструкций, – Acinetobacter spp. и Pseudomonas aeruginosa, являющихся представителями неферментирующих грамотрицательных бактерий.
Штаммы семейства Enterobacteriaceae за исследуемый период выделены в 26,1% случаев, что составляет более 1/4 от всего количества выделенных бактерий у пациентов с ППИ.
При сравнительном анализе внутри семейства Enterobacteriaceae за 2019–2022 годы выявлены средние показатели за этот период пяти основных видов и других редко встречающихся штаммов: Pseudomonas aeruginosa – 47,3%, E. coli – 16,5%, Acinetobacter spp. – 8,5%, Enterobacter aerogenes – 7,8% (2019–2021 годы), Klebsiella pneumoniae – 6,5%, другие представители семейства – 15,2%, которых идентифицировано четыре вида.
Проведенный анализ исследований по выявлению штаммов семейства Enterobacteriaceae при перипротезной инфекции позволяет сделать пессимистичные выводы по наличию резистентных штаммов, прогнозирующие дальнейший рост резистентности в Республике Казахстан и связанные с этим ухудшение прогноза лечения, увеличение инвалидизации и смертности.
Библиографическая ссылка
Плиска Н.Н., ?айржан Д.Т. ДИНАМИКА ВЫДЕЛЕНИЯ ЭНТЕРОБАКТЕРИИ ПРИ ПЕРИПРОТЕЗНЫХ ИНФЕКЦИЯХ // Международный журнал прикладных и фундаментальных исследований. 2023. № 8. С. 12-17;URL: https://applied-research.ru/ru/article/view?id=13564 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13564

