Воспаление является нормальной реакцией на любой вредный раздражитель, угрожающий организму, и может варьироваться от локализованной до генерализованной реакции. Нестероидные противовоспалительные препараты (НПВП) достигают своего противовоспалительного действия за счет ингибирующего действия на фермент циклооксигеназу (ЦОГ), белок необходим для биосинтеза простагландинов из арахидоновой кислоты. ЦОГ существует в двух изоформах, а именно ЦОГ-1 и ЦОГ-2. В общих чертах, ЦОГ-1 отвечает за защиту слизистой оболочки желудка и поддержание гомеостаза, тогда как ЦОГ-2 индуцируется провоспалительными стимулами в очагах воспаления. Арахидоновая кислота является одним из основных компонентов фосфолипидов клеточных мембран и действует как нормальный субстрат для различных ферментов, таких как 5-липоксигеназа (5-ЛОГ) [1] и ЦОГ [2].
5-ЛОГ метаболизирует арахидоновую кислоту с образованием лейкотриенов, которые являются медиаторами при астме и воспалении, и инициирует биосинтез провоспалительных лейкотриеновых липидных медиаторов и вместе с 15-ЛОГ также необходима для синтеза противовоспалительных липоксинов. 5-липоксигеназа (5-ЛОГ) является одним из трех основных изоферментов, участвующих в метаболическом процессе арахидоновой кислоты, и существует в виде компенсаторного механизма с ЦОГ [3]. Лейкотриены (ЛТ), в конечном счете продуцируемые ЛОГ-путем, рассматриваются как важные медиаторы воспалительных и аллергических заболеваний и, как полагают, тесно связаны с раком и сердечно-сосудистыми заболеваниями [4]. Каталитическая активность 5-ЛОГ регулируется с помощью множества механизмов, включая Ca(2+)-направленное связывание с мембраной и фосфорилирование по специфическим сериновым остаткам. Следовательно, можно снизить потенциальный риск сердечно-сосудистых заболеваний, связанных с НПВП, путем ингибирования 5-ЛОГ и снижения синтеза ЛТ.
Биологическая активность производных антраниловой кислоты характеризуются широким спектром: анальгетической, противомикробной, в том числе и противовоспалительной [5, 6] и антиоксидантной [7].
Целью данной работы является расчет новых конформаций для двадцати гомологов ряда амидов и гидразидов N-ароил антраниловых кислот моделированием связывания с 5-ЛОГ, а также проверка результатов моделирования на экспериментальных данных торможения каррагенинового отека с помощью регрессионного анализа.
Материалы и методы исследования
Молекулярное моделирование исследуемых соединений ряда антраниловой кислоты осуществляли с помощью: ChemDraw и Gaussian 03. Расчет анализируемых конформаций с 5-липоксигеназой с PDB ID Code: 3v99 [8] проводили программным комплексом MGL Tools и AutoDock 4.2.. Подготовку исследуемых производных для молекулярного докинга AutoDock 4.2 осуществляли переведением веществ в трехмерный формат (.pdb) программой Marvin Sketch. Проверку результатов моделирования осуществляли на экспериментальных данных торможения каррагенинового отека программой Statistica 6.
Результаты исследования и их обсуждение
Молекулярное моделирование двадцати гомологов (I–XX) амидов и гидразидов N-ароил антраниловых кислот проводили программой ChemDraw.
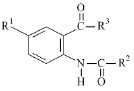
R1= H, R2= 4–BrC6H4, R3= NHCH2CH=CH2 (I); R1= H, R2= 2–фурил, R3= NHCH2CH=CH2 (II); R1= Br, R2= 2–COOH C6H4, R3= NH2 (III); R1= I, R2=2–фурил, R3=NHCH2C6H5 (IV); R1=H, R2=4–NO2C6H4, R3=NHCH2CH=CH2 (V); R1=Br, R2=2–фурил, R3= NHNHCOCH2Cl (VI); R1=Br, R2=2–фурил, R3= NHCH2CH2CH(CH3)2 (VII); R1= Br, R2= 2–фурил, R3= NHCH3 (VIII); R1= I, R2= –фурил, R3=NHCH3 (IX); R1= H, R2= 3, 4, 5–(OCH3)3C6H2, R3= NHCH2CH=CH2 (X); R1=Br, R2=2–фурил, R3=NHNHCOCH2CH2CH3 (XI); R1=Br, R2=2–фурил, R3=NHNHCO(2-фурил) (XII); R1= Br, R2= 2–фурил, R3= NHNHCOCH2C6H5 (XIII); R1= Br, R2= 2–фурил, R3=NHNHCO 2–COOHC6H4 (XIV); R1=I, R2=2–фурил, R3=N(CH3)2 (XV); R1=Br, R2=2–OCH3C6H4, R3=NH2 (XVI); R1=Br, R2=3–NO2C6H4, R3=NH2 (XVII); R1=Br, R2=2–фурил, R3=NHNH2 (XVIII); R1=H, R2= 4–OCH3C6H4, R3=NHCH2CH=CH2 (XIX); R1=I, R2=C6H5, R3=NHCH2CH2OH (XX).
Спектральные характеристики и результаты экспериментального определения противовоспалительной активности ПВА (ПВАэксп.) на модели торможения каррагенинового отека объекта исследования (I–XX) опубликованы в работе [9].
Для проведения расчета новых конформаций исследуемых амидов и гидразидов N-ароил антраниловых кислот выполняли молекулярный докинг с мутантной формой 5-ЛОГ с 10 мутациями [8].
Наш выбор биологической мишени основан на публикации, посвященной исследованию различных форм 5-ЛОГ, полученных из так называемой человеческой стабильной формы фермента 5-ЛОГ, в которой авторы отмечают, что модель 3V99 по своему составу предназначена для исследования связывания с субстратом в качестве структурной основы.
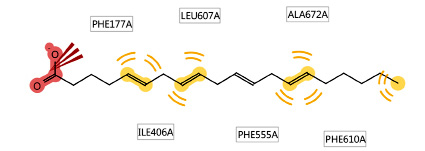
Рис. 1. Диаграмма взаимодействия арахидоновой кислоты с 5-ЛОГ
Таблица 1
Результаты молекулярного докинга по 5-ЛОГ: номер конформации, скоринговые функции и остатки аминокислот с водородной связью (Н-связь) и ПВАэксп.
|
№ |
Конформация № |
Н-связь (5-ЛОГ) |
Ki5-ЛОГ |
Be5-ЛОГ |
Ime5-ЛОГ |
ПВАэксп., % |
|
I |
3 |
нет |
463,25 |
-4,55 |
-6,04 |
33,60 |
|
II |
3 |
нет |
155,06 |
-5,20 |
-6,69 |
66,30 |
|
III |
3 |
ARG596 |
63,81 |
-5,72 |
-7,21 |
59,95 |
|
IV |
9 |
ARG596 |
45,81 |
-5,92 |
-7,41 |
60,05 |
|
V |
6 |
GLY431, CYS300 |
1,77 |
-3,75 |
-5,54 |
-8,10 |
|
VI |
9 |
ARG596 |
112,45 |
-5,39 |
-6,88 |
46,40 |
|
VII |
4 |
ASN180 |
362,25 |
-4,69 |
-6,48 |
31,65 |
|
VIII |
3 |
ARG596 |
618,84 |
-4,38 |
-5,27 |
19,55 |
|
IX |
7 |
нет |
720,52 |
-4,29 |
-5,18 |
36,15 |
|
X |
7 |
ARG596 |
4,05 |
-3,26 |
-5,65 |
22,70 |
|
XI |
10 |
ARG596 |
500,34 |
-4,50 |
-6,29 |
35,65 |
|
XII |
2 |
GLY430, HIS432 |
346,25 |
-4,72 |
-6,21 |
42,05 |
|
XIII |
5 |
нет |
4,25 |
-3,24 |
-5,03 |
28,20 |
|
XIV |
9 |
ARG596, GLN363 |
201,13 |
-5,04 |
-7,13 |
33,65 |
|
XV |
10 |
ASN180 |
161,22 |
-5,17 |
-6,07 |
51,50 |
|
XVI |
9 |
ARG596 |
147,86 |
-5,23 |
-6,42 |
46,30 |
|
XVII |
7 |
GLY430, ASP293 |
473,06 |
-4,54 |
-5,73 |
46,15 |
|
XVIII |
10 |
нет |
347,11 |
-4,72 |
-5,91 |
41,05 |
|
XIX |
10 |
нет |
1,09 |
-4,04 |
-5,83 |
36,50 |
|
XX |
8 |
нет |
1,10 |
-4,03 |
-5,82 |
21,30 |
Кроме того, активный центр модели 3V99 находится в открытой конфигурации, доступной для второй небольшой молекулы – исследуемого лиганда.
Для оптимизации дизайна исследования методом молекулярного докинга и проведения расчета новых конформаций необходимо было выявить и локализовать сайт связывания лигандов с биологической мишенью, в пределах которого проводилось дальнейшее моделирование.
Локализацию сайта связывания проводили на основе комплекса внутри исследуемой мутантной формы 5-ЛОГ: арахидоновой кислоты с активным участком (рис. 1).
На рис. 1 изображен комплекс арахидоновой кислоты с активным участком 5-ЛОГ.
Диаграмма, представленная на рис. 1, показывает наличие ионизационных и гидрофобных взаимодействий. Ионизационная связь образуется по карбоксильной группе арахидоновой кислоты с остатком фенилаланина (PHE177). Структурные фрагменты арахидоновой кислоты, содержащие двойные связи и алкильный радикал, гидрофобно ориентируются рядом с остатками фенилаланина (PHE177, PHE555, PHE610), изолейцина (ILE406), лейцина (LEU607), аланина (ALA672). Локальный участок связывания внутри 5-ЛОГ мы определили в координатах: x= 16,91, y= – 72,12, z= – 47,24.
Далее проводили построение 20 Grid-карт (x= 16,91, y= – 72,12, z= – 47,24), с координатами точек (60 × 60 × 60) внутри исследуемой ячейки 5-ЛОГ. Выполнен расчет 10 конформаций по каждому исследуемому амиду и гидразиду N-ароил антраниловой кислоты. Анализ результатов расчета новых конформаций проводили по RMSD относительно арахидоновой кислоты. Полученные конформации по каждому исследуемому соединению представлены в табл. 1.
Анализ результатов расчета новых конформаций приведен в табл. 1 в виде энергии докинга (Be5-ЛОГ) и скоринговых функций, характеризующих межмолекулярные взаимодействия (межмолекулярная энергия (Ime5-ЛОГ)) и количество вещества, необходимое для связывания активного участка (константа ингибирования (Ki5-ЛОГ)).
Наибольшее значение энергии связывания с 5-ЛОГ, равное -5,92 ккал/моль, найдено по конформации № 9 для соединения IV (рис. 2), межмолекулярная связь показывает взаимодействие карбонильной группы в NH-ацильном фрагменте по аминокислоте аргинин (ARG 596).
Осуществлена проверка результатов моделирования на экспериментальных данных торможения каррагенинового отека с помощью множественного линейного регрессионного анализа. Проведено составление регрессионных многофакторных моделей зависимости и связи экспериментальных данных торможения каррагенинового отека с конформационным анализом.
Проверку осуществляли исследованием зависимости ПВАэксп. от Be5-ЛОГ, Ime5-ЛОГ, Ki5-ЛОГ. Полученные результаты представлены уравнениями с наибольшими значениями коэффициента множественной регрессии (R), критерия Фишера (F) и минимальным значением средней квадратичной ошибки (S) (табл. 2).
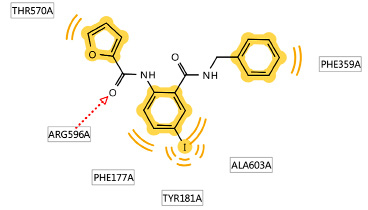
Рис. 2. Диаграмма взаимодействия соединения IV с 5-ЛОГ в активном участке фермента
Таблица 2
Уравнения регрессии зависимости ПВАэксп. от Be5-ЛОГ, Ime5-ЛОГ, Ki5-ЛОГ
|
№ |
Уравнение регрессии |
R |
F |
S |
N |
|
1 |
ПВАрассч.1 = – 39,0983 – 18,8373 × Be5-ЛОГ + 1,6908 × Ime5-ЛОГ |
0,762 |
11,77 |
11,47 |
20 |
|
2 |
ПВАрассч.2 = – 42,9889 – 17,5416 × Be5-ЛОГ – 0,0021 × Ki5-ЛОГ |
0,761 |
11,74 |
11,48 |
20 |
Выводы
1. Методом молекулярного моделирования построены трехмерные модели исследования взаимодействия амидов и гидразидов N-ароил антраниловых кислот с мутантной формой 5-ЛОГ.
2. Выполнен расчет новых двадцати конформаций взаимодействия исследуемых производных с мишенью 3v99 мутантной формы 5-липоксигеназы.
3. Осуществлена проверка результатов поиска соединений с ПВА на экспериментальных данных торможения каррагенинового отека, в результате получены две двухфакторные модели зависимости с высоким значением R в интервале от 0,761 до 0,762.
Библиографическая ссылка
Андрюков К.В. МОЛЕКУЛЯРНЫЙ ДОКИНГ В ИССЛЕДОВАНИИ ВЗАИМОДЕЙСТВИЯ АМИДОВ И ГИДРАЗИДОВ N-АРОИЛЗАМЕЩЕННЫХ АНТРАНИЛОВЫХ КИСЛОТ С МУТАНТНОЙ ФОРМОЙ 5-ЛИПОКСИГЕНАЗЫ В ПОИСКЕ СОЕДИНЕНИЙ С ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ // Международный журнал прикладных и фундаментальных исследований. 2023. № 10. С. 38-42;URL: https://applied-research.ru/ru/article/view?id=13583 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13583

