Оценка высвобождения лекарственных веществ (ЛВ) через полупроницаемую мембрану является одним из важных этапов в поиске и разработке перспективного препарата [1]. Мембраны, используемые в исследованиях высвобождения in vitro, были разработаны для обеспечения постоянного контакта между лекарственной формой (ЛФ) и рецепторной средой. При этом мембраны не должны проявлять какого-либо физического или химического взаимодействия с лекарственной субстанцией (ЛС) и должны быть совместимы с рецепторной средой и обеспечивать минимально возможное сопротивление диффузии действующего вещества.
В качестве мембраны используют различные материалы, чаще целлофановую пленку. Целлофан инертен, не вступает во взаимодействие ни с субстанцией, ни с компонентами лекарственной формы, а его толщина оказывает незначительное влияние на диффузию ЛВ. Существуют две основные группы мембран – натуральные и искусственные [2]. Синтетические мембраны широко используются для определения скорости высвобождения активного соединения in vitro из различных ЛФ. Их основными преимуществами являются доступность, стабильность и эффективность использования в ходе эксперимента. Основным преимуществом синтетических мембран по отношению к натуральным является однородность их состава и стабильность свойств от партии к партии. На сегодняшний день на рынке представлено большое количество синтетических мембран на основе целлюлозы, ее производных и различных полимеров.
Важным аспектом в исследованиях высвобождения является выбор рецепторной среды. Рецепторная среда должна обладать способностью к солюбилизации исследуемого вещества, хорошо перемешиваться и не ограничивать диффузию исследуемого вещества [2]. Чаще всего используемыми рецепторными средами для водорастворимых лекарственных средств являются вода очищенная, буферные растворы и изотонический раствор натрия хлорида. Однако для препаратов с нерастворимым в воде ЛВ выбор подходящей рецепторной среды является сложной задачей. В наших исследованиях рецепторная среда имитировала физиологически активные среды желудка и кишечника.
Цель исследования – изучить особенности высвобождения ФБЗ и ФНС из их твердых дисперсий различных составов, полученных в различных типах измельчителей-активаторов.
Материалы и методы исследования
Фенбендазол (ФБЗ) – 5-(фенилтио)-2-бензимидазолкарбамат (99,0 %) фирмы Changzhou Yabang Pharmaceuticals Co. Ltd (КНР). Растворимость в воде 1,0 мг/л. Тпл = +233 °С.
Фенасал (ФНС) – 5-хлор-N-(2-хлор-4-нитрофенил)-2-гидроксибензамид (99,3 %) компании Ghangzhou Yabang-Qh Pharmachem Co, Ltd. (КНР). Растворимость в воде 5,0 мг/л. Тпл = +225 – +230 °С.
Поливинилпирролидон (ПВП) – 1 этенилпирролидин-2-он марки К-15 компании Boai NKY Pharmaceuticals Ltd. (КНР).
Для получения экспериментальных составов в виде твердых дисперсий:
− состав № 1 – ФБЗ:ФНС:ПВП (2:20:78),
− состав № 2 – ФБЗ:ФНС:ПВП (3:30:67),
− состав № 3 – ФБЗ:ФНС:ПВП (4:40:56) –
использовались валковая мельница LE-101 и еще планетарно-центробежный активатор АГО-2.
Приготовление экспериментальных составов в валковой мельнице LE-101. Для получения ТД состава № 1 проводили совместную механообработку субстанций ФБЗ и ФНС с ПВП в условиях [3]. Компоненты загружали в массовых соотношениях 2:20:78 в металлический барабан валковой мельницы LE-101. Барабан емкостью 0,8 см3 последовательно загружали предварительно приготовленной шихтой (физическая смесь) из 3,0 г ФБЗ, 30,0 г ФНС и 117,0 г ПВП. Далее в барабан добавили 1880 г стальных шаров (35 шаров диаметром 25 мм) и проводили механообработку в течение 4 ч с отбором проб на анализ растворимости, как параметра, контролирующего процесс получения оптимальной ТД. Основными факторами механообработки были:
− объем загрузки барабана – 60 %;
− модуль процесса – 1:16;
− энергонапряженность – 1 g.
После завершения процесса механообработки из барабана была выгружена твердая дисперсия состава ФБЗ:ФНС:ПВП (2:20:78) /Состав № 1/ в количестве 148,8 г в виде сыпучего порошка светло-бежевого цвета.
Аналогично были приготовлены в валковой мельнице LE-101 твердые дисперсии состава № 2 (148,1 г) и состава № 3 (146,5 г).
Приготовление экспериментальных составов в планетарно-центробежном активаторе АГО-2. Шихту, приготовленную в фарфоровой ступке из 0,4 г ФБЗ, 4,0 г ФНС и 15,6 г ПВП, разделив на две равные части, поместили в два металлических барабана АГО-2, объемом 60 мл. Механообработку проводили при 20 g в течение 10 мин при следующих условиях:
− 300 г шаров (диаметр 5–6 мм);
− объем загрузки барабана – 60 %;
− модуль процесса – 1:38;
− энергонапряженность – 20g.
По окончании механообработки из двух барабанов выгрузили 18,5 г сыпучего желтоватого порошка композиции состава № 1 (образец под названием «1–20 g»).
Аналогично были приготовлены образцы:
− состава № 1
при 40 g (образец «1–40 g»)
и 60 g (образец «1–60 g»);
− состава № 2
при 20 g (образец «2–20 g»),
при 40 g (образец «2–40 g»)
и при 60 g (образец «2–60 g»);
− состава № 3
при 20 g (образец «3–20 g»),
при 40 g (образец «3–40 g»)
и при 60 g (образец «3–60 g»).
Для определения растворимости ФНС и ФБЗ в экспериментальных твердых дисперсиях в коническую колбу помещали 0,560 г соответствующей ТД и добавляли 10 мл воды. Перемешивали в течение 3 ч с использованием магнитной мешалки Heidolph MR 3001 K со скоростью 200–250 об/мин при 37 °С. Полученную при этом суспензию центрифугировали при следующих условиях:
− скорость центрифугирования 12500 об/мин;
− время центрифугирования 30 мин.
Полученные после центрифугирования прозрачные водные растворы анализировали методом ВЭЖХ на хроматографе Agilent 1200 с колонкой Zorbax Eclipse XDB-C18, 4,6*50 мм; температура колонки +30 °С; детектор диодно-матричный. В качестве элюента применяли систему ацетонитрил-ацетатный буфер рН 3,4 (55:45), скорость потока – 1 мл/мин, объем пробы – 5 мкл [4].
УФ-спектры для высвобожденных субстанций ФБЗ и ФНС в буферном растворе бората натрия с рН = 9,18 и растворе 0,1 н соляной кислоты регистрировались [5] на компьютеризированном УФ-спектрометре Specord M-40 Carl Zeis в кварцевых кюветах.
Для проведения метода диализа использовали лабораторную установку, состоящую из термостатированного стакана, установленного на магнитной мешалке Heidolph MR 3001 K. В стакан помещали расчетный объем рецепторной среды, для которой поддерживалась температура 37±0,5 °С. Исследуемое количество ТД (около 0,5 г с точностью 0,001 г) наносили внутрь диализного мешка с полупроницаемой мембраной, которую потом погружали в стакан. Отбор проб диализата производили через равные промежутки времени с восполнением рецепторной среды. В качестве полупроницаемых мембран использовали нитроцеллюлозную мембрану (НЦМ), представляющую собой бумагоподобную матрицу [6], а также синтетические мембраны в виде диализных мешков Spectrapor фирмы Spectrum Medical Industry (США) и M-Cel фирмы Viscase (Франция) [7]. Для изучения процесса высвобождения компонентов экспериментальных составов были использованы следующие рецепторные среды:
− система (А), моделирующая среду кишечника (стандартный раствор тетрабората натрия Na2B4O7Х10H2O с рН = 9,18);
− система (В), моделирующая среду желудка (стандартный раствор 0,1 н соляной кислоты).
Содержание ФБЗ и ФНС в диализатах контролировали методами ВЭЖХ и данными УФ-спектров.
Результаты исследования и их обсуждение
Экспериментальные составы готовили и анализировали на растворимость, исходя из данных хроматограмм (рис. 1 и 2).
Условия приготовления экспериментальных составов представлены ниже:
(А) в валковой мельнице LE-101 с энергонапряженностью 1 g (в табл. 1 и 2 представлены данные по составу № 1 и его растворимости в динамике);
(В) в планетарно-центробежном активаторе АГО-2 с регулируемой (20, 40 и 60 g) энергонапряженностью.
Таблица 1
Растворимость фенбендазола (ФБЗ) в образцах ТД композиций ФБЗ:ФНС:ПВП (2:20:78), полученных при варьировании времени механообработки (м/о)
|
№ |
Наименование образца, условия получения |
Растворимость ФБЗ |
|
|
абсолютная |
увеличение |
||
|
1 |
ФБЗ – исх. субстанция |
1,0 |
– |
|
2 |
Проба 1 оп. 090223(1) – ФС состава ФБЗ:ФНС:ПВП (2:20:78) |
1,8 |
2 |
|
3 |
Проба 2 оп. 090223(1) – ТД состава ФБЗ:ФНС:ПВП (2:20:78), 2 ч м/о |
11,3 |
11 |
|
4 |
Проба 3 оп. 090223(1) – ТД состава ФБЗ:ФНС:ПВП (2:20:78), 3 ч м/о |
43,2 |
43 |
|
5 |
Проба 4 оп. 090223(1) – ТД состава ФБЗ:ФНС:ПВП (2:20:78), 4 ч м/о |
45,1 |
45 |
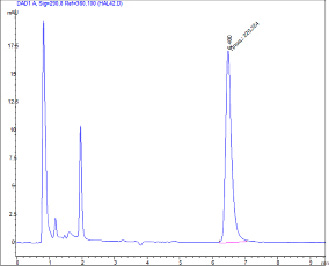
Рис. 1. Хроматограмма водного фильтрата состава № 1 для определения растворимости ФБЗ: А = 220, 290 нм, 6,480 мин, 5 мкл
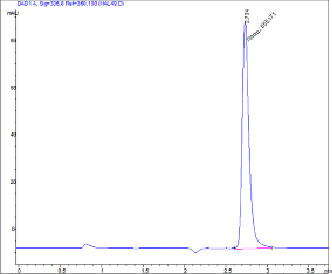
Рис. 2. Хроматограмма водного фильтрата состава № 1 для определения растворимости ФНС: А = 555, 336 нм, 2,734 мин, 5 мкл
Таблица 2
Растворимость фенасала (ФНС) в образцах ТД композиций ФБЗ:ФНС:ПВП (2:20:78), полученных при варьировании времени механообработки (м/о)
|
№ |
Наименование образца, условия получения |
Растворимость ФНС |
|
|
абсолютная |
увеличение |
||
|
1 |
ФНС – исх. субстанция |
5,0 |
– |
|
2 |
Проба 1 оп. 090223(1) – ФС состава ФБЗ:ФНС:ПВП (2:20:78) |
60,0 |
12 |
|
3 |
Проба 2 оп. 090223(1) – ТД состава ФБЗ:ФНС:ПВП (2:20:78), 2 ч м/о |
130,2 |
26 |
|
4 |
Проба 3 оп. 090223(1) – ТД состава ФБЗ:ФНС:ПВП (2:20:78), 3 ч м/о |
315,1 |
63 |
|
5 |
Проба 4 оп. 090223(1) – ТД состава ФБЗ:ФНС:ПВП (2:20:78), 4 ч м/о |
329,5 |
66 |
Таблица 3
Данные диализа ФНС за 192 ч из образцов ТД, полученных в планетарно-центробежном активаторе АГО-2
|
№ образца |
Информация об образце |
% высвобождения ФНС |
|
№ 0 |
Техническая смесь ФБЗ и ФНС |
1,0 % |
|
№ 1 – образец 1–20 g |
ТД состава ФБЗ:НФС:ПВП (2:20:78) |
16,2 % |
|
№ 2 – образец 2–40 g |
ТД состава ФБЗ:НФС:ПВП (3:30:67) |
6,7 % |
|
№ 3 – образец 3–60 g |
ТД состава ФБЗ:НФС:ПВП (4:40:56) |
5,6 % |
Анализ данных табл. 1 указывает на то, что увеличение времени механообработки приводит к улучшению растворимости ФБЗ. Однако этот параметр имеет ограничение, и обработка в течение 4 ч не приводит к существенному увеличению растворимости ФБЗ. Поэтому это время обработки и было выбрано оптимальным для получения ТД состава № 1. Это оптимальное время было подтверждено и по анализу растворимости ФНС при получении состава № 1 (табл. 2), увеличение показателя до 66 раз.
Аналогично была изучена растворимость ФБЗ и ФНС из составов № 2 и 3, и было показано, что:
− в составе № 2 наблюдается увеличение растворимости ФБЗ в 38 раз и ФНС в 52 раза;
− в составе № 3 – увеличение растворимости ФБЗ в 31 раз и ФНС в 37 раз.
Растворимость компонентов (ФБЗ и ФНС) из ТД, полученных в АГО-2, значительно уступала и составляла: по ФБЗ – в 5–12 раз, ФНС – в 9–20 раз. Такой результат можно объяснить образованием спекшихся агломератов в жестких условиях механообработки в АГО-2.
При проведении диализа в буферный раствор с рН = 9,18 высвобождение ФБЗ проходило, вероятно, с концентрацией ниже чувствительности метода. Этого надо было ожидать в связи с относительно низкой концентрацией ФБЗ в экспериментальных составах по сравнению с ФНС (сравн.: 2 и 20 % /состав № 1/, 3 и 30 % /состав № 2/, 4 и 40 % /состав № 3/). Поэтому проводили анализ ВЭЖХ лишь одного компонента – ФНС, и результаты анализа представлены в табл. 3 и 4.
Из данных табл. 3 следует, что высвобождение ФНС из образцов, подвергнутых жесткой механообработке (например, 60 g), идет медленнее, чем из образцов при мягких условиях – 20 g.
Анализ данных табл. 4 показывает, что высвобождение ФНС из ТД, полученных в валковой мельнице, выше, чем таковых, полученных в АГО-2. Такой результат можно объяснить комплексообразованием, что косвенно подтверждается данными УФ-спектров образцов № 5, 6 и 7, в которых наблюдается появление новой полосы в области 377–380 нм, что отличается от полос поглощения ФБЗ (290 нм) и ФНС (336 нм) (рис. 3, а, б).
Весьма интересные данные были обнаружены при диализе составов № 1, 2 и 3 в среде желудочного сока. Из указанных ТД в диализат проходит лишь ФБЗ (рис. 4).
Таблица 4
Данные диализа ФНС за 48 ч из образцов ТД, полученных в валковой мельнице LE-101 при механообработке за 4 ч
|
№ образца |
Информация об образце |
% высвобождения ФНС |
|
№ 4 – физ. смесь состава № 1 |
ФС состава ФБЗ:НФС:ПВП (2:20:78) |
7,9 % |
|
№ 5 – состав № 1 |
ТД состава ФБЗ:НФС:ПВП (2:20:78) |
27,3 % |
|
№ 6 – состав № 2 |
ТД состава ФБЗ:НФС:ПВП (3:30:67) |
22,2 % |
|
№ 7 – состав № 3 |
ТД состава ФБЗ:НФС:ПВП (4:40:56) |
16,7 % |
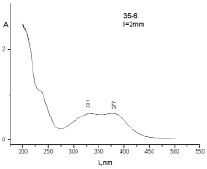
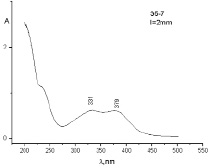
(а) (б)
Рис. 3. УФ-спектры диализатов ТД состава № 2 (а) и состава № 3 (б)
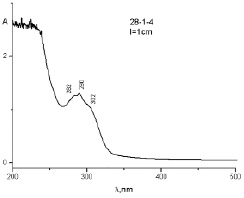
Рис. 4. УФ-спектр образца 1–20 g при диализе в 0,1 н HCI за 280 ч
Этот результат можно объяснить протонированием молекулы ФБЗ, являющейся слабым основанием. Молекула ФНС является нейтральной молекулой и поэтому не проникает через полупроницаемую перегородку в среду соляной кислоты, и она полностью остается внутри диализного мешка (рис. 5).
Из данных рис. 5 видно, что внутри мешка остается смесь, в которой содержание ФБЗ уменьшилось, а содержание ФНС осталось без изменения.
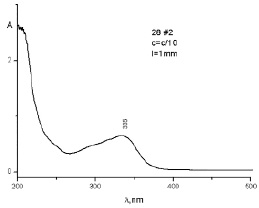
Рис. 5. УФ-спектр раствора из ТД состава № 1 (1–20 g), оставшегося внутри диализного мешка после диализа в соляную кислоту в течение 280 ч
Заключение
Проведенные исследования по высвобождению активных субстанций ФБЗ и ФНС из ТД, полученных в валковой мельнице LE-101 и планетарно-центробежном активаторе АГО-2, показали, что диализ этих компонентов происходит в среду желудочного сока и среду, моделирующую кишечник, по различным механизмам, которые требуют дальнейших исследований.
Библиографическая ссылка
Халиков С.С., Кононова Е.Г., Халиков М.С., Ильин М.М. ВЫСВОБОЖДЕНИЕ СУБСТАНЦИЙ ФЕНБЕНДАЗОЛА И ФЕНАСАЛА ИЗ ИХ ТВЕРДЫХ ДИСПЕРСИЙ // Международный журнал прикладных и фундаментальных исследований. 2024. № 1. С. 33-39;URL: https://applied-research.ru/ru/article/view?id=13608 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13608

