Введение
Акриламид (АА) – производственный токсикант. Кроме того, он может поступать в организм с пищевыми продуктами, содержащими крахмал, которые подвергались термической обработке выше 120°C [1, 2]. Токсичность АА для различных систем организма достаточно детально изучена [3, 4]. Экспериментально доказана его гепатотоксичность [5, 6]. Показано, что длительное воздействие АА снижает активность ферментов печени и повышает уровень показателей перекисного окисления липидов (ПОЛ) [7]. Некоторые авторы считают, что это связано с подавлением АА активности антиокислительных ферментов клетки [8].
Ядерный транскрипционный фактор Nfe2l2 отвечает за поддержание клеточного окислительно-восстановительного баланса за счет регуляции экспрессии ключевых генов актиоксидантных и детоксикационных ферментов [9]. Связывание Nfe2l2 с последовательностью ARE в регуляторной области генов-мишеней активирует каскад реакций, которые обеспечивают защиту клеток от воздействия активных кислородных радикалов [10]. Ген Nqo1 также оказывает защитное влияние на клетки от окислительного стресса [11, 12]. Ключевым компонентом антиоксидантной защиты организма, нейтрализующей постоянно образующиеся активные формы кислорода, являются супероксиддисмутазы (СОД). Ген Sod1 кодирует фермент супероксиддисмутазу-1 (СОД1), принимающий непосредственное участие в антиокислительном ответе клеток [13].
В литературе чаще описываются симптомы хронического воздействия АА, однако имеются сведения и об острых отравлениях, связанных с его пероральным приемом [14]. Поскольку вероятность контакта человека с данным токсикантом достаточно велика, особенно в быту, актуально дальнейшее проведение фундаментальных исследований по детализации механизмов его токсического действия и возможности медикаментозной коррекции последнего.
Цель исследования – изучить транскрипционную активность генов Sod1, Nqo1 и Nfe2l2 в ткани печени крыс при остром воздействии высоких доз акриламида и на фоне профилактической коррекции.
Материалы и методы исследования
Исследования проведены на 30 аутбредных крысах-самках с массой тела, равной 189–194 г в начале эксперимента. Животные были разделены на 5 групп: 1 – группа, которая не подвергалась какому-либо воздействию (К-, отрицательный контроль), 2 – группа, подвергшаяся воздействию АА (К+, положительный контроль), 3 – группа, подвергшаяся воздействию АА на фоне приема комплексного соединения оксиметилурацила с аскорбиновой кислотой (МГ-1) в дозе 50 мг/кг массы тела (АА+МГ1), 4 – группа, подвергшаяся воздействию АА на фоне приема комплексного соединения оксиметилурацила с сукцинатом натрия (МГ-2) в дозе 50 мг/кг массы тела (АА+МГ-2), 5 – группа, подвергшаяся воздействию АА на фоне приема комплексного соединения оксиметилурацила с ацетилцистеином (МГ-10) в дозе 500 мг/кг массы тела (АА+МГ-10).
Животные 3–5 групп внутрижелудочно получали комплексные соединения оксиметилурацила первые 5 дней эксперимента, животным 1 и 2 группы вводили аналогично эквивалентные объемы дистиллированной воды. Через 1 ч после последнего введения корректирующего препарата крысам 2–5 групп вводили внутрижелудочно АА в дозе 150 мг/кг массы тела.
Через 24 ч после введения токсиканта была оценена летальность животных и проведена эвтаназия выживших. Образцы печени для генетических исследований замораживали в жидком азоте и заливали реагентом Extract RNA, затем проводили выделение суммарной РНК. Для синтеза кДНК использовали набор готовых реагентов («Евроген», Россия). Определение транскрипционной активности генов проводили в режиме реального времени методом ПЦР на амплификаторе Rotor-Gene Q («Qiagen», Германия).
Статистический анализ проводили с использованием программного обеспечения SPSS Statistics 21.0 (IBM, USA). Критерий Колмогорова – Смирнова использовали в качестве критерия нормальности распределения признаков по группам. Для оценки значимости различий между группами использовали однофакторный дисперсионный анализ (ANOVA) и апостериорные критерии Тьюки и Тамхейна. Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
Данные по гибели животных по группам приведены в таблице.
Данные по летальности крыс, доза 150 мг/кг массы тела
|
Группы животных |
Количество животных в группе |
Количество павших животных |
|
К - |
6 |
0 |
|
К + |
6 |
1 |
|
АА + МГ1 |
6 |
1 |
|
АА + МГ2 |
6 |
2 |
|
АА + МГ10 |
6 |
0 |
Из представленных данных видно, что доза 150 мг/кг массы тела при однократном поступлении оказалась практически ниже среднесмертельной для крыс-самок. Вместе с тем только в группе, получавшей в профилактическом режиме препарат МГ-10, все животные остались живы, как и в группе отрицательного контроля.
Полученные авторами результаты свидетельствуют об активации системы антиоксидантной защиты клеток печени после воздействия АА, что согласуется с данными литературы [7, 8]. Об этой активации судили по изменению уровня экспрессии гена Nfe2l2, который запускает каскад реакций, связанных с антиоксидантной защитой [10]. Проведенный анализ биостатистических данных выявил значимые диспаратности в средней интенсивности транскрипции гена Nfe2l2 в тканях печени (рис. 1) между группами К- и АА+МГ1 (F = 5,42, p = 0,0068). Максимальный индекс экспрессии гена (-0,14±0,14) отмечен в контрольной группе K-. Минимальная экспрессия была зафиксирована в группе АА+МГ1 (-1,07±0,40). В экспериментальной группе K+ наблюдался показатель экспрессии -0,74±0,29, еще ниже он зафиксирован в группе АА+МГ-2 (-1,07±0,40). Ближе всего к данным группы отрицательного контроля находилась экспрессия гена Nfe2l2 в группе АА+МГ10 (-0,11±0,22).
Уровень экспрессии гена Sod1, кодирующего фермент супероксиддисмутазу 1, который катализирует дисмутацию супероксид-анионов в перекись водорода и кислород [13], также продемонстрировал изменения. При анализе транскрипционной активности гена Sod1 было установлено следующее: самый высокий уровень экспрессии наблюдался в контрольной группе K- (0,09±0,25), в группе положительного контроля К+ он был ниже (-0,78±0,37), еще ниже – в группах АА+МГ-1 (-1,26±0,32) и АА+МГ-2 (-1,59±0,33), и только в группе АА+МГ-10 экспрессия стал выше (-0,47±0,35), но различия не имели статистической значимости. Значимыми (F = 7,71, p = 0,0013) были лишь различия между экспрессией гена в группах АА+МГ-2 и К- (рис. 2).
Разница в средней интенсивности экспрессии гена Nqo1 в печени, кодирующего фермент NAD(P)H: убихиноноксидоредуктазу 1, который также играет ключевую роль в защите клетки против окислительного стресса (рис. 3), между изучаемыми группами не достигла статистической значимости (F = 0,89, p = 0,4617). Самый низкий уровень экспрессии был зафиксирован в контрольной группе K- (0,25±0,35), в то время как самый высокий уровень наблюдался в группе АА+МГ10 (1,07±0,21). В группе K+ уровень экспрессии гена Nqo1 (0,30±0,51) был слегка выше по сравнению с группой K-. В группе АА+МГ1 уровень экспрессии составил 0,83±0,29, а в группе МГ2 – 0,8±0,45. Экспрессия гена Nqo1 в группе АА+МГ10 была самой высокой и составила 1,07±0,21.
Молекулярные механизмы токсичности АА основаны на нескольких патогенетических путях, включая развитие окислительного стресса, индукцию апоптоза и воспалительную реакцию [15, с. 113696]. Некоторые химические агенты, обладая антиоксидантными свойствами и способностью модулировать внутриклеточные сигнальные пути, могут вмешиваться в эти процессы, тем самым снижая выраженность токсического воздействия АА.
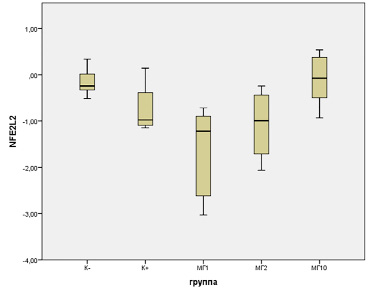
Рис. 1. Уровень экспрессии гена Nfe2l2 в ткани печени крыс-самок при экстремальном воздействии акриламида и профилактической коррекции комплексными соединениями оксиметилурацила
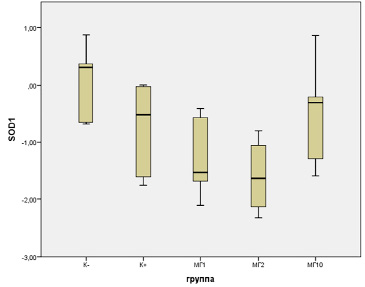
Рис. 2. Уровень экспрессии гена Sod1 в ткани печени крыс-самок при экстремальном воздействии акриламида и профилактической коррекции комплексными соединениями оксиметилурацила
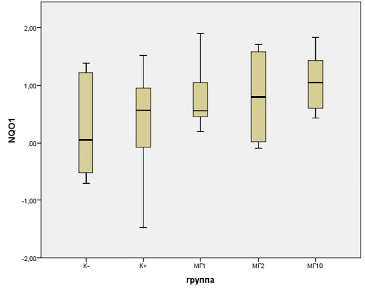
Рис. 3. Уровень экспрессии гена Nqo1 в ткани печени крыс-самок при экстремальном воздействии акриламида и профилактической коррекции комплексными соединениями оксиметилурацила
Согласно проведенным исследованиям, МГ-1, содержащий аскорбиновую кислоту, которая по неясным механизмам оказывает положительное влияние на состояние организма при воздействии АА [15], а также МГ-2, оказались менее эффективными в защите клеток от токсического действия АА по сравнению с МГ-10.
Предполагается, что выраженный протекторный эффект МГ-10 связан с его разнонаправленным защитным действием. Ацетилцистеин, входящий в состав МГ-10, с одной стороны, проявляет антиоксидантное действие за счет способности реактивных сульфгидрильных групп связываться с окислительными радикалами и нейтрализовать их. С другой стороны, он способствует синтезу глутатиона. Кроме того, ацетилцистеин известен своим защитным действием против воспалительных процессов, апоптоза и окислительного повреждения, индуцированного АА [15].
Заключение
Проведенные исследования показали, что при однократном поступлении доза 150 мг/кг массы тела акриламида для крыс-самок находится на уровне ниже среднесмертельной. По показателю летальности наиболее заметный защитный эффект проявил препарат МГ-10 – в данной группе все животные остались живы.
Транскрипционная активность гена Sod1 под воздействием акриламида снизилась. Еще ниже она оказалась в группах, получавших препараты МГ-1 и МГ-2. Профилактическое введение препарата МГ-10 проявилось в меньшем снижении экспрессии гена по сравнению с группой отрицательного контроля. Изменение активности гена Nfe2l2 по группам имело такую же направленность. Динамика активности гена Nqo1 была иной: во всех группах крыс, получавших акриламид, она стала выше, чем в группе отрицательного контроля.
Таким образом, гены Sod1 и Nfe2l2 можно отнести к маркерам наиболее раннего нарушения окислительно-восстановительного баланса в организме.
Наибольший протекторный антиоксидантный эффект проявляет комплексное соединение оксиметилурацила с ацетилцистеином (МГ-10).
Библиографическая ссылка
Репина Э.Ф., Рябова Ю.В., Якупова Т.Г., Хуснутдинова Н.Ю., Хмель А.О., Ахмадеев А.Р. ИЗМЕНЕНИЕ ТРАНСКРИПЦИОННОЙ АКТИВНОСТИ ГЕНОВ АНТИОКСИДАНТНОЙ ЗАЩИТЫ В ПЕЧЕНИ КРЫС В ОТВЕТ НА ОСТРОЕ ВОЗДЕЙСТВИЕ ВЫСОКИХ ДОЗ АКРИЛАМИДА // Международный журнал прикладных и фундаментальных исследований. 2024. № 9. С. 21-25;URL: https://applied-research.ru/ru/article/view?id=13656 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13656

