Введение
Мицелий базидиальных грибов и его метаболиты обладают широким спектром биологической активности, в частности противоопухолевой, антиоксидантной, антимикробной и противовирусной активностями [1-3]. Полисахаридные компоненты, выделенные из плодовых тел или мицелия базидиомицетов, являются перспективными иммуностимуляторами [4; 5]. Существенным преимуществом базидиальных полисахаридов является физиологичность их действия на организм и отсутствие токсичности. Грибы базидиомицеты выращивают в виде плодовых тел, а также получают вегетативный мицелий при глубинном культивировании. Глубинное культивирование позволяет осуществлять регулируемый синтез нужных метаболитов, сократить время процесса в 3–5 раз и получать стандартный продукт. Актуальность исследования заключается в поиске новых перспективных базидиомицетов с высокой продуктивностью биологически активных метаболитов.
Цель исследования – изучение процесса глубинного культивирования штаммов базидиомицетов для повышения выхода биомассы мицелия, изучение его компонентного состава и биологической активности.
Материалы и методы исследования
Объектами исследования были штаммы базидиальных грибов, полученные из Коллекции культур базидинмицетов Ботанического института им. В.Л. Комарова, РАН: Lentinus substrictus (Bolton) Zmitr. & Kovalenko LE-BIN 0626; L. substrictus LE-BIN 1601; Ganoderma valesiacum Boud. LE-BIN 2256; Grifola frondosa (Dicks.) Gray LE-BIN 2639; Ganoderma tsugae Murrill LE-BIN 1158; Flammulina velutipes (Curtis) Singer LE-BIN 1483.
Ростовые параметры и морфологические признаки исследуемых базидиомицетов изучали при культивировании на плотных питательных средах, где базидиомицеты образовывали мицелиальные колонии, состоящие из скопления вегетативных гиф.
Для определения скорости роста грибов использовали среды: сусло-агар (4% сусло; 2% агар), мальтекс-агар (1,5% мальтекс; 2% агар) и глюкозо-пептонный агар (ГПА). Состав последней среды аналогичен составу жидкой питательной среды, которая в дальнейших экспериментах будет использована для глубинного культивирования грибов.
Ростовой коэффициент определяли на седьмые сутки культивирования штаммов. Он является комплексным показателем, который учитывает скорость роста в единицу времени и коэффициент плотности мицелия (Кр):
Кр = (Д / τ) ∙ Н ∙ П,
где Д – диаметр колонии, мм; Н – высота мицелия, мм; П – коэффициент плотности мицелия (1 – слаборазвитый, 2 – плотный, опушённый, 3 – кожистый, плотный); τ – количество суток.
Ферментативные свойства исследуемых штаммов оценивали по активности некоторых ферментов: протеолитических, лигнинолитического комплекса (ферментов лакказ).
Проверку протеиназной активности проводили на плотных питательных средах с молоком и желатином. Использовали метод аппликации мицелиальных дисков на среды с казеином и желатином. Измеряли зоны гидролиза субстратов.
Наличие компонентов лигнинолитического комплекса (ферментов лакказ) проверяли на среде с реагентом АБТС: основа – сусло-агар 4% с добавлением 0,28% АБТС – 2,2’-азино-бис(3-этилбензотиазолин-6-сульфокислоты). На плотные питательные среды помещали агаровые блоки с двухнедельной культурой. Учет результатов проводился через 24 часа [6].
Для получения биомассы мицелия проводили глубинное культивирование грибов в жидкой питательной среде. Культуру выращивали в колбах Эрленмейера вместимостью 750 мл (объем питательной среды 150 мл) на лабораторном шейкере (n = 220 об./мин.). Культивирование проводили 10 суток при температуре 23-24°С. В качестве базовой питательной среды использовали глюкозо-пептонную среду (ГПС) [7].
Растворимые (НФр) и нерастворимые (НФр) углеводные фракции экстрагировали из измельченного мицелия водой при 100°С в течение 4-5 часов. Моносахаридный состав мицелия и полученных из него фракций определяли после полного кислотного гидролиза. Количественный анализ моносахаридного состава проводили методом ГЖХ с последующим расчётом соотношения площадей полученных пиков [7]. Антиоксидантную активность определяли методом активированной хемолюминесценции [8].
Иммунобиологическое действие выделенных углеводных фракций определяли по изменению микробоцидности макрофагов белых мышей по отношению к клеткам Staphylococcus aureus через 24 часа после введения препарата в количестве 100 мг/кг веса животного. Сравнивали выживаемость клеток после 1 минуты контакта со стимулированными полисахаридами макрофагами и макрофагами контрольной группы. Определяли константу киллинга, которая характеризует количество клеток тест-микроорганизма, погибших в единицу времени (минуту) под действием микробоцидных факторов, нарушающих жизнедеятельность микроорганизма [7].
Статистическая обработка результатов осуществлялась с помощью программы MS Excel. Результаты обрабатывали методом вариационной статистики с вычислением среднего арифметического для каждой группы опытов и стандартного отклонения от среднего арифметического.
Результаты исследования и их обсуждение
Наиболее высокую скорость роста наблюдали у штаммов Lentinus substrictus и Flammulina velutipes. Максимальный ростовой коэффициент (34,3 мм/сут.) отмечали у штамма L. substrictus LE-BIN 1601 при его росте на среде сусло-агар.
Базидиомицеты являются источниками различных ферментов, имеющих практическую ценность [9]. Для оценки ферментативного потенциала исследуемых грибов определяли их лакказную и протеолитическую активности. За 100% принимали максимальное значение показателей у наиболее активного штамма. При сравнении показателей лакказной активности исследуемых штаммов установлено, что максимальная активность (100%) обнаружена у штамма F. velutipes LE-BIN 1483. Оба исследованных штамма Lentinus обладали достаточно высокой активностью (92%). У штамма G. frondosa LE-BIN 2639 лакказная активность не была обнаружена.
Была выявлена высокая протеолитическая активность исследуемых штаммов, которая составляла от 62,3% до 86,7% от наиболее активного штамма. Наиболее активными были штаммы L. substrictus LE-BIN 0626, L. substrictus LE-BIN 1601 и F. velutipes LE-BIN 1483.
На основе проведенных экспериментов, с учетом скорости роста и ферментативной активности грибов, для изучения процессов глубинного культивирования было выбрано 4 штамма: L. substrictus LE-BIN 0626 и LE-BIN 1601, F. velutipes LE-BIN 1483 и G. valesiacum LE-BIN 2256.
Основными преимуществами глубинного культивирования являются регулируемый синтез нужных метаболитов, сокращение времени процесса в 3–5 раз и получение стандартного продукта. Наиболее продуктивными по выходу биомассы мицелия оказались базидиомицеты рода Lentinus – выход биомассы мицелия составил 7,0 и 4,8 г/л.
Уже с первых суток культивирования отобранные штаммы начинали активно потреблять источники углерода и азота, при этом наблюдали значительный прирост биомассы мицелия. Наиболее продуктивным являлся штамм L. substrictus LE-BIN 0626, в то время как утилизация глюкозы проходила интенсивнее штаммом L. substrictus LE-BIN 1601. У обоих штаммов к седьмым суткам в питательной среде глюкозы почти не оставалось (0,09 мг/мл). Базидиомицеты показали высокую скорость накопления биомассы, и к седьмым суткам культивирования наблюдали переход в стационарную фазу роста. Таким образом, в данных условиях возможно сокращение времени культивирования с 10 до 7 суток для этих штаммов грибов, что представлено на рис. 1.
Характер потребления азота существенно не отличался у разных штаммов и имел сходные закономерности. Аминный азот к десятым суткам роста утилизировался на 90% и 80% штаммами L. substrictus LE-BIN 0626 и LE-BIN 1601 соответственно.
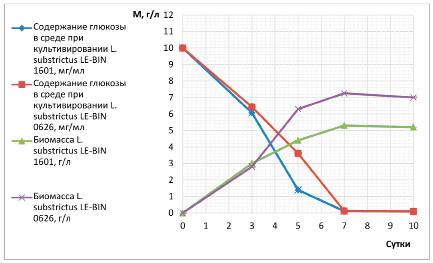
Рис. 1. Динамика утилизации источников углерода и накопление биомассы в процессе культивирования L. substrictus LE-BIN 0626 и L. substrictus LE-BIN 1601

Рис. 2. Динамика утилизации источника углерода и накопления биомассы при культивировании L. substrictus LE-BIN 0626 с дробным добавлением глюкозы
Возможно, имеет место лимитирующее действие источника углерода на рост культуры вследствие того, что базидиомицет активно утилизировал глюкозу, и её концентрация уже к седьмым суткам снижалась практически до нуля.
С целью повышения выхода биомассы грибов провели эксперименты с дробной подачей раствора глюкозы. Для этого использовали ГПС, которая содержала 7 г/л глюкозы, и в процессе культивирования на пятые сутки проводили дробную подачу 10% раствора глюкозы таким образом, чтобы общее количество глюкозы в среде соответствовало количеству глюкозы в стандартной ГПС (10 г/л).
Дробное добавление глюкозы приводило к значительному увеличению количества биомассы. Увеличение выхода мицелия составило 51% и 42% у штаммов LE-BIN 0626 и LE-BIN 1601 соответственно, и уже на седьмые сутки был отмечен прирост биомассы на 20% и 50% в сравнении с выходом биомассы в стандартных условиях (рис. 2).
Из полученной биомассы мицелия грибов методом водной экстракции мицелия были выделены нерастворимая (НФр) и растворимая фракции (РФр).
В выделенных фракциях определяли содержание полисахаридов (по количеству редуцирующих веществ в гидролизатах), белка, минеральных примесей. Также определяли количественно углеводный состав полисахаридов – основного компонента фракций мицелия (таблица).
Показано, что мицелий и полученные из него фракции состояли преимущественно из полисахаридов. Содержание полисахаридов в мицелии составляло от 70% до 73%, белка до 17% и минеральных примесей – 6,4%. Фракции содержали от 61,5% до 85,4% полисахаридов, количество минеральных примесей было незначительным – менее 1%.
Был определен количественный моносахаридный состав выделенных фракций. Фракции, выделенные из мицелия исследованных грибов рода Lentinus, содержали глюкозу (60-81%), а также значительное количество маннозы (11,6% и 19% для штаммов LE-BIN 0626 и LE-BIN 1601 соответственно) и галактозы (5-10%), следовые количества ксилозы и фукозы (таблица).
Выделенные фракции мицелия использовали для определения их иммуностимулирующей активности в экспериментах in vivo.
Изучение иммунобиологической активности углеводных фракций показало, что константы киллинга после контакта с макрофагами, стимулированными НРф и РФр, составляли соответственно 6,0-6,2 и 6,7-6,9. Таким образом, полученные полисахаридные фракции достоверно увеличивали микробоцидный эффект макрофагов в среднем в 1,5 раза по сравнению с контролем.
Характеристики химического состава углеводных фракций мицелия исследованных штаммов Lentinus substrictus
|
Образец |
Компонентный состав мицелия, % |
Углеводный состав полисахаридов, % |
||||||
|
Полисахариды |
Белок |
Минеральные примеси |
Глюкоза |
Манноза |
Галактоза |
Ксилоза |
Фукоза |
|
|
РФр LE-BIN 0626 |
82,7±5,5 |
1,1±0,1 |
0,17±0,02 |
76,3 |
11,6 |
8,3 |
2,3 |
1,5 |
|
НФр LE-BIN 0626 |
61,5±3,1 |
4,2±0,8 |
1,0±0,1 |
81,4 |
11,5 |
5,6 |
1,1 |
0,4 |
|
РФр LE-BIN 1601 |
85,4±7,6 |
1,7±0,4 |
0,5±0,1 |
68,1 |
18,7 |
10,1 |
2,5 |
0,7 |
|
НФр LE-BIN 1601 |
67,6±4,5 |
8,8±1,2 |
0,4±0,1 |
70,7 |
17,7 |
8,4 |
2,3 |
0,84 |
Для определения антиоксидантных свойств были получены водные извлечения мицелия штаммов L. substrictus. Их добавляли к специальной аналитической системе АБАП/люминол и определяли активность антиоксиданта по интенсивности хемилюминесценции во времени [8]. Показано, что исследуемое водное извлечение мицелия обладало антиоксидантным действием со средним уровнем активности, сопоставимым с известным антиоксидантом – аскорбиновой кислотой.
Заключение
В результате экспериментов из шести культур базидиомицетов были отобраны два штамма из рода Lentinus, которые обладали наибольшей скоростью роста, накопления биомассы мицелия и ферментативной активностью. Данные штаммы в процессе глубинного культивирования активно накапливали биомассу с высоким выходом и полной утилизацией источника углерода (глюкозы). При этом время культивирования было сокращено с 10 до 7 суток. При дробном добавлении глюкозы на пятые сутки культивирования значительно повышался выход мицелия, от 42% до 51%. Из мицелия базидиомицетов были выделены фракции, состоящие преимущественно из полисахаридов (61-85%) с незначительным количеством белка (до 8,8%).
Показано, что полисахаридные фракции мицелия L. substrictus оказывали иммуностимулирующее действие, которое выражалось в усилении микробоцидного эффекта перитонеальных макрофагов мышей в эксперименте. Обнаружены антиоксидантные свойства водных извлечений мицелия L. substrictus.
Библиографическая ссылка
Ананьева Е.П., Гурина С.В., Псурцева Н.В. УСЛОВИЯ КУЛЬТИВИРОВАНИЯ ШТАММОВ БАЗИДИАЛЬНЫХ ГРИБОВ РОДА LENTINUS, ХАРАКТЕРИСТИКА СОСТАВА И БИОЛОГИЧЕСКОЙ АКТИВНОСТИ // Международный журнал прикладных и фундаментальных исследований. 2024. № 11. С. 7-11;URL: https://applied-research.ru/ru/article/view?id=13664 (дата обращения: 30.01.2026).
DOI: https://doi.org/10.17513/mjpfi.13664

