Введение
Последние достижения в области фармацевтической науки и практики привели к развитию новой области – нанофармацевтики, что делает актуальными проблемы качества, контроля эффективности и безопасности нанопрепаратов. Цито- и генотоксичность имеют особое значение для неорганических наночастиц, характеризующихся плохой биоразлагаемостью.
Наночастицы диоксида церия являются весьма перспективными нанофармпрепаратами благодаря своему уникальному взаимодействию с активными формами кислорода (АФК) [1]. Наноразмерный CeO2 проявляет выраженные ферментоподобные (нанозимные) свойства, являясь миметиком супероксиддисмутазы (СОД), а также пероксидазы, каталазы, фосфатазы. Несмотря на многочисленные исследования, активность наноразмерного диоксида церия по отношению к генам изучена в основном на модели животных. По отношению к клеткам человека токсичность изучена, главным образом, на модели раковых клеток [2]. Исследования на культурах неопухолевых клеток относительно малочисленны (например, это работы по исследованию кератиноцитов кожи [3], пигментного эпителия сетчатки [4]). В целом, систематических исследований влияния диоксида церия на гены нормальных клеток человека, участвующих в окислительном метаболизме и регуляции ключевых АФК-зависимых сигнальных путей, не проводилось.
Цель исследования – изучить влияние стабилизированного цитратом наноразмерного диоксида церия на гены окислительного метаболизма в эмбриональных фибробластах легких человека в отношении: (1) жизнеспособности клеток, (2) экспрессии NOX4 и NRF2, (3) окислительного повреждения / репарации ДНК.
Материалы и методы исследования
Синтез и физико-химическая характеристика наночастиц СеО2. Нестабилизированный коллоидный раствор СеО2 получали термогидролизом гексанитратоцерата(IV) аммония (#215473, Sigma) [5]. Концентрацию золя СеО2 определяли термогравиметрическим методом. Раствор модификатора готовили путем растворения цитрата аммония (#247561, Sigma) в деионизированной воде. Модификацию наночастиц CeO2 проводили путем постепенного добавления по каплям при непрерывном перемешивании не менее 30 мин водного раствора диоксида церия к раствору лиганда. Рентгенограммы образцов нанодисперсного СеО2 были получены с помощью дифрактометра Bruker D8 Advance (CuKα-излучение, геометрия θ–2θ). Идентификацию дифракционных максимумов осуществляли с использованием банка данных ICDD PDF2. Электронные изображения получали с помощью просвечивающего электронного микроскопа Leo 912 AB Omega (Carl Zeiss, Германия). Гидродинамический диаметр наночастиц измеряли с помощью анализатора Photocor Complex (Photocor, Россия). Для измерения дзета-потенциалов использовали Nano ZS Zetasizer (Malvern Panalytical, UK) в соответствии с ISO/TR 19997:2018.
Культивирование клеток. Эмбриональные фибробласты легких человека (4-й пассаж) рассеивали в концентрации 1,7×104 кл/мл в культуральной среде DMEM («Панэко», Россия), содержащей 1-% фетальную телячью сыворотку (PAA, Австрия), 50 ЕД/мл пенициллина, 50 мкг/мл стрептомицина и 10 мкг/мл гентамицина. Клетки культивировали при 37°C в течение 24 ч, далее добавляли наночастицы и инкубировали в течение 1, 3, 24 и 72 ч.
МТТ-тест. Для оценки выживаемости клеток проводили MTT-тест (3-(4,5- диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид). Флуоресценцию при 550 нм измеряли на планшетном ридере EnSpire (EnSpire Equipment, Финляндия). В качестве отрицательного контроля использовали клетки, инкубированные с культуральной средой и раствором цитрата в деионизированной воде. С наночастицами CeO2 клетки инкубировали в течение 72 ч.
Проточная цитометрия. Клетки промывали раствором Версена (Thermo Fisher Scientific, США), обрабатывали 0,25%-ным трипсином («Панэко», Россия), промывали средой, суспендировали в фосфатном буферном растворе (PBS, pH 7,4) («Панэко», Россия), фиксировали параформальдегидом (Sigma-Aldrich, США) при 37°C в течение 10 мин, трижды промывали 0,5%-ным BSA-PBS, обрабатывали 0,1%-ным Triton X-100 в PBS в течение 15 мин при 20°C. Далее окрашивали конъюгированными антителами (1 мкг/мл) в течение 2 ч при комнатной температуре, промывали PBS и анализировали с помощью проточного цитометра (CytoFlex S, Beckman Coulter, США).
Результаты исследования и их применение
МТТ-тест. Результаты МТТ-теста свидетельствуют о том, что стабилизированный цитратом CeO2 безопасен для клеток в широком диапазоне концентраций (рис. 1). Для дальнейших экспериментов выбраны концентрации 5 нМ и 1,5 мкМ.
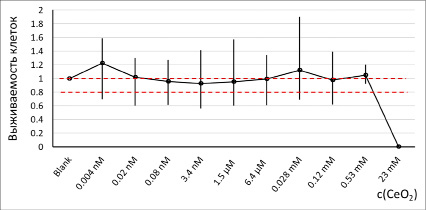
Рис. 1. Результаты 72-часового МТТ-теста. Пунктирными линиями отмечены линия контроля (выживаемость 1) и граница биологического эффекта (выживаемость клеток 0,8)
(а) 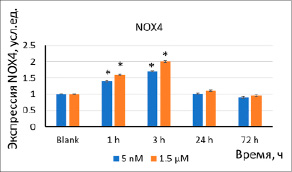
(б) 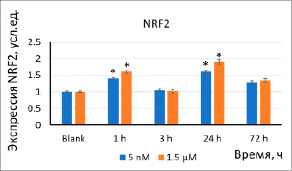
Рис. 2. Экспрессия белков (a) NOX4 (б) и NRF2 в результате инкубации клеток с наночастицами стабилизированного цитратом CeO2 (5 нМ, 1,5 мкМ) в течение 1–72 ч. Значимые различия по критерию Манна–Уитни (p<0,05) отмечены знаком *
(а) 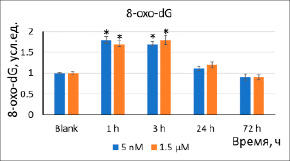
(б) 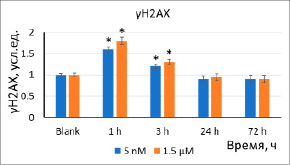
Рис. 3. Уровни (а) 8-oxo-dG и (б) γH2AX в результате инкубации клеток с наночастицами стабилизированного цитратом CeO2 (5 нМ, 1,5 мкМ) в течение 1–72 ч. Значимые различия по критерию Манна–Уитни (p<0,05) отмечены знаком *
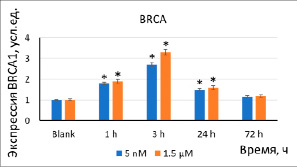
Рис. 4. Экспрессия белка BRCA в результате инкубации клеток с наночастицами стабилизированного цитратом CeO2 (5 нМ, 1,5 мкМ) в течение 1–72 ч. Значимые различия по критерию Манна–Уитни (p<0,05) отмечены знаком *
Экспрессия NOX4 и NRF2. Ключевыми источниками АФК в клетке являются НАДФН-оксидазы. Спустя 1–3 ч после добавления наночастиц к клеткам экспрессия белка NOX4 увеличилась в 1,4–2,0 раза (рис. 2а). Фактор транскрипции NRF2 участвует в антиоксидантном ответе. Экспрессия транскрипционного фактора NRF2 увеличилась в 1,5–2 раза через 24 ч (рис. 2б). Кратковременная активность фактора NRF2, скорее всего, связана с высвобождением его из белковых комплексов с KEAP1 и фосфорилированием NRF2, депонированного в клетках. Повышение активности через 24 ч инкубации является результатом ответа на повышение экспрессии NOX4.
Окислительное повреждение и репарация ДНК. Спустя 1–3 ч инкубации клеток с наночастицами (5 нМ, 1,5 мкМ) уровень 8-оксо-2’-дезоксигуанозина (8-oxo-dG), являющегося маркером окислительного повреждения ДНК, увеличился в 1,8–2,7 раза (рис. 3а). Увеличение 8-oxo-dG может служить причиной разрывов ДНК. Уровень двухцепочечных разрывов ДНК был оценен по концентрации фосфорилированного гистона γH2AX. Спустя 1 ч инкубации с наночастицами уровень γH2AX увеличился в 1,5–1,8 раза, что коррелирует с изменениями 8-oxo-dG (рис. 3б).
Уменьшение разрывов ДНК может быть обусловлено активацией генов, участвующих в репарации ДНК. Ключевым геном репарации является ген BRCA1. В результате действия наночастиц (5 нМ, 1,5 мкМ) на клетки через 1–3 ч экспрессия белка BRCA1 увеличилась в 1,5–3,5 раза (рис. 4). Увеличение экспрессии белка BRCA1 в течение 24 ч объясняет уменьшение двухцепочечных разрывов через 24–72 ч после добавления CeO2.
Основные результаты исследования можно суммировать следующим образом: 1) стабилизированный цитратом наноразмерный диоксид церия не проявляет токсичности по отношению к эмбриональным фибробластам легких человека в широком диапазоне концентраций до 0,53 мМ; 2) он быстро проникает в клетки в течение 1–3 ч, при этом увеличивается экспрессия NOX4 и NRF2; 3) увеличение экспрессии NOX4 приводит к окислительному повреждению ДНК и двухцепочечным разрывам, что, в свою очередь, активирует системы репарации; 4) как в низкой (5 нМ), так и в 300 раз более высокой концентрации (1,5 мкМ) наночастицы действуют примерно с одинаковой эффективностью. Эффекты диоксида церия развиваются довольно быстро – в течение 24 ч – и исчезают через 72 ч, что, предположительно, связано с удалением CeO2 из клеток.
Цитрат-анион – широко используемый стабилизатор наночастиц. Несмотря на то что цитрат аммония – нейтральное вещество, но в качестве стабилизатора он может влиять на токсичность. Например, цитрат-стабилизированные наночастицы серебра оказались более токсичными для кератиноцитов человека, чем стабилизированные полиэтиленгликолем [6]. Однако на клетках гепатомы наночастицы серебра, стабилизированные цитратом и полиэтиленгликолем, проявили схожую токсичность [7]. Кроме того, на токсичность влияет и способ приготовления суспензии. Цитратное покрытие не мешало связыванию олигонуклеотидов с золотыми наночастицами, однако большое количество цитрата на поверхности золотых частиц увеличивало их токсичность, хотя и не влияло на проникновение в эндотелиальные или эпителиальные клетки [8]. Авторами не найдено работ, посвященных оценке токсичности цитрат-стабилизированного диоксида церия по отношению к клеткам человека. На фибробластах мышей цитрат как стабилизатор диоксида церия проявлял токсичность по сравнению с полиакриловой кислотой [9]. Согласно полученным данным, цитрат как стабилизатор диоксида церия является безопасным, а цитрат-стабилизированные наночастицы проявляют в целом цитопротекторные свойства. Поскольку эффекты наночастиц развиваются достаточно быстро (в течение 1 ч), можно предположить, что цитрат не препятствует проникновению в фибробласты.
Наночастицы диоксида церия вызывают активацию экспрессии NOX4 [10]. Фермент NOX4 катализирует продукцию супероксидного анион-радикала и пероксида водорода, что ставит его в один ряд с важнейшими окислительно-восстановительными регуляторами. Повышение активности NOX4 приводит к активации противовоспалительного ответа NRF2, тем самым клетка защищается от повреждения. Негативный эффект NOX4 заключается в окислительном повреждении ДНК и возникновении двухцепочечных разрывов. В свою очередь, в ответ на повреждение ДНК происходит активация систем репарации.
Относительно токсичности и безопасности наноразмерного диоксида церия в литературе имеются противоречивые данные. Исследования на культурах альвеолярных эпителиальных клеток II типа у крыс свидетельствуют о провоспалительном и оксидативном действии диоксида церия [11]. В отношении клеток рака легких CeO2 вызывал выраженный окислительный стресс, перекисное окисление липидов и повреждение мембран. Ченг с соавт. показали, что наночастицы CeO2 вызывают повреждение и апоптоз в клетках гепатомы человека посредством окислительного стресса и активации сигнальных путей MAPK [12]. Токсическое действие CeO2 на клетки аденокарциномы легких было продемонстрировано Митталом с соавт. [13]. Напротив, в исследовании клеток рака яичников и толстой кишки человека CeO2 продемонстрировал антиоксидантные и противовоспалительные свойства [14]. Одновременное введение CeO2 и ацетата свинца снижало генотоксичность, воспаление и образование АФК, восстанавливая целостность геномной ДНК [15].
Заключение
Активный участник биохимических реакций с участием АФК, диоксид церия проявляет свою окислительно-восстановительную активность в клетках, регулируя АФК-зависимые пути и активируя экспрессию NOX4. В течение 24 ч разворачивается каскад событий, включающий окислительную модификацию ДНК и двухцепочечные разрывы и одновременно активацию защитных систем: антиоксидантного пути NRF2 и систем репарации ДНК. Таким образом, стабилизированный цитратом диоксид церия можно рассматривать как вещество с кратковременным противовоспалительным действием.
Библиографическая ссылка
Проскурнина Е.В., Созарукова М.М., Ершова Е.С., Савинова Е.А., Каменева Л.В., Вейко Н.Н., Костюк С.В. ВЛИЯНИЕ СТАБИЛИЗИРОВАННОГО ЦИТРАТОМ НАНОРАЗМЕРНОГО ДИОКСИДА ЦЕРИЯ НА ЭКСПРЕССИЮ ГЕНОВ ОКИСЛИТЕЛЬНОГО МЕТАБОЛИЗМА В ЭМБРИОНАЛЬНЫХ ФИБРОБЛАСТАХ ЛЕГКИХ ЧЕЛОВЕКА // Международный журнал прикладных и фундаментальных исследований. 2024. № 11. С. 12-17;URL: https://applied-research.ru/ru/article/view?id=13665 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/mjpfi.13665

