Введение
На современном этапе научно-технического прогресса с помощью высокотехнологичных методов, включая использование технологии искусственного интеллекта, появились возможности масштабированного создания уникальных субстанций и синтетических молекул узконаправленного действия за достаточно краткосрочный период, не доступные разработчикам ранее. Однако клиническое применение новых фармакологических средств и материалов медицинского назначения по-прежнему требует научно обоснованных экспертиз и доказательств их безопасности и эффективности. В соответствии с действующими нормативно-правовыми актами для формирования доказанной в достаточной степени безопасности и эффективности необходимо многоэтапное научное исследование. При соблюдении установленного порядка на первоначальном этапе выполняется доклиническая оценка общей (острой и хронической) токсичности в условиях in vitro и in vivo на лабораторных животных.
Установление фактов наличия интоксикации и определение степени её выраженности при взаимодействии тестируемого вещества или изделия с живым организмом является важнейшей задачей доклинических токсикологических испытаний. Согласно Федеральному закону № 61 от 12 апреля 2010 года «Об обращении лекарственных средств» в ходе доклинических испытаний должна быть достигнута цель в получении достаточной доказательной базы о безопасности и эффективности применения новых средств и субстанций, с обязательной оценкой возможности и риска проведения на последующих этапах клинической апробации [1]. Доклинические исследования проводятся в строгом соответствии с Приказом Министерства здравоохранения Российской Федерации от 01 апреля 2016 года № 199н «Об утверждении Правил надлежащей лабораторной практики» [2].
В рамках выполнения прикладной научно-исследовательской работы «Разработка персонализированных технологий применения лечебных физических факторов и геропротекторов природного происхождения в коррекции биомаркеров старения» по государственному заданию № 84.002.24.800 авторами была разработана биологически активная добавка к пище на основе электроимпульсного экстракта из сырья растительного происхождения. Состав и технологическая схема извлечения данного экстракта (ноу-хау) подобраны таким образом, чтобы полученная композиция обладала выраженной адаптогенной активностью при внутреннем применении у лиц с факторами риска преждевременного старения организма и возраст-ассоциированных заболеваний.
В связи с вышеизложенным целью данного исследования явилась оценка острой токсичности нового электроимпульсного экстракта биологически активных веществ растительного происхождения, предназначенного для применения в клинической практике, при внутреннем введении лабораторным крысам.
Материалы и методы исследования
Исследование проводили на 60 половозрелых крысах линии Wistar обоего пола массой 240–300 г, полученных из сертифицированного питомника, которые после периода карантина (14 суток) содержались в стандартных условиях вивария Филиала ТНИИКиФ ФГБУ «ФНКЦ МРиК ФМБА» России при естественном световом режиме и на стандартном рационе со свободным доступом к воде и пище. Все процедуры с животными выполняли в соответствии с правилами и рекомендациями гуманного обращения с животными, используемыми для экспериментальных и иных научных целей (Приказ Минздрава России от 18 мая 2021 г. № 464н «Об утверждении Правил проведения лабораторных исследований») [3]. Исследование проводили согласно «Руководству по проведению доклинических исследований лекарственных средств» под редакцией А.Н. Миронова [4, с. 20–25]. Содержание животных и дизайн экспериментов одобрены Локальным этическим комитетом ФГБУ «ФНКЦ МРиК ФМБА» России после проведения независимой экспертизы на соответствие этическим нормам и принципам биомедицинских исследований (протокол № 3 от 28 марта 2024 г.).
Животных рандомизировали на контрольную и три опытные группы по 6 особей каждого пола. 48 животным опытных групп тестируемый экстракт вводился однократно внутрижелудочно через зонд в разных дозах. В соответствии с «Руководством по проведению доклинических исследований лекарственных средств» [4, с. 21] «…полученные результаты должны адекватно обеспечить возможность вычисления LD50 (доза, вызывающая гибель 50% особей), что предполагает наличие среди изучаемых групп одной группы со 100% летальностью и одной, в которой гибель животных отсутствует. Если из-за низкой токсичности фармакологического вещества нельзя определить LD50, следует указать максимальную дозу, которая была введена животным, но не менее 2 г/кг». Действуя согласно данному руководству, сначала животным ввели тестируемый экстракт в количестве 50 мг/кг и наблюдали за ними в течение трех суток. У этой группы крыс летальный исход и внешние признаки интоксикации отсутствовали. Далее для остальных групп последовательно применяли следующие дозы: 250, 500 и 2000 мг/кг. Контрольную группу составили 12 крыс, получавших перорально эквивалентный объем воды очищенной.
Общая продолжительность наблюдения за животными составила 14 суток. Ежедневно в ходе всего периода эксперимента фиксировали общее состояние животных, особенности их поведения, наличие и характер судорог, координации движений, тонус скелетных мышц, состояние шерстного и кожного покровов, окраску слизистых оболочек, количество и консистенцию фекальных масс, потребление корма и воды, изменение массы тела и температуры тела, с обязательной регистрацией сроков развития интоксикации и гибели животных. Через 14 суток наблюдения у крыс оценивали поведенческую активность в тесте «открытое поле» по методу C.S. Hall [5]. Далее животных выводили из эксперимента одномоментным декапитированием под СО2-наркозом, осуществляли забор крови для исследования, некропсию внутренних органов. В сыворотке крови проводили аналитические измерения концентраций общего белка, креатинина, глюкозы и общего холестерина с применением стандартных колориметрических методов согласно инструкциям производителя диагностических наборов (ООО «Ольвекс Диагностикум», РФ) с помощью полуавтоматического фотометра «Biochem SA» (High Тechnology, США).
При обработке полученных данных были использованы автоматизированные методы статистического описания, включающие проверку на нормальность распределения исследуемого признака по критерию Шапиро – Вилка, расчет медианы (М), верхнего и нижнего квартилей (Q1; Q3), а также методы проверки статистических гипотез при межгрупповом сравнении показателей с помощью непараметрического критерия Манна – Уитни. Различия считались статистически значимыми при уровне р<0,05.
Результаты исследования и их обсуждение
В ходе выполнения экспериментального исследования введение тестируемого вещества не привело к нарушению здоровья и гибели животных. Электроимпульсный экстракт биологически активных веществ растительного происхождения при внутрижелудочном однократном введении крысам в дозах 50, 250, 500 и 2000 мг/кг не вызывал смертность. Таким образом, установлена LD50 тестируемого экстракта более 2000 мг/кг, что согласно классификации [6] относится к умеренно опасным веществам (LD50 в диапазоне 151–5000 мг/кг).
Измерение температуры тела в динамике показало отсутствие пирогенной реакции у всех животных опытных групп на 1-е и 14-е сутки после однократного введения экстракта. Определение массы тела экспериментальных животных показало прибавку данного показателя в течение 14 суток эксперимента у крыс всех исследуемых групп (рисунок).
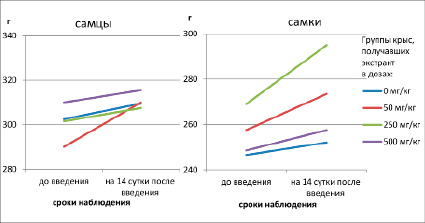
Динамика массы тела у крыс на 14-е сутки после однократного введения электроимпульсного экстракта биологически активных веществ растительного происхождения в разных дозах
Биохимические показатели сыворотки крови у крыс на 14-е сутки после введения электроимпульсного экстракта биологически активных веществ растительного происхождения, Me (Q1; Q3)
|
Исследуемые показатели |
Контрольные крысы, получавшие очищенную воду |
Опытные крысы, получавшие тестируемый экстракт в разной дозе: |
|||
|
50 мг/кг |
250 мг/кг |
500 мг/кг |
|||
|
Общий белок, г/л |
самцы |
71,0 (67,8; 94,5) |
84,0 (80,8; 93,9) р≥0,05 |
73,2 (60,2; 83,1) р≥0,05 |
76,4 (63,8; 86,9) р≥0,05 |
|
самки |
71,5 (59,8; 85,0) |
79,9 (76,6; 82,5) р≥0,05 |
77,3 (74,1; 79,8) р≥0,05 |
80,5 (47,8; 95,9) р≥0,05 |
|
|
Креатинин, мкмоль/л |
самцы |
42,0 (39,8; 54,8) |
50,1 (43,1; 61,9) р≥0,05 |
49,8 (42,2; 57,3) р≥0,05 |
44,3 (40,9; 56,9) р≥0,05 |
|
самки |
48,0 (44,5; 60,0) |
48,2 (45,2; 62,5) р≥0,05 |
55,3 (51,8; 70,6) р≥0,05 |
49,5 (40,7; 61,7) р≥0,05 |
|
|
Глюкоза, ммоль/л |
самцы |
5,3 (5,0; 5,9) |
5,6 (5,3; 5,6) р≥0,05 |
4,3 (4,0; 4,7) р=0,011 |
5,3 (4,6; 6,0) р≥0,05 |
|
самки |
5,2 (4,7; 5,5) |
4,9 (4,8; 5,0) р≥0,05 |
4,4 (3,9; 5,1) р=0,009 |
4,7 (4,0; 6,7) р≥0,05 |
|
|
Общий холестерин, ммоль/л |
самцы |
1,8 (1,7; 2,2) |
2,5 (2,3; 2,7) р≥0,05 |
2,7 (2,5; 3,0) р=0,036 |
2,4 (1,6; 2,9) р≥0,05 |
|
самки |
1,9 (1,8; 2,0) |
2,3 (2,2; 2,5) р≥0,05 |
3,0 (2,8; 3,3) р=0,019 |
2,7 (2,5; 3,1) р≥0,05 |
|
Примечание: р – уровень статистической значимости по сравнению с контрольной группой.
Сравнительный анализ показателей поведенческих реакций в тесте «открытое поле» на 14-е сутки после перорального применения экстракта выявил только учащение регистрации горизонтальной активности у самцов крыс, получавших 500 мг/кг тестируемого экстракта, на 60% (41,5 (34,3; 45,8) усл. ед., p=0,038) по сравнению со значением данного параметра у самцов контрольной группы (26,0 (13,5; 29,3) усл. ед.). Изменений других показателей, которые характеризуют ориентировочно-исследовательскую активность, зафиксировано не было. Тестирование самок крыс опытных групп в установке «открытое поле» на 14-е сутки после приема оцениваемого средства растительного происхождения не выявило изменений их поведенческих реакций относительно самок контрольной группы. Двигательная активность животных при помещении их в новые условия установки «открытое поле» свидетельствует об отсутствии у них стрессового состояния [7].
Результаты биохимического анализа показали, что у всех экспериментальных животных мужского и женского полов на 14-е сутки после внутреннего однократного приема разработанного нового экстракта в сыворотке крови показатели, характеризующие состояние белкового обмена веществ (концентрации общего белка и креатинина), сопоставимы с уровнем аналогичных параметров у крыс, принимавших очищенную воду (таблица).
Проведенный биохимический анализ выявил меньшие значения скринингового показателя, характеризующего состояние углеводного обмена – содержание глюкозы в сыворотке крови – у крыс, получавших 250 мг/кг экстракта, вне зависимости от половой принадлежности (табл.). Со стороны липидного обмена отмечено небольшое повышение содержания общего холестерина также у животных данной опытной группы обоего пола (табл.). Считаем это несущественным изменением, т.к. в данном случае установленные уровни показателей не выходят за границы интервала референсных значений [8]. В целом, полученные результаты свидетельствуют об отсутствии грубых метаболических нарушений, сопровождающих токсическое поражение.
При макроскопическом изучении состояния внутренних органов после вскрытия патологических изменений у всех самцов опытных групп не обнаружено. Для половины крыс из группы с дозой тестируемого экстракта в 500 мг/кг отмечен визуально бо́льший объём висцерального жира по сравнению с контрольной группой. При некропсии у самок крыс всех групп патологических изменений также не выявлено. Объём висцерального жира у всех животных женского пола был одинаков.
При обследовании желудка установлено, что у всех крыс обоего пола размеры его не изменены, границы ровные, серозная оболочка тонкая, блестящая, гладкая, нормально окрашена. Стенка желудка не изменена. Слизистая оболочка данного органа во всех случаях имела складчатую поверхность, соответствующую нормальному рельефу внутренней поверхности желудка, без эрозий и язв.
Заключение
В ходе проведения доклинических испытаний нового электроимпульсного экстракта биологически активных веществ растительного происхождения, разработанного для внутреннего применения, у 48 половозрелых крыс Wistar обоего пола при внутрижелудочном введении объекта исследования в течение 14 суток наблюдения признаки общей интоксикации организма (летальный исход, нарушения дыхания, сердцебиения, пищеварения, параличи, судороги, тремор, недостаточность сердца, печени, почек, отек мозга, гипоксия и дистрофия тканей внутренних органов) отсутствовали, что свидетельствует о нетоксичности тестируемого экстракта.
На основе сравнительной оценки результатов клинического наблюдения, измерения температуры тела, массы тела, определения показателей теста «открытое поле», электрокардиографии, гематологического и биохимического анализов крови, а также макроскопического осмотра состояния внутренних органов было установлено, что новый электроимпульсный экстракт биологически активных веществ растительного происхождения при внутреннем применении не оказывает острого токсического действия на самок и самцов лабораторных крыс. LD50 нового экстракта определен более 2000 мг/кг, что соответствует умеренно опасным веществам.
Библиографическая ссылка
Жукова О.Б., Зайцев К.В., Гостюхина А.А., Дорошенко О.С., Кожемякина А.Д., Степанова А.М., Гамеева Е.В. ИССЛЕДОВАНИЕ ОСТРОЙ ТОКСИЧНОСТИ НОВОГО ЭЛЕКТРОИМПУЛЬСНОГО ЭКСТРАКТА БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ // Международный журнал прикладных и фундаментальных исследований. 2024. № 11. С. 18-22;URL: https://applied-research.ru/ru/article/view?id=13666 (дата обращения: 30.01.2026).
DOI: https://doi.org/10.17513/mjpfi.13666

