Введение
Активное внедрение в клиническую практику новых методов хирургического лечения в травматологии и ортопедии на костно-мышечной системе в настоящее время предусматривает вмешательства, сопровождающиеся широким использованием имплантатов. К сожалению, мировая практика ежегодно регистрирует наличие 3–4 % инфекционных осложнений в области установленного импланта – перипротезную инфекцию (ППИ) при первичном эндопротезировании, после ревизионного эндопротезирования достигает 40 % [1]. Из года в год увеличиваются абсолютные значения количества хирургических вмешательств, связанных с установкой имплантов, это приводит к возрастанию количества лиц, страдающих от данной патологии. Формирование длительного хронического очага может вызвать системные поражения внутренних органов, что может привезти к сепсису и, соответственно, к летальному исходу. Особую актуальность эта проблема приобретает при эндопротезировании крупных суставов, поскольку такие пациенты часто являются трудоспособными и инвалидизация в результате развития инфекции в области протеза влечет значительные социальные и экономические последствия [2].
Одна из актуальных проблем ППИ – это ее лечение, что связано с постоянным нарастанием резистентности выделенных штаммов. Структура микроорганизмов при перипротезной инфекции разнообразна, по мнению многих авторов, лидирующими являются стафилококки коагулазопозитивные и коагулазонегативные, которые в своей структуре имеют тенденцию к увеличению резистентных штаммов, но все-таки остаются некоторые виды антибиотиков, которые можно применить в лечении. Хуже ситуация обстоит с грамотрицательными бактериями: регистрируются штаммы с полирезистентностью, когда, получая результат микробиологического исследования, выясняется, что отсутствуют антибиотики, применимые для лечения. Рассмотрим наиболее агрессивный микроорганизм, часто угрожающий жизни пациента, представляющий собой в силу своих фенотипических особенностей одну из самых серьезных проблем в лечении инфекции травматологии и ортопедии, – Pseudomonas аeruginosa [3].
Синегнойная палочка – «мастер маскировки и выживания», она легко адаптируется к любым условиям, в том числе к действию антибиотиков, что делает ее одним из самых опасных возбудителей перипротезной инфекции в травматологии и ортопедии. Синегнойная палочка является одним из наиболее распространенных условно-патогенных микроорганизмов, колонизирующих кожные покровы и слизистые оболочки человека. Pseudomonas aeruginosa широко распространена в окружающей среде, при этом вода играет ключевую роль в ее циркуляции. Бактерия способна выживать в течение длительного времени в воде, даже в различных медицинских растворах. Синегнойная палочка – один из наиболее распространенных возбудителей внутрибольничных инфекций, ее доля в общей структуре таких инфекций достигает 20 %. Кроме того, она является причиной четверти всех гнойных хирургических ран и случаев бактериемии. Часто синегнойная палочка образует опасные ассоциации с золотистым стафилококком [4].
У бактерии Pseudomonas aeruginosa имеется способность неспецифически прикрепляться к имплантатам (катетерам, эндотрахеальным трубкам и т.д.), также она может использовать специфические молекулы плазмы крови в случаях проведения хирургических вмешательств. Нарушения мукоцилиарного клиренса, что может наблюдаться у пациентов в критических состояниях (например, после операций, при дыхательной недостаточности), способствуют усилению адгезии бактерий и развитию инфекции. В дальнейшем микроколонии бактерий постепенно объединяются, формируя многослойную структуру – биопленку. Биопленка покрыта общим гликокаликсом, который обеспечивает ее прочность и защищает бактерии от внешних воздействий. Большинство бактерий в биопленке находятся в стационарной фазе роста, что делает их значительно менее чувствительными к антимикробным препаратам [5].
Перипротезная инфекция возникает вследствие проникновения патогенных микроорганизмов, таких как синегнойная палочка, в область эндопротеза. В результате развивается гнойное воспаление. Эндопротезирование создает условия, способствующие развитию инфекции, и является одним из ключевых факторов риска у отдельной категории лиц.
Пациенты отделений реанимации, перенесшие эндопротезирование, представляют наибольшую сложность при выборе антибиотиков для лечения инфекций сустава до 90 % случаев. Причиной такой высокой резистентности является длительная антибиотикотерапия, снижающая иммунитет организма, а также ошибки в назначении и применении антибактериальных препаратов. Например, часто наблюдается нарушение сроков лечения.
Инфекционный процесс, как правило, развивается у лиц с ослабленным иммунитетом или поврежденными тканями. Основными факторами патогенности являются токсины, вырабатываемые микроорганизмами. Способность адгезироваться к эпителиальным клеткам с помощью ворсинок и слизи играет ключевую роль в инициации инфекции. Взаимодействие патоген – хозяин осуществляется через специфические рецепторы. Будучи типичным внеклеточным паразитом, возбудитель успешно противостоит защитным механизмам организма, обеспечивая свое размножение [6, 7].
К сожалению, нельзя точно сказать, какие антибиотики лучше всего подходят для лечения инфекций после операции по замене сустава. Причина в том, что бактерии постоянно меняются и становятся устойчивыми к лекарствам. Динамика изменения чувствительности микроорганизмов к антимикробным препаратам затрудняет разработку эффективных и безопасных схем терапии.
Целью исследования являлось изучение динамики Pseudomonas aeruginosa в микробном пейзаже штаммов, выделенных у пациентов перипротезной инфекцией, анализ резистентности для повышения эффективности антибактериальной терапии.
Материалы и методы исследования
Исследование было осуществлено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации, которая содержит этические принципы проведения медицинских исследований с участием человека. Декларация была принята на 59-й Генеральной Ассамблее ВМА в Сеуле в октябре 2008 г. В ходе исследования были отобраны пациенты, прошедшие не менее трех предыдущих курсов лечения, включающих как консервативные, так и хирургические методы. Все участники исследования были проинформированы о целях и методах, а также о возможных рисках и преимуществах нового подхода. Полученные согласия на участие в исследовании были задокументированы.
Каждому пациенту было проведено всестороннее обследование, охватывающее клинические, биохимические, рентгенологические и другие методы диагностики. Важным элементом диагностики стал предоперационный и интраоперационный микробиологический анализ с определением микрофлоры и ее чувствительности к антибиотикам.
Объектом исследования стали пункты из свищевого канала, а также отобранный биоматериал, полученный интраоперационно во время ревизионной операции, осуществляемой в связи с заменой сустава или его элементов. В ходе исследования рассматривались все пациенты, поступившие с подозрением или уже подтвержденным диагнозом перипротезной инфекции в РГП «Научно-исследовательский институт травматологии и ортопедии имени академика Батпенова Н.Д.» Министерства здравоохранения Республики Казахстан (г. Астана) за период с 2020 по 2023 г. и 10 месяцев 2024 г. Эти пациенты обращались за медицинской помощью из различных регионов Казахстана.
Биологический материал был подвергнут комплексному бактериологическому исследованию. После первичного посева на дифференциально-диагностические среды, окраски мазков по Граму далее фенотипирование выделенных культур осуществлялось на бактериологическом анализаторе ErbaScan [8, 9]. Антибиотикограмма была выполнена методом диффузии дисков в соответствии с действующими клиническими рекомендациями [10]. Статистическая обработка полученных данных позволила оценить значимость полученных результатов.
Результаты исследования и их обсуждение
В ходе исследования перипротезной инфекции у пациентов, получивших травматологическую и ортопедическую помощь, были получены следующие результаты. За период с 2020 по 2024 г. было исследовано биоматериала 2749, при этом отрицательных результатов было получено 823. Частота выявления инфекций демонстрировала тенденцию к увеличению по количеству исследований и из них отрицательные результаты в динамике пяти лет. В 2020 г. исследовано биоматериала 401, из них 128 негативных результата, что составляет 32 %, в 2021 г. 479 проб, негативных 128 результата – 39,2 %, в 2022 г. – 500 проб, негативных из них 173 – 34,6 %, в 2023 г. 653 пробы, негативных 223 – 34,2 %, за 10 месяцев 2024 г. 716 проб, негативных 112 – 15,6 %. Среднее количество отрицательных результатов за исследуемый период – 31,1 %. Далее представлена табл. 1 с динамикой общего количества обследованных лиц и количества полученных негативных результатов в абсолютных цифрах и процентах по годам, 2024 г. представлен статистическими данными за 10 месяцев.
Таблица 1
Динамика обследованного биоматериала на перипротезную инфекцию и полученные негативные результаты
|
№ п/п |
Года |
2020 |
2021 |
2022 |
2023 |
2024 |
Всего |
|
1 |
Общее количество исследованного биоматериала |
401 |
479 |
500 |
653 |
716 |
2749 |
|
2 |
Количество негативных результатов |
128 |
187 |
173 |
223 |
112 |
823 |
|
3 |
Негативные результаты в % |
32 |
39,2 |
34,6 |
34,2 |
15,6 |
31,1 |
Таблица 2
Основные патогены перипротезной инфекции за 2020–2024 гг.
|
Микроорганизмы |
2020 |
2021 |
2022 |
2023 |
2024 |
Всего |
||||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Staphylococcus aureus |
51 |
20 |
98 |
27,8 |
110 |
32 |
158 |
32,7 |
187 |
34,7 |
604 |
30,6 |
|
Staphylococcus spp. |
108 |
42 |
147 |
41,7 |
128 |
38 |
162 |
33,5 |
153 |
28,4 |
698 |
35,3 |
|
Acinetobacter spp. |
0 |
0 |
5 |
1,4 |
19 |
5,6 |
5 |
1,1 |
10 |
1,9 |
39 |
1,97 |
|
Рseudomonas aeruginosa |
43 |
17 |
32 |
8,9 |
39 |
11 |
63 |
13,1 |
84 |
15,6 |
261 |
13,2 |
|
Enterobacteriales |
33 |
13 |
49 |
14 |
27 |
7,9 |
78 |
16,1 |
65 |
12 |
252 |
12,7 |
|
Др. микроорганизмы |
22 |
8,7 |
25 |
7,1 |
18 |
5,3 |
16 |
3,5 |
40 |
7,4 |
121 |
6,18 |
|
Анаэробы |
1 |
0,2 |
0 |
0 |
1 |
0,05 |
||||||
|
Итого |
257 |
352 |
341 |
483 |
539 |
1976 |
||||||
Далее проанализируем микробный пейзаж (табл. 2). Доминирующие патогены чаще всего выявлялись в биоматериале пациентов с периимплантной инфекцией (Staphylococcus aureus, Staphylococcus spp., Pseudomonas aeruginosa, группа Enterobacteriales, Acinetobacter spp. Анализ научной литературы указывает на стафилококки как на ведущий этиологический агент периимплантных инфекций, в частности золотистый (12–23 %) и коагулазонегативные стафилококки (30–43 %). Грамотрицательная микрофлора (Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae, Escherichia coli, Enterobacter cloacae и др.) играет незначительную роль (5–23 %) в этиологии перипротезной инфекции [11]. До 20 % всех внутригоспитальных или нозокомиальных инфекций вызвано именно синегнойной палочкой, до 25 % гнойных хирургических процессов [12, 13].
Проанализируем динамику полученных авторами результатов при исследовании биоматериала на перипротезные инфекции за последние 5 лет. Стафилококки были наиболее распространенными возбудителями, особенно коагулазонегативные штаммы, которых идентифицировано было 35,3 %, золотистого стафилококка несколько меньше – 30,6 %. Стафилококки были преобладающими возбудителями, составляя 65,9 % от общего числа изолятов за 5 лет. Синегнойная палочка была выделена несколько реже, чем стафилококки, но занимала второе место по частоте обнаружения – 13,2 %. Группа Enterobacteriales занимала третье место по распространенности среди выделенных микроорганизмов – 12,7 %. Разнообразная группа других микроорганизмов составила четвертую группу по частоте обнаружения, куда вошли стрептококки, энтерококки, грибы рода Candida, их идентифицировано было 6,18 %. Редкими были выделены Acinetobacter spp. – 1,97 % и анаэробы 0,05 %.
В ходе пятилетнего исследования синегнойная палочка была идентифицирована как второй по распространенности возбудитель перипротезной инфекции, составляя в среднем 13,2 % от общего числа выделенных культур. За исследуемый период доля синегнойной палочки изменялась следующим образом: 2020 г. – 17 %, 2021 г. – 8,9 %, 2022 г. – 11 %, 2023 г. – 13,1 %, 2024 г. – 15,6 %.
По проведенным исследованиям доля выделенной синегнойной палочки соответствует данным литературы, опубликованным зарубежными и российскими авторами, где она варьирует от 4,4 до 23,8 %, по частоте возникновения имплантат-ассоциированных инфекций у взрослых [14, 15].
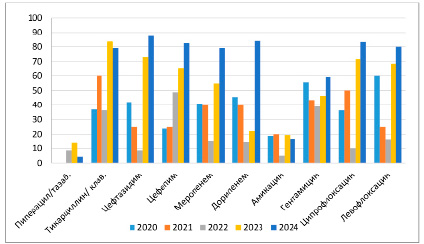
Динамика резистентности Рseudomonas aeruginosa за 2020–2024 гг.
Проведенные авторами исследования демонстрируют, что синегнойная палочка занимает второе место по частоте выделения среди исследованных патогенов при микробиологической диагностике имплант-ассоциированной инфекции, уступая лишь роду стафилококков.
В дальнейшем углубимся в исследование изменений устойчивости синегнойной палочки к антимикробным препаратам на протяжении пятилетнего периода, которая представлена на рисунке.
Группа пенициллинов, представленная пиперациллином/тазобактамом, который был исследован в течение трех лет, демонстрировала нестабильную резистентность за этот период: 8,5 % в 2022 г., 13,8 % в 2023 г. и 4,3 % в 2024 г.
При исследовании второго представителя группы пенициллинов, который исследователи наблюдали в течение пяти лет, тикарциллина/клавуланата, был выявлен более широкий диапазон резистентности, составивший от 36,2 до 83,6 %.
Цефтазидим, представитель третьего поколения цефалоспоринов, продемонстрировал крайне нестабильную резистентность в период с 2020 по 2024 г., колеблясь от 8,5 до 87,5 %.
Цефепим, широко используемый в клинической практике антибиотик четвертого поколения, за последние 5 лет продемонстрировал значительное снижение эффективности из-за постоянного роста резистентности от 25 %, достигнув 82,6 % в 2024 г.
Группа карбапенемов в течение пятилетнего периода исследования характеризовалась снижением эффективности в отношении синегнойной палочки. Резистентность к этим антибиотикам нарастала волнообразно, но в 2024 г. наблюдался резкий скачок устойчивости. Так, резистентность к меропенему увеличилась с 14,9 до 54,7 %, а затем достигла 79,2 % в 2024 г. Аналогично, резистентность к дорипенему выросла с 14,2 до 40 % и достигла 84 % в 2024 г.
В ходе исследования было выявлено, что эффективность аминогликозидов изменялась неодинаково. Резистентность к амикацину характеризовалась волнообразными колебаниями, варьируя от 5 до 20 %. В то же время эффективность гентамицина постепенно снижалась, а уровень резистентности к нему увеличился с 39,1 до 59,1 %.
Группа фторхинолонов продемонстрировала тенденцию к увеличению резистентности в течение исследуемого периода, особенно ярко выраженную в последние 2 года. Так, резистентность к ципрофлоксацину колебалась от 10 до 83,3 %, демонстрируя волнообразный характер роста у обоих представителей, а резистентность к левофлоксацину увеличилась с 16,3 до 80 %.
Анализ полученных данных позволяет сделать вывод о том, что резистентность синегнойной палочки к широкому спектру антибиотиков, включая пенициллины, цефалоспорины, карбапенемы, фторхинолоны и аминогликозиды, значительно возросла. В связи с этим выбор оптимальной схемы антибактериальной терапии для лечения перипротезных инфекций, вызванных синегнойной палочкой, требует индивидуального подхода и основывается на результатах антибиотикограммы. Тем не менее исследования авторов показали, что амикацин и пиперациллин в комбинации с тазобактамом могут быть эффективными в отношении данного патогена.
Заключение
Синегнойная палочка является значимым этиологическим агентом перипротезных инфекций, уступая по распространенности только роду стафилококков. Проведенные авторами исследования подтверждают, что синегнойная палочка является одним из наиболее распространенных возбудителей перипротезных инфекций. Несмотря на то что ранее эффективность многих групп антибиотиков против этого патогена была высокой, в настоящее время наблюдается рост антибиотикорезистентности. Полученные данные позволяют предположить, что амикацин и пиперациллин/тазобактам могут быть эффективными препаратами для лечения инфекций, вызванных синегнойной палочкой. Однако, учитывая высокую изменчивость чувствительности микроорганизмов к антибактериальным препаратам, рациональная антибиотикотерапия должна основываться на результатах микробиологического исследования и определении антибиотикограммы.
Библиографическая ссылка
Плиска Н.Н., Мусина Г.А. ОСЛОЖНЕНИЕ ПОСЛЕ ЭНДОПРОТЕЗИРОВАНИЯ, ВЫЗВАННОЕ БАКТЕРИЕЙ PSEUDOMONAS AERUGINOSA, И ДИНАМИКА НАРАСТАНИЯ ЕЕ РЕЗИСТЕНТНОСТИ // Международный журнал прикладных и фундаментальных исследований. 2025. № 2. С. 34-39;URL: https://applied-research.ru/ru/article/view?id=13694 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13694

