Введение
Широкое применение современных полимерных материалов в различных сферах человеческой деятельности, таких как строительство, медицина, транспорт, промышленность и быт, обусловлено их уникальными свойствами. Эти материалы, включая пластики, резины и композиты, характеризуются легкостью, прочностью и устойчивостью к химическим воздействиям, что делает их незаменимыми в современном мире. Огромный объем производства пластиковых изделий с учетом ограниченной переработки отходов от их использования создает серьезную экологическую проблему и реальную угрозу для здоровья людей [1, 2]. Процесс производства и активное использование изделий из органических полимеров привели к образованию и накоплению в окружающей среде частиц пластика различных размеров – от макро- до наночастиц. В настоящее время под термином «микропластик» понимают частицы синтетических полимеров размером от нанометров до 5 мм, состоящих из твердых (нерастворимых в воде и неразлагаемых) материалов. Загрязнение микропластиком объектов окружающей среды остается серьезной экологической проблемой, поскольку большая часть этих отходов не перерабатывается, а сжигается или сбрасывается на свалки.
Основными источниками пластиковых микрочастиц являются как непосредственно пластиковые отходы, так и продукты различных отраслей промышленности (косметическая, медицинская и др.). Микропластик условно делят на две группы – первичный (продукты косметической промышленности) и вторичный, который образуется из крупных пластиковых отходов [3]. Первичный микропластик производится для добавления в различную продукцию и представляет собой микрогранулы c определенными параметрами. Так, их используют при производстве косметических средств (косметика c добавлением блесток, зубные пасты c абразивными частицами, использующиеся для отбеливания зубов, и бытовая химия – в стиральных порошках для удаления пятен). В промышленности первичный микропластик используется как абразив для очистки загрязненных поверхностей зданий или технических средств, например кораблей. Также микропластик используется в 3D-принтерах [4, 5].
Вторичный микропластик образуется путем распада крупных фрагментов пластика, таких отходов, как полиэтиленовые пакеты, одноразовая пластиковая посуда, бутилированные емкости и т.п., на микроскопические частицы под влиянием сочетания физических, химических и биологических процессов в окружающей среде [4]. Также примером вторичного микропластика может служить пыль, возникающая при трении шин автомобилей о дорожное покрытие. Такой вид загрязнения как распространяется в атмосферном воздухе, так и попадает в ливневую канализацию, a далее в сточные воды города [6].
За последние годы проведено значительное количество исследований по содержанию микропластика в объектах окружающей среды [7–9], в том числе в очищенной водопроводной и бутилированной воде [10]. Однако до сих пор остаются малоизученными вопросы воздействия МП на здоровье человека [11], и недостаточной является информация о токсикокинетике и токсикодинамике микропластика в организме [12].
Цель исследования – установить наличие микрочастиц пластика размером 1000 нм в различных органах лабораторных животных при однократном поступлении.
Материалы и методы исследования
Для оценки токсикокинетики применялись образцы меченных зеленым флуоресцентным красителем микрочастиц полистирола с размерами 1000 нм (кат. № 7-3-0100) в форме 1 % суспензии в дистиллированной воде с концентрацией 10 мг/мл (длина волны пика возбуждения – 488 нм, длина волны пика эмиссии – 518 нм) (QiuHuan, КНР). Продукт предварительно высушивался при 37ºС в твердотельном термостате до стабилизации массы в пробирке с высушенным осадком, затем путем добавления испаренного количества жидкости была приготовлена суспензия микрочастиц полистирола в дистиллированной воде. Для разделения высушенного на стенках пробирок микропластика использовали центрифугу вортекс BioSan (BioSan, Латвия), ультразвуковую ванну УЗО-1-01 (Медэл, Россия) и ротатор BioSan (BioSan, Латвия).
Экспериментальные исследования проведены на 6 крысах-самках линии Wistar с начальным весом 180–200 г. Животные содержались в стандартных условиях вивария при постоянной температуре воздуха (20–25℃), уровня влажности и освещенности. Для идентификации крыс применяли индивидуальную метку на коже хвоста специальным маркером. Животные находились в оптимальных для жизни условиях микроклимата с достаточным количеством гранулированного комбинированного корма и дистиллированной воды в чистых клетках, сертифицированных для содержания лабораторных животных, с гипоаллергенным (обеспыленным) подстилом из измельченных кукурузных початков.
Уход за животными осуществляли в соответствии с ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур». Исследования выполнены в соответствии с Директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22.09.2010 о защите животных, использующихся для научных целей.
Трем опытным крысам вводили внутрисердечно в объеме 0,5 мл 1 % суспензии в дистиллированной воде микрочастиц полистирола (МП). Трем контрольным крысам вводили дистиллированную воду. МП сферической формы диаметром 1000 нм, меченный флуоресцентным красителем, предварительно «разбивали» в ультразвуковой ванне УЗО-«МЕДЭЛ» и ротаторе BioSan. Состояние вводимой суспензии контролировали в имиджере Celena X со светофильтром EGFP (Logos Biosystems, Южная Корея).
В течение 5 ч после введения исследуемых суспензий проводилось визуальное наблюдение за состоянием животных для регистрации их гибели. Морфологические и гистологические исследования: через 5 ч после введения всех животных подвергали эвтаназии. При вскрытии животных непосредственно после забоя был проведен отбор кусочков тканей шести органов (мозг, печень, почка, легкие, сердце, яичники) от каждого животного каждой группы в сосуды вместимостью 10 мл, по одному кусочку органа животного размером 0,5*0,5*0,5 см3 для приготовления микросрезов замороженных тканей. Хранение кусочков тканей до приготовления срезов на микротоме-криостате осуществлялось при -70 ℃ в криогеле. Криотомия производилась на напольном микротоме-криостате Leica СМ 1520 (Leica BioSystems, Германия), толщина срезов составляла 10 мкм, затем срезы помещались на предметное стекло и сразу производилось фотографирование при увеличении 200х со светофильтром EGFP в имиджере Celena X (Logos Biosystems, Южная Корея).
Результаты исследования и их обсуждение
На рис. 1 изображены микрофотографии органов контрольных крыс, которым вводили дистиллированную воду. В печени этих животных отмечалась равномерная умеренная флуоресценция гепатоцитов. Не было обнаружено ярко флюоресцирующих объектов сферической формы, их конгломератов либо флюоресцирующих тканевых элементов (рис. 1, А). В почках наблюдалась равномерная умеренная флюоресценция поля зрения с незначительным числом артефактов, которые выглядели как образования с нечеткой формой и слабой интенсивностью свечения (рис. 1, В). В головном мозге на всем поле зрения различались флуоресцирующие тканевые элементы размером порядка 10–12 мкм (рис. 1, С). На микрофотографиях яичников наблюдалась равномерная умеренная флюоресценция поля зрения (рис. 1, D).
На рис. 2 представлены микрофотографии органов животных опытной группы, которым внутрисердечно вводили суспензию МП диаметром 1000 нм. В печени крыс этой группы наблюдалась равномерная умеренная флуоресценция гепатоцитов. Флюоресцирующие объекты сферической формы в большей степени встречались в области печеночных триад, большое число объектов образовывали конгломераты неправильной формы (рис. 2, А).
В почках также наблюдалась равномерная умеренная флуоресценция поля зрения. Встречались флюоресцирующие объекты сферической формы, обнаруживались крупные конгломераты неправильной формы (рис. 2, В).
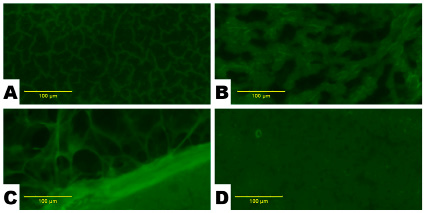
Рис. 1. Микрофотографии органов животных контрольной группы: печень (А), почки (В), яичники (С) и головной мозг (D). Равномерная умеренная фоновая флуоресценция и отсутствие ярко флуоресцирующих объектов. Увел. х100
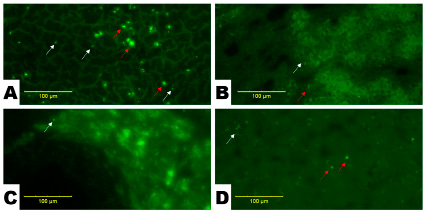
Рис. 2. Микрофотографии органов животных опытной группы: печень (А), почки (В), яичники (С) и головной мозг (D). Присутствуют ярко флуоресцирующие объекты (на них указывает белая стрелка) и их конгломераты (красная стрелка). Увел. х100
При исследовании тканей яичников крыс, подвергшихся воздействию МП размером 1000 нм обнаруживались как флуоресцирующие объекты и их конгломераты, так и большое количество флуоресцирующих тканевых элементов, сосредоточенных вокруг фолликулов яичников (рис. 1, С). Конгломераты характеризовались четкими контурами, ярким свечением, их размер достигал порядка 30–40 мкм. Отмечено обилие крупных тканевых элементов порядка 20–40 нм с нечеткими контурами и ярким свечением, некоторые из них по форме были близки к сферической.
В головном мозге этих животных наблюдались в большом количестве флуоресцирующие тканевые элементы размером порядка 1–3 мкм. Наибольшее скопление указанных объектов и элементов было сосредоточено преимущественно в коре головного мозга. Объекты изредка группировались в конгломераты размером ориентировочно 10–15 мкм, которые также характеризовались четким контуром и локализацией преимущественно в корковых структурах головного мозга (рис. 1, D).
Проведенные исследования свидетельствуют, что при однократном внутрисердечном введении частиц МП сферической формы и диаметром 1000 нм, они определялись во всех изученных органах крыс. По сравнению с животными контрольной группы, в органах опытных животных МП визуализировался более интенсивным свечением, иногда образуя конгломераты. Полученные результаты согласуются с результатами других исследовательских коллективов и подчеркивают способность микрочастиц пластика размером 1000 нм (1 мкм) накапливаться в органах и тканях. Так, Deng Y. и соавт. на примере частиц диаметром 5 и 20 мкм показали, что они способны накапливаться в печени, почках. Авторы особо подчеркивают, что кинетика накопления в тканях и характер распределения сильно зависят от размера частиц [13]. Вероятно, частицы 5 и 20 мкм имеют другую динамику миграции и распределения; возможно, они в большей степени задерживаются в местах первичного депонирования, в то время как мелкие частицы демонстрируют более широкое распределение по органам. Дополнительным подтверждением полученных данных служат сведения о способности микрочастиц пластика размером 2 мкм накапливаться в головном мозге, а дальнейшее их перераспределение в этом органе связано с возможностью захвата микрочастиц пластика клетками микроглии [14]. Существуют сведения о способности микрочастиц пластика размером 500 нм оказывать влияние на функциональное состояние яичников у крыс [15]. Однако сравнение с данными An R. и соавт. не представляется авторам данной статьи корректным, поскольку поведение в организме частиц столь разного размера может существенно различаться. Кроме того, в данной проведенной работе сделан акцент исключительно на эффектах, без внимания к кинетике микрочастиц. В доступной литературе отсутствуют работы, в которых бы исследовалось распределение частиц размером 1000 нм в ткани яичников.
Для точной и объективной оценки степени накопления МП в различных органах крыс требуется дальнейшая разработка количественных и полуколичественных методов его определения. Существенно важным является разработка единых методических подходов к решению данной проблемы, которые будут способствовать сопоставимости результатов различных исследований и улучшат понимание механизмов воздействия микропластика на живые организмы. Для выработки действенных мер по снижению негативного влияния МП на организм необходимо продолжать исследования по токсикокинетике и токсикодинамике частиц МП в биосредах, изучать возможность и различные способы выведения его из организма.
Заключение
При однократном внутрисердечном введении крысам микропластик сферической формы и диаметром 1000 нм проникает в ткани основных жизненно важных органов. Использование микропластика, меченного флуоресцентным красителем, позволило визуализировать его наличие в печени, почках, яичниках в виде отдельных частиц и в форме конгломератов. Присутствие микропластика в головном мозге может свидетельствовать о его способности преодолевать гематоэнцефалический барьер.
Библиографическая ссылка
Репина Э.Ф., Хмель А.О., Каримов Д.Д., Рябова Ю.В., Каримов Д.О., Кулагин Е.А., Ахмадеев А.Р., Кудояров Э.Р. РАСПРОСТРАНЕНИЕ МИКРОЧАСТИЦ ПЛАСТИКА РАЗМЕРОМ 1000 НАНОМЕТРОВ В ЖИЗНЕННО ВАЖНЫХ ОРГАНАХ ПРИ ОДНОКРАТНОМ ВВЕДЕНИИ ЛАБОРАТОРНЫМ ЖИВОТНЫМ // Международный журнал прикладных и фундаментальных исследований. 2025. № 2. С. 40-44;URL: https://applied-research.ru/ru/article/view?id=13695 (дата обращения: 01.01.2026).
DOI: https://doi.org/10.17513/mjpfi.13695

