Введение
Оленьи рога широко использовались в качестве нутрицевтика и лекарства в Китае, Японии и Корее на протяжении тысячелетий. Как единственный полностью регенерируемый орган млекопитающих, панты уникальны в качестве лечебного средства животного происхождения, которое можно получить, не причиняя вреда животному [1]. Панты являются источником множества биологически активных соединений, в том числе биоактивных пептидов, которые обладают более высоким уровнем активности, чем цельные белки, за счет большего количества функциональных групп [2]. В последние десятилетия пептиды оленьих пантов привлекли внимание ученых из-за разнообразных полезных биологических эффектов. Были проведены исследования с использованием молекулярных методов, а также клеточных и животных моделей для подтверждения фармакологического действия этих компонентов, доказавшие, что пептиды пантов обладают антиоксидантным, противовоспалительным, гипогликемическим, противоопухолевым свойствами, противодействуют фиброзу органов и неврологическим заболеваниям, способствуют регенерации костной ткани, а также замедляют процессы старения [1, 2, 3].
В настоящее время возрастающую актуальность для медицины приобретает коррекция стресс-индуцированных нарушений. Как известно, при действии различных неблагоприятных факторов организм может использовать либо резистентную, либо толерантную стратегии адаптации. Реализация адаптации по резистентному типу нередко приводит к дезадаптивным эффектам, которые проявляются в виде снижения устойчивости к гипоксии, увеличения вероятности ишемических повреждений жизненно важных органов и систем организма, истощения иммунологического надзора [4, 5]. Все это определяет полиморфность симптоматики срыва адаптационных реакций с вовлечением в процесс различных звеньев гомеостаза, который при прогрессировании имеет тенденцию к генерализации. В связи с этим поиск новых высокоэффективных, универсальных и стабильных биологически активных веществ и лекарственных форм представляется актуальным для целей профилактической и восстановительной медицины. Одним из легкодоступных и экологически чистых источников биологически активных веществ природного происхождения считаются панты алтайского марала.
В связи с вышеизложенным целью данного исследования явилась сравнительная оценка адаптогенного эффекта экстракта пантов марала при внутреннем введении лабораторным крысам с моделью многокомпонентного стресса.
Материал и методы исследования
Объектом исследования были 60 самцов крыс линии Wistar в возрасте 3–4 месяца, массой 260–310 г, выращенных в сертифицированном питомнике. Животных содержали по 7–8 особей в просторных пластиковых клетках в виварии Томского НИИКиФ ФФГБУ ФНКЦ МРиК ФМБА России при естественном освещении, со свободным доступом к воде и стандартизированному комбинированному корму. Все процедуры с животными выполняли в соответствии с правилами и рекомендациями гуманного обращения с животными, используемыми для экспериментальных и иных научных целей (приказ Минздрава России от 18 мая 2021 г. № 464н «Об утверждении Правил проведения лабораторных исследований»). Содержание животных и дизайн эксперимента были одобрены Локальным этическим комитетом ФГБУ ФНКЦ МРиК ФМБА России после проведения независимой экспертизы на соответствие этическим нормам и принципам биомедицинских исследований (протокол № 3 от 28 марта 2024 г.).
Экспериментальные животные были разделены на следующие группы: 1) интактная, 2) контрольная, 3) группа сравнения, 4) опытная. У 45 животных моделировали состояние хронического многокомпонентного стресса путем последовательного воздействия светового десинхроноза и длительной физической нагрузки [6]. Для индукции экспериментального десинхроноза крысы круглосуточно находились при полном затемнении в течение 10 суток. После этого животных подвергали длительной физической нагрузке в виде принудительного плавания с грузом при температуре воды 26°С до полного утомления. Плавание проводили в специальной боксированной установке с утяжеляющим грузом, равным по весу 10% от массы тела конкретной особи, в утренние часы до кормления ежедневно в течение 5 дней. Животные плавали до полного утомления (пока не начинали тонуть). После моделирования состояния многокомпонентного стресса 15 крысам опытной группы внутрижелудочно через зонд вводили 1%-ный раствор экстракта пантов марала 1 раз в сутки в течение 10 дней, а 14 крысам группы сравнения – этилметилгидроксипиридина сукцинат в дозе 10 мг/кг из расчета по 0,5 мл на 100 г массы тела. Контрольную группу составили 16 крыс, получавших очищенную воду в эквивалентном объеме. Фоновые значения исследуемых показателей были получены у 15 интактных крыс.
Через 10 суток у всех крыс оценивали психоэмоциональный статус в тесте «открытое поле» по методу C.S. Hall [7]. Далее животных выводили из эксперимента одномоментным декапитированием под СО2-наркозом, осуществляли забор крови для исследования, извлекали левый надпочечник (поскольку этот орган парный). В сыворотке крови проводили аналитические измерения концентрации кортикостерона с применением твердофазного неконкурентного иммуноферментного анализа согласно инструкции производителя набора («IBL», Германия).
Структурные изменения надпочечников исследовали с помощью выполнения гистологического анализа по стандартной методике [8, с. 3–58]. Образцы данного органа фиксировали в 10%-ном забуференном формалине, обезвоживали в растворах этанола возрастающей концентрации (70%, 95%, 98%), просветляли в бутаноле и заключали в парафин («LabPoint», Россия). Срезы толщиной 5–7 мкм изготавливали на ротационном микротоме RMD-3000 («MTPoint», Россия). Препараты окрашивали гематоксилином Майера и эозином. Микроскопирование, изготовление снимков и морфометрические измерения осуществляли с использованием системы, состоящей из микроскопа «Axio Lab A1», камеры «AxioCam ERc 5s» и программного обеспечения «ZEN 2012» («Carl Zeiss Microscopy», Германия).
При обработке полученных данных использовали автоматизированные способы статистического описания, включающие проверку на нормальность распределения исследуемого признака по критерию Шапиро–Вилка, расчет медианы (М), верхнего и нижнего квартилей (Q1; Q3), а также методы проверки статистических гипотез при межгрупповом сравнении показателей с помощью непараметрического критерия Манна–Уитни. Различия считали статистически значимыми при уровне р<0,05.
Результаты исследования и их обсуждение
Анализ показателей теста «открытое поле» определил уменьшение частоты регистрации горизонтальной и увеличение частоты вертикальной активностей, а также учащение актов груминга при моделировании у грызунов состояния хронического многокомпонентного стресса по сравнению с интактными крысами (табл. 1). Это свидетельствует о появлении сильного эмоционального напряжения отрицательного характера, например страха, беспокойства [9]. Известно об истощающем воздействии сочетания стресс-индуцирующих агентов на адаптивные резервы, особенно при их длительной совместной экспозиции [10].
Высокий уровень в сыворотке крови стресс-реализующего гормона – кортикостерона – подтвердил выраженные проявления классической картины фазы тревоги общего адаптационного синдрома у крыс контрольной группы (табл. 2). В связи с тем, что кортикостерон вырабатывается надпочечниками, была проведена оценка их структурно-функционального состояния у исследуемых животных. В качестве размерного показателя использовали площадь пучковой зоны коры надпочечника как один из объективных критериев оценки секреторной активности железы [11]. Полученные результаты морфометрического анализа указали на увеличение пучковой зоны коры надпочечника у крыс контрольной группы (табл. 2), связанное с гипертрофией адренокортикоцитов ввиду напряжения их синтетической активности, направленной на выработку кортикостерона [11]. Таким образом, проведенное исследование свидетельствовало, что сочетанное воздействие десинхроноза и физического переутомления является мощным стрессирующим фактором для организма.
Для профилактики и коррекции стресс-индуцированных нарушений существует широкий спектр адаптогенных препаратов различного генеза. Перспективными в этом отношении считаем продукты пантового мараловодства как экологически чистые средства природного происхождения, сочетающие огромный спектр биологически активных веществ и физиологичное воздействие модулирующего характера. Выраженность адаптогенного действия тестируемого средства оценивали в сравнении с аналогичными эффектами такого традиционно используемого в клинической практике адаптогена, как этилметилгидроксипиридина сукцинат. Механизм противострессорного действия данного синтетического фармакопейного препарата обусловлен активацией эндогенных стресс-лимитирующих систем, в частности ГАМК-эргической [12].
Тестирование в установке «открытое поле» показало, что курсовой прием пантового экстракта на фоне многокомпонентного стресса нивелировал негативные стресс-обусловленные проявления в поведенческих реакциях по типу преобладания торможения. Так, все показатели данного теста, кроме груминга, у крыс опытной группы соответствовали норме и значениям аналогичных параметров у животных, получавших препарат сравнения (табл. 1).
Таблица 1
Показатели теста «открытое поле» у крыс с моделью многокомпонентного стресса после приема адаптогенов, Me (Q1; Q3)
|
Исследуемые показатели |
Интактные крысы (n=15) |
Крысы с моделью стресса, получавшие |
Р-уровень значимости межгрупповых различий |
||
|
воду (n=16) |
этилметил- гидроксипиридина сукцинат (n=14) |
экстракт пантов (n=15) |
|||
|
1 |
2 |
3 |
4 |
||
|
Горизонтальная активность, усл.ед. |
41,0 (29,5; 48,5) |
32,0 (22,0; 42,0) |
42,5 (29,5; 48,5) |
45,0 (39,3; 51,3) |
p1-2=0,021 p1-3=0,356 p1-4=0,356 p2-3=0,016 p2-4=0,002 p3-4=0,086 |
|
Вертикальная активность, усл.ед. |
7,5 (6,5; 16,5) |
15,0 (10,5; 19,0) |
5,0 (3,0; 8,5) |
8,5 (6,0; 10,0) |
p1-2=0,015 p1-3=0,861 p1-4=0,356 p2-3=0,004 p2-4=0,042 p3-4=0,056 |
|
Груминг, усл.ед. |
0,5 (0,0; 1,5) |
0,0 (0,0; 0,0) |
0,5 (0,0; 1,5) |
0,0 (0,0; 1,0) |
p1-2=0,023 p1-3=0,585 p1-4=0,356 p2-3=0,036 p2-4=0,052 p3-4=0,032 |
|
Норковый рефлекс, усл.ед. |
4,0 (3,0; 5,5) |
7,5 (5,0; 10,5) |
5,0 (4,0; 6,5) |
4,5 (3,3; 6,0) |
p1-2=0,012 p1-3=0,592 p1-4=0,356 p2-3=0,056 p2-4=0,021 p3-4=0,382 |
|
Частота дефекации, усл.ед. |
0,5 (0,0; 0,5) |
1,0 (0,0; 1,3) |
1,0 (0,5; 1,5) |
1,5 (0,5; 2,0) |
p1-2=0,593 p1-3=0,855 p1-4=0,056 p2-3=0,224 p2-4=0,282 p3-4=0,456 |
Таблица 2
Показатели структурно-функционального статуса надпочечников у крыс с моделью многокомпонентного стресса после приема адаптогенов, Me (Q1; Q3)
|
Исследуемые показатели |
Интактные крысы (n=15) |
Крысы с моделью стресса, получавшие |
Р-уровень значимости межгрупповых различий |
||
|
воду (n=16) |
этилметил- гидроксипиридина сукцинат (n=14) |
экстракт пантов (n=15) |
|||
|
1 |
2 |
3 |
4 |
||
|
Содержание кортикостерона, нг/мл |
97,9 (77,1; 108,6) |
189,1 (135,1; 223,8) |
101,3 (68,2; 112,6) |
81,3 (52,7; 94,4) |
p1-2=0,004 p1-3=0,119 p1-4=0,356 p2-3=0,026 p2-4=0,002 p3-4=0,116 |
|
Площадь пучковой зоны коры надпочечника, мм2 |
4,1 (3,6; 4,9) |
5,1 (3,9; 5,8) |
3,8 (3,1; 4,5) |
4,0 (4,1; 4,9) |
p1-2=0,013 p1-3=0,669 p1-4=0,748 p2-3=0,005 p2-4=0,029 p3-4=0,456 |
Уменьшение количества актов груминга у крыс контрольной и опытной групп (табл. 1) как неспецифический показатель уровня эмоциональности является одним из механизмов снятия избыточной активности ЦНС.
У животных опытной группы после моделирования многокомпонентного стресса и приема экстракта пантов уровень кортикостерона в сыворотке крови не имел статистически значимого отличия по сравнению с интактной группой (р=0,356) и группой сравнения (р=0,116) (табл. 2). Данный факт может свидетельствовать о том, что рассматриваемое средство животного происхождения при предъявлении двух стрессирующих факторов последовательно (длительная физическая нагрузка на фоне циркадного десинхроноза) восстанавливает адекватный характер протекания стресс-реакций организма в той же степени, что и этилметилгидроксипиридина сукцинат. При этом гипертрофия пучковой зоны коры надпочечника, отмеченная у контрольных крыс, получавших воду, у животных опытной группы отсутствует (р=0,029) (табл. 2), что, вероятно, связано с адаптогенным действием пантового экстракта. Микроскопический и морфометрический анализы установили, что значимых различий в изменении структуры надпочечников при используемых вариантах коррекции многокомпонентного стресса нет. Визуально при микроскопии отмечена лишь разная степень эозинофильности цитоплазмы адренокортикоцитов надпочечника у крыс разных групп, что обусловлено различной степенью вакуоляризации данных клеток (рисунок).
Полученные результаты согласуются с данными других авторов о высоком адаптогенном потенциале препаратов пантового мараловодства. Так, применение пантокрина в эксперименте у белых мышей при физической нагрузке способствовало восстановлению ткани миокарда и, соответственно, более длительной плавательной активности [13]. Пантокрин также благоприятно действовал на слизистую оболочку желудка, проявлял умеренную антигипоксическую активность, снижал развитие гипертрофии надпочечников у крыс, подвергшихся воздействию стресса [14]. Включение экстракта пантов в клинические рекомендации, посвященные медицинским технологиям коррекции различных стресс-обусловленных состояний, позволяет восстановить нарушенные физиологические функции и повысить работоспособность, выносливость [15].
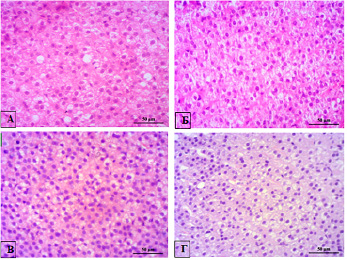
Пучковая зона надпочечника: А – интактной крысы, Б – крысы с моделью хронического многокомпонентного стресса, получавшей воду, В – крысы с моделью хронического многокомпонентного стресса, получавшей этилметилгидроксипиридина сукцинат, Г – крысы с моделью хронического многокомпонентного стресса, получавшей экстракт пантов. Окрашивание: гематоксилин-эозин
Заключение
В ходе проведения сравнительного испытания экстракта пантов марала на модели многокомпонентного стресса у крыс было продемонстрировано адаптогенное действие, сопоставимое по эффективности с аналогичным свойством стандартизированного фармакопейного адаптогена синтетического происхождения – этилметилгидроксипиридина сукцината. Экстракт пантов марала нивелирует срыв адаптации и выраженные проявления хронического стресса при сочетанном воздействии стресс-индуцирующих факторов в виде светового десинхроноза и физического переутомления в экспериментальных условиях у модельных животных.
Представленные данные свидетельствуют о перспективности разработки и использования препаратов на основе пантов маралов для профилактики и коррекции негативных стресс-реакций. Дальнейшие исследования, направленные на выявление и изучение биологически активных компонентов пантов, а также проведение масштабных клинических испытаний позволят более полно раскрыть их адаптогенный потенциал и разработать новые эффективные методы терапии хронической усталости.
Библиографическая ссылка
Жукова О.Б., Зайцев К.В., Гостюхина А.А., Дорошенко О.С., Ярцев В.В., Степанова А.М., Гамеева Е.В. СРАВНИТЕЛЬНАЯ ОЦЕНКА АДАПТОГЕННОГО ЭФФЕКТА ЭКСТРАКТА ПАНТОВ МАРАЛА В УСЛОВИЯХ МНОГОКОМПОНЕНТНОГО СТРЕССА // Международный журнал прикладных и фундаментальных исследований. 2025. № 4. С. 13-18;URL: https://applied-research.ru/ru/article/view?id=13712 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13712

