Введение
Одним из широко используемых на практике окислителей является пероксид водорода. Его часто применяют в качестве отбеливателя, антисептика, гидрирующего агента, а также для очистки сточных вод [1]. По сравнению с другими окислителями пероксид водорода обладает рядом преимуществ: он вступает в различные реакции окисления и восстановления, разлагается с образованием кислорода и воды. В отсутствии катализаторов происходит медленное спонтанное разложение:
2Н2О2 → 2Н2О + О2 [2].
Высокую скорость окисления загрязнителей пероксидом водорода можно обеспечить при использовании катализаторов процесса его разложения [3; 4]. Одним из эффективных катализаторов для разложения пероксида водорода является серебро [5]. Реакция разложения протекает на поверхности катализатора. Вначале молекулы пероксида водорода адсорбируются на активных центрах поверхности серебра, а затем адсорбированный пероксид водорода подвергается разложению. Адсорбция пероксида водорода протекает по следующей схеме [6]:
H2O2 (aq) + Ag (s) → H2O2 ∙ Ag (s). (1)
На поверхности происходят следующие превращения:
H2O2 ∙ Ag (s) → O2 ∙ Ag (s) + H2O (l); (2)
O2 ∙ Ag (s) → O2 (g) + Ag (s). (3)
Образовавшаяся вода остается в жидкой фазе, а кислород десорбируется с поверхности катализатора в газовую фазу.
Особое значение имеет изучение кинетики протекающих при этом процессов, поскольку это позволяет выяснить механизм реакций и возможность управления процессом. Для описания механизма процесса, протекающего с участием катализатора, могут быть использованы различные подходы [7]. Катализаторы можно рассматривать в качестве моделей ферментов [8].
Цель исследования – изучить кинетику разложения пероксида водорода в водной среде при различных температурах, значениях рН среды в присутствии катализатора, синтезированного пропиткой угля раствором соли серебра (Ag-У).
Материалы и методы исследования
Синтез и свойства полученного катализатора подробно описаны одним из авторов ранее [9]. Проанализировано временное изменение концентрации пероксида водорода в растворах с фиксированной начальной концентрацией равной 170 мг/л при разных значениях рН и температуры. Кислую среду создавали добавлением соляной кислоты в раствор, щелочную – гидроксидом натрия. Контроль вели по показаниям рН-метра. Реакцию проводили в термостатируемой установке при 50–90 ºС.
По окончании времени реакции (10–60 мин) остаточную концентрацию пероксида водорода в растворе определяли общеизвестным йодометрическим методом [10, с. 49].
СЭМ проводили на приборе TESCAN Vega 3 LMH, оборудованным энергодисперсионным рентгеновским микроанализатором Oxford X-ACT c программным обеспечением Oxford AZtec Energy. Качественный и количественный энергодисперсионный химический анализ проводился в режимах сканирования Point-ID (точечное сканирование).
Результаты исследования и их обсуждение
Пероксид водорода при комнатной температуре без катализатора разлагается очень медленно: например, за первые 10 мин скорость его разложения равна 0,70∙10-5 моль/лсг (табл. 1).
Присутствие серебряного катализатора ускоряет реакцию разложения пероксида водорода (табл. 2).
Таблица 1
Кинетические данные по разложению пероксида водорода
|
t, мин |
[H2O2]*10-3, моль/л |
Ѵ*10-5, моль/лсг |
m*103, моль/л |
|
10 |
4,58 |
0,70 |
0,46 |
|
20 |
4,26 |
0,53 |
0,43 |
|
30 |
4,10 |
0,27 |
0,41 |
|
40 |
4,00 |
0,17 |
0,40 |
|
50 |
3,95 |
0,08 |
0,39 |
|
60 |
3,92 |
0,05 |
0,39 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Таблица 2
Кинетические данные по разложению пероксида водорода в присутствии катализатора Ag-У (t = 25 ºC, mkat = 0,1 г)
|
t, мин |
[H2O2]*10-3, моль/л |
1/[H2O2]*10-3, л/моль |
Ѵ*10-5, моль/лсг |
m*103, моль/л |
|
10 |
2,49 |
0,40 |
5,85 |
0,25 |
|
20 |
2,28 |
0,44 |
0,35 |
0,23 |
|
30 |
2,14 |
0,48 |
0,23 |
0,21 |
|
40 |
2,00 |
0,50 |
0,23 |
0,20 |
|
50 |
1,87 |
0,53 |
0,22 |
0,19 |
|
60 |
1,77 |
0,56 |
0,17 |
0,18 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
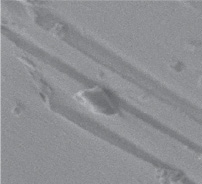
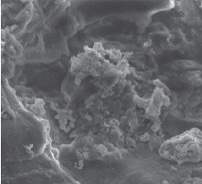
а б
Рис. 1. Микрофотографии СЭМ: а – исходный уголь, б – Ag-У Источник: составлено авторами по результатам данного исследования
Для описания механизма процесса, протекающего с участием катализатора, могут быть использованы различные подходы. Катализаторы можно рассматривать в качестве модели ферментов [8]. Предполагается, что реакция разложения пероксида водорода в присутствии серебряного катализатора протекает через образование промежуточного комплекса между реагентом и катализатором [11].
На активность катализатора оказывает существенное влияние его морфология.
Снимки СЭМ полученных образцов показывают наличие пористой структуры. Образец исходного угля (рис. 1, а) имеет плотную поверхностную структуру. Текстура поверхности серебряных катализаторов (рис. 1, б) состоит из плотно сросшихся глобул, между которыми просматриваются пустоты, образующие бугристую текстуру поверхности. Как было отмечено в работе [9], серебро на поверхности катализатора имеет кристаллическую структуру. Описанная здесь морфология нанесенного катализатора облегчает формирование промежуточных активированных комплексов с молекулами субстрата. Увеличение скорости реакции разложения Н2О2 с ростом его концентрации объясняется увеличением частоты эффективных столкновений между молекулами пероксида водорода и активными центрами катализатора Ag-У, что и приводит к значительному ускорению процесса (рис. 2).
О каталитической активности катализатора можно судить по константе Михаэлиса, которая выражает сродство катализатора к субстрату [12]. Чем меньше константа Михаэлиса, тем выше активность катализатора и тем интенсивнее будет протекать катализ (табл. 3).
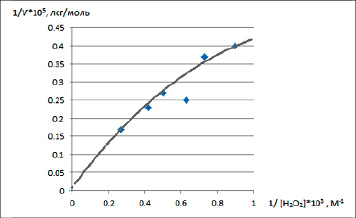
Рис. 2. Зависимость скорости разложения пероксида водорода от его концентрации по схеме Михаэлиса – Ментен в присутствии Ag-У Источник: составлено авторами по результатам данного исследования
Таблица 3
Значения констант скорости реакции и Михаэлиса разложения пероксида водорода в присутствии катализатора Ag-У при разных температурах
|
T, ºC |
K*10-3, 1/c |
Ѵm*10-4, моль/лсг |
Km*10-4 |
|
25 |
1,77 |
2,0 |
1,4 |
|
35 |
2,50 |
2,5 |
1,1 |
|
45 |
3,16 |
3,3 |
1,9 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Для описания изучаемого процесса выбрана общая модель, которая предполагает связывание с катализатором «n» молекул субстрата и описывается следующей схемой [13]:
k1 k3
nS + K ↔ KSn → K + nP (4)
k2
Согласно схеме Михаэлиса – Ментен скорость реакции в данном случае выражается следующим уравнением:
Ѵ = Ѵm[S]n / Km + [S]n. (5)
При дальнейшей трансформации данного выражения
Ѵ = Ѵm [S]n / Km + [S]n; (6)
Ѵ Km + Ѵ[S]n = Ѵm [S]n; (7)
Ѵ Km = Ѵm [S]n – Ѵ[S]n; (8)
Ѵ Km = [S]n (Ѵm – Ѵ); (9)
Ѵ / (Ѵm – Ѵ) = [S]n / Km (10)
получаем следующее уравнение
lg (Ѵ / Ѵm – Ѵ) = n lg S – lg Km, (11)
позволяющее определить значение «n» по наклону прямой зависимости lg (Ѵ / Ѵm – Ѵ) от lg [S] в координатах Хилла [14].
Результаты исследований показали, что «n» имеет дробное значение (рис. 3). Это может быть объяснено неодновременным связыванием молекул субстрата с активными центрами катализатора при формировании промежуточного активированного комплекса. Образующиеся при этом координационные узлы представляются неоднородными, то есть могут включать как одну, так и две молекулы субстрата. Возможно также, что связывание одной молекулы субстрата влияет на эффективность связывания другой.
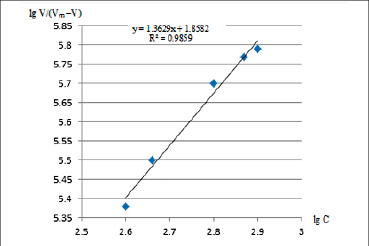
Рис. 3. Зависимость скорости разложения пероксида водорода от его концентрации в координатах Хилла в присутствии катализатора Ag-У Источник: составлено авторами по результатам данного исследования
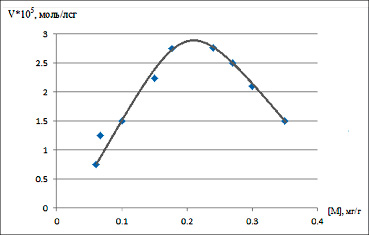
Рис. 4. Зависимость скорости разложения пероксида водорода от содержания металла в фазе Ag-У Источник: составлено авторами по результатам данного исследования
Состав координационных узлов, образующихся в катализаторе при разных концентрациях иона металла, оказывает влияние на формирование в процессе реакции промежуточного активированного комплекса и, следовательно, на каталитическую активность. Как показано на рис. 4, зависимость скорости разложения пероксида водорода от концентрации ионов металла проходит через экстремум.
Вероятно, что в области небольших концентраций серебра в фазе катализатора формирование промежуточных активированных комплексов облегчено за счет участия более устойчивых координационных узлов, образующихся при вовлечении в процесс комплексообразования наиболее доступных лигандных групп катализатора [15]. Повышение скорости реакции, соответствующее последующему интервалу увеличения содержания ионов металлов в катализаторе, следует отнести к увеличению каталитически активных центров в реакционной системе. Однако при дальнейшем увеличении содержания ионов металла в массе катализатора происходит их диффузия вглубь матрицы угля. При этом насыщенность координационной сферы ионов металла лигандными группами катализатора увеличивается. Как следствие, возрастает конкурентность координационных центров по лигандным группам катализатора, уменьшается их устойчивость, и образование промежуточного активного комплекса затрудняется, что, вероятно, объясняется понижением каталитической активности.
Заключение
В рамках данного исследования была изучена кинетика разложения пероксида водорода в водной среде в присутствии серебряного катализатора, синтезированного методом пропитки угля солью серебра. Полученные данные позволили определить закономерности процесса, включая влияние температуры и рН на скорость реакции, а также выявить каталитическую активность разработанного катализатора Ag-У в различных условиях. Результаты работы подтверждают эффективность данного подхода к синтезу катализаторов для реакций разложения пероксида водорода и могут служить основой для дальнейших исследований по оптимизации процесса и разработке новых, более эффективных каталитических систем.
Конфликт интересов
Библиографическая ссылка
Камбарова Г.Б., Ли С.П., Худайбергенова Э.М., Жоробекова Ш.Ж. РАЗЛОЖЕНИЕ ПЕРОКСИДА ВОДОРОДА В ПРИСУТСТВИИ СЕРЕБРЯНОГО КАТАЛИЗАТОРА // Международный журнал прикладных и фундаментальных исследований. 2025. № 7. С. 31-36;URL: https://applied-research.ru/ru/article/view?id=13739 (дата обращения: 13.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13739

