Введение
Вопрос выраженности поражения органов дыхания в постковидном периоде (ПКП), а также угроза перехода организующейся пневмонии (ОП) в фиброз легких (ФЛ) в постковидном периоде не теряет своей актуальности до настоящего времени. В мультифакторном патогенезе организующейся пневмонии важная роль принадлежат системным эффектам воспаления, эндотелиальной и иммунной дисфункции, окислительному стрессу [1–3]. На клеточно-молекулярном уровне индукция перечисленных выше патологических процессов может быть детерминирована нарушением ультраструктуры и функционирования важной клеточной органеллы – митохондрии [4]. Известно, что альтерация митохондриального аппарата клеток лежит в основе патогенеза ишемической болезни сердца, нейродегенеративных заболеваний, развития фиброзных изменений, ожирения, метаболического синдрома, астмы и многих других патологических процессов [4, 5]. Наиболее информативным ферментом, определяющим функциональную активность митохондрий лимфоцитов, является сукцинатдегидрогеназа (СДГ) [6], которая участвует в формировании электрон-транспортной цепи в цикле Кребса, в образовании основного источника энергии в клетке – аденозинтрифосфат (АТФ), прочно связана с внутренней мембраной митохондрий. Таким образом, функционирование СДГ митохондрий характеризует энергетический обмен в клетке. Митохондриальная дисфункция приводит к продукции и накоплению активных форм кислорода (АФК) [7, 8], которые стимулируют выработку провоспалительных цитокинов и хемокинов, среди которых особое внимание уделялось продукции IL-1β, IL-6, IL-8, IL-13, TNF-α [9–11]. При заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность лактатдегидрогеназы (ЛДГ) в крови повышается, в связи с чем она является важным маркером тканевой деструкции. Следует отметить, что увеличение активности фермента не связано с каким-либо конкретным заболеванием, а помогает в диагностике заболеваний, сопровождающихся хронической гипоксией [12]. Таким образом, в постковидном периоде можно ожидать более выраженной дисфункции активности ферментов энергетического баланса клеток, которые могут не зависеть от тяжести течения острого периода коронавирусной инфекции.
Цель исследования – изучить динамику изменений показателей ферментов энергетического обмена в лимфоцитах периферической крови, связанных с клеточным дыханием: сукцинатдегидрогеназы и лактатдегидрогеназы – у пациентов разных возрастных групп с организующейся пневмонией в постковидном периоде в 2023 и 2024 гг.
Материалы и методы исследования
Обследовано в динамике 298 пациентов разных возрастных групп (от 18 до 72 лет) с верифицированным диагнозом согласно стандартным клинико-лабораторным, функциональным и инструментальным методам диагностики ОП в ПКП [13, 14]. Все пациенты подписывали информированное согласие, имели при поступлении на лечение трехкратный отрицательный результат ПЦР-теста на РНК вируса SARS-CoV-2. Программа исследования была одобрена ЛЭК БПНЦ РАН, протокол № 22 от 25.12.2020. Компьютерное томографическое исследование (КТ) органов грудной клетки выполнялось на аппарате «Сименс» (Германия). Активность ферментов энергетического баланса в лимфоцитах крови пациентов с ОП и 20 пациентов группы контроля, которые не имели в ПКП признаков ОП, измеряли разработанным авторами цитобиохимическим методом (ЦБХ) [15], путем определения количества продукта реакции восстановления нитросинего тетразолия (НСТ). В качестве биомаркеров процессов переключения путей окисления в клетке использовали два фермента: сукцинатдегидрогеназу (СДГ) как показатель активности митохондриального дыхания и лактатдегидрогеназу (ЛДГ) как показатель одного из восстановительных путей поддержания биосинтезов – гликолиза и его динамического фонда взаимопревращений молочной и пировиноградной кислот. Одновременное определение активности СДГ и ЛДГ дает значительно более полную картину окислительного обмена в клетке, которая недоступна в исследованиях выделенных митохондрий [15]. ЛДГ в сыворотке крови изучали кинетическим ультрафиолетовым методом (УФ кинетический тест) на биохимическом автоматическом анализаторе BS-400 Mindray, КНР, с использованием тест-системы АО «Вектор-Бест» (Россия). Для статистического анализа и графического представления данных использовали программное обеспечение Microsoft Office Excel 2010 (плагин AtteStat), Stat Soft STATISTICA 10.1 и Sigma Plot (SystatSoftwareInc, Сан-Хосе, Калифорния, США).
Результаты исследования и их обсуждение
Для изучения в динамике показателей ферментов энергетического обмена в лимфоцитах периферической крови 298 пациентов были распределены в группы по возрастам:
1 гр. (n = 46) – от 18 до 39 лет, из них активно курили 68 %;
2 гр. (n = 121) – от 40 до 59 лет, курили 54 %;
3 гр. (n = 131) – от 60 лет и старше, курили 46 %.
Группу контроля составили 20 пациентов в возрасте от 18 до 60 лет и старше. Все они не имели в анамнезе клинических проявлений коронавирусной инфекции и клинико-инструментального подтверждения ОП при КТ исследовании органов грудной клетки. Активно курили из них 44 %. Распределение пациентов по полу было равномерным по всем группам – лиц мужского пола 30 % и женского пола 70 %. Из сопутствующих заболеваний регистрировались заболевания сердечно-сосудистой системы, сахарный диабет, ожирение и др. более чем у 80 % пациентов. В клинической картине у пациентов с ОП наиболее значимыми были следующие симптомы: длительный малопродуктивный кашель, тяжесть в грудной клетке, выраженная слабость, хроническая усталость, непостоянные боли в горле, мигрирующие боли и дискомфорт в мышцах и суставах, длительный субфебрилитет, частые ОРВИ, регионарная лимфоаденопатия, нарушение структуры сна и процесса засыпания, снижение памяти, внимания. Полученные авторами результаты исследований согласуются с данными А.Г. Чучалина и J.E. Gold с соавт. [16, 17].
При динамическом наблюдении установлено, что в возрасте 18–40 лет у 21,7 % пациентов сохранялись в течение года при КТ-исследовании симптомы поражения легких. В возрасте 41–60 лет этот процент составлял 10,7 % и в возрасте 61 и старше – 45,8 %.
При лабораторном обследовании у 47,5 % пациентов всех возрастных групп с признаками ОП отмечалась стойкая лейкоцитопения (2,5±0,9 г/л) и стойкая лимфоцитопения (0,93±1,02 кл/мкл). Особенно важно учитывать такие изменения у пациентов молодого возраста при отсутствии через 12 месяцев у них клинических и функциональных проявлений поражения органов дыхания. Все они имели умеренно выраженные проявления ОП при КТ-исследовании [18–20]. В качестве маркеров процессов переключения путей окисления в клетке использовали два фермента: сукцинатдегидрогеназу (СДГ) как показатель активности митохондриального дыхания и лактатдегидрогеназу (ЛДГ) как показатель одного из восстановительных путей поддержания биосинтезов – гликолиза и его динамического фонда взаимопревращений молочной и пировиноградной кислот. Результаты измерения активностей СДГ и ЛДГ, цитобиохимическим методом в лимфоцитах периферической крови, у пациентов с ОП через 12 мес. в разных возрастных группах и группе контроля представлены на рис. 1, А и Б.
В группе 1 активности СДГ имеют средние значения, превышающие значения группы контроля. Активность ЛДГ приближена к значениям контрольной группы. В группе 2 наблюдалось увеличение средней активности СДГ и ЛДГ (на 14 и 28 % соответственно). Превышение показателей СДГ в 1,5 раза и ЛДГ в 1,65 раза по сравнению с контрольной группой было выявлено у пациентов группы 3. Такое увеличение активности ферментов указывает на повышение активации гликолиза и свидетельствует о возможной, на грани срыва, активации механизмов энергообеспечения клеток организма, что является неблагоприятным признаком течения заболевания. В этой же возрастной группе в течение последующего года в 45,8 % сохранялись изменения в легких, такие как линейные тяжи, тени типа «матового стекла», сетчатый рисунок, уплотнения и признаки бронхоэктазов. Изучение в динамике активности ферментов СДГ и ЛДГ в лимфоцитах периферической крови (1 гр., n = 22) и ЛДГ в сыворотке венозной крови у пациентов в возрастной группе 60 лет и старше без клинико-функционального и КТ-подтверждения признаков ОП через 12 месяцев в сравнении с пациентами этой же возрастной группы с сохраняющимися признаками ОП (2 гр., n = 20) представлены на рис. 2 и 3.
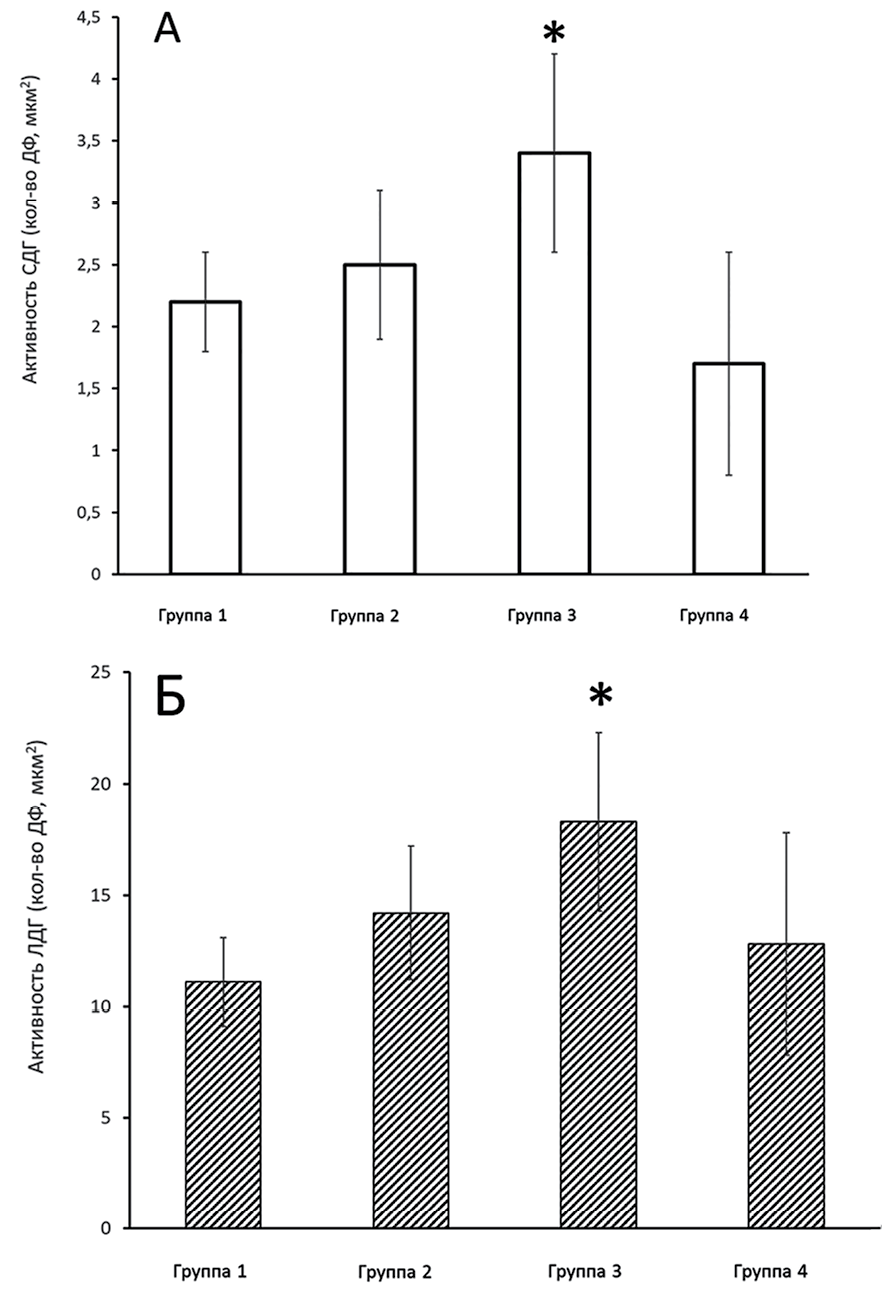
Рис. 1. Средние значения активностей СДГ (А) и ЛДГ (Б) в обследуемых группах с ОП через 12 месяцев: 1 гр. (n = 22) – пациенты 18–39 лет; 2 гр. (n = 24) – пациенты 40–59 лет; 3 гр. (n = 21) – пациенты > 60 лет; 4 гр. (n = 20) – контрольная группа Источник: составлено авторами по результатам данного исследования
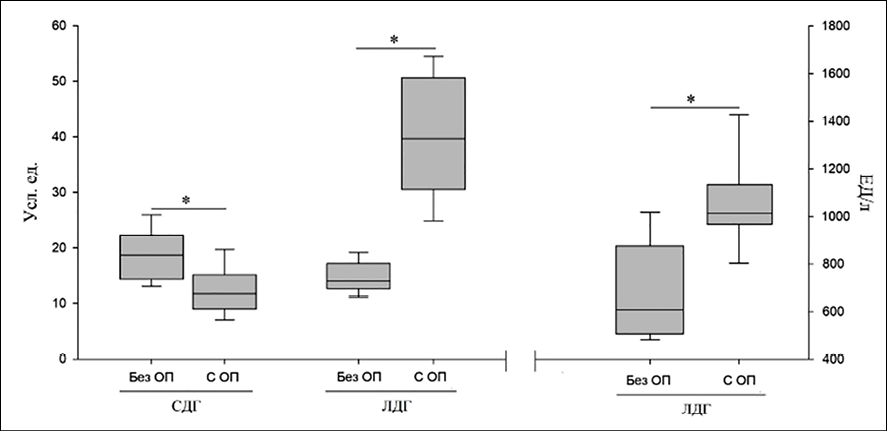
Рис. 2. Изменения активности СДГ и ЛДГ в лимфоцитах периферической крови и ЛДГ в сыворотке венозной крови у пациентов групп 1 и 2 в 2023 г. Источник: составлено авторами по результатам данного исследования
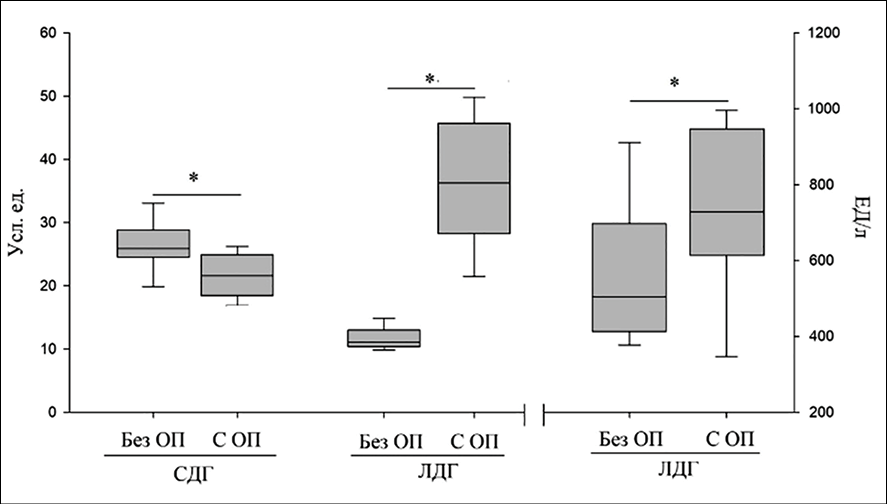
Рис. 3. Изменения активности СДГ и ЛДГ в лимфоцитах периферической крови и ЛДГ в сыворотке венозной крови у пациентов групп 1 и 2 в 2024 г. Источник: составлено авторами по результатам данного исследования
Возрастная группа 60 лет и старше выбрана в связи с тем, что постковидный период у лиц пожилого возраста имеет свои особенности, связанные с возрастными изменениями организма и сопутствующими заболеваниями, приводящими к более высокому риску развития осложнений в постковидном периоде [21–23]. Из представленных результатов следует, что ферменты энергетического обмена в лимфоцитах периферической крови имели выраженный дисбаланс, который сохранялся в течение 12 месяцев. Так, активность СДГ у пациентов с ОП в 2023 г. была повышена в 1,5 раза и через 12 месяцев сохранялась на значениях выше референтных в 1,1 раза. ЛДГ в лимфоцитах периферической крови была в 3,3 раза выше референтных значений через 12 месяцев и в 1,4 раза в венозной крови через 12 месяцев. Такое повышение активации СДГ и ЛДГ может привести к усилению свободнорадикальных процессов, индукции апоптоза, потере жизнеспособности клеток, что следует учитывать при назначении препаратов, стимулирующих систему антиоксидантной защиты организма [23]. При анализе индивидуальных показателей активности СДГ и ЛДГ в лимфоцитах периферической крови наблюдалась такая же закономерность. Подобные изменения показателей активности ферментов энергетического обмена в лимфоцитах были выявлены: у 4 пациентов из 10 с признаками ОП в возрасте от 18 до 39 лет, у 5 из 12 в возрасте 40–59 лет и у 31 из 59 в возрасте 60 лет и старше. Положительная корреляционная связь была установлена между повышением активности ЛДГ в лимфоцитах периферической крови и в сыворотке крови (r = 0,581859 при p < 0,005), что подтверждает диагностическую ценность цитобиохимического метода и позволяет применять данный метод в качестве маркера выраженности энергетического кризиса у пациентов с ОП.
Заключение
Нарушения активности ферментов энергетического обмена у пациентов всех возрастных групп и прогрессирующее их истощение, особенно в группе пациентов в возрасте от 60 лет и старше, указывают на дефицит внутриклеточной энергии в лимфоцитах периферической крови.
Изучение в динамике цитобиохимическим методом ферментов энергетического обмена в лимфоцитах периферической крови может предположительно выступать в качестве предикторов перехода организующейся пневмонии в фиброз легких, что позволит дифференцированно подходить к лечению пациентов в постковидном периоде.
Особенно это важно для лиц молодого возраста, у которых отсутствовали через 12 месяцев клинико-функциональные проявления патологии органов дыхания, но сохранялись признаки организующейся пневмонии при компьютерной томографии, что повышало угрозу формирования у них фиброза легких.
Внедрение ЦБХ метода в практическое здравоохранение позволит малоинвазивным и недорогостоящим методом контролировать эффективность реабилитационных мероприятий.
С учетом установленных особенностей нарушений энергетического баланса в лимфоцитах периферической крови следует индивидуально подходить к назначению терапии иммунотропными, противовирусными и антиоксидантными препаратами, что позволит повысить эффективность проводимой терапии.
Авторы заявляют об отсутствии конфликта интересов.
Конфликт интересов
Финансирование
Библиографическая ссылка
Косякова Н.И., Акуленко М.В., Прохоренко И.Р. ОСОБЕННОСТИ НАРУШЕНИЯ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА У ПАЦИЕНТОВ РАЗНЫХ ВОЗРАСТНЫХ ГРУПП С ОРГАНИЗУЮЩЕЙСЯ ПНЕВМОНИЕЙ В ПОСТКОВИДНОМ ПЕРИОДЕ // Международный журнал прикладных и фундаментальных исследований. 2025. № 10. С. 11-17;URL: https://applied-research.ru/ru/article/view?id=13760 (дата обращения: 13.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13760

