Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам.
В группу часто болеющих детей (ЧБД) входят на том или ином возрастном этапе от 15 до 75 % детской популяции, в связи с чем,частые респираторные заболевания является актуальной проблемой педиатрии. К категории ЧБД относят детей, страдающих повторными острыми респираторными заболеваниями (ОРЗ) свыше 4–6 раз в год, имеющих инфекционный индекс от 1,1 до 3,5. Среди всей популяции ЧБД выделяют категорию ложно болеющих с индексом резистентности от 0,3 до 0,49, а к категории истинно часто болеющих детей, относят часто болеющих детей при индексе резистентности 0,5 и выше [1-4].
Система иммунитета в детском возрасте характеризуется относительно пониженным уровнем нейтрофилов основных эффекторных клеток естественного (врожденного) звена иммунного ответа и низкой продукцией иммуноглобулинов на фоне повышенного числа Т- и В-лимфоцитов, что свидетельствует о неполноценности адаптивного (приобретенного) звена, а в совокупности с анатомо-физиологическими особенностями органов дыхания, недостаточными гигиеническими навыками и значительным контактом с окружающим миром делает детей дошкольного возраста особенно уязвимыми для инфекций [5, 6].
После перенесенного эпизода ОРЗ дисбиотические изменения микрофлоры зева сохраняются до 1,5 месяцев. Вирусы являются этиологическими агентами более чем в 80 % случаев ОРЗ для их лечения даже при неосложнённом течении, используются антибактериальные (АБ) препараты, что способствует усугублению дисбиоза. 35 % детей, относящихся к группе ЧБД, имеют хроническую ЛОР патологию. Не менее, чем в 30 % случаев, ЧБД являются носителями β-гемолитического стрептококка группы А, а 50 % детей являются носителями золотистого стафилококка [11, 12].
Введение интерферона 1 типа в экспериментальных исследованиях сокращало сроки персистенции золотистого стафилококка и количество персистирующих бактерий, способствуя нормализации показателей иммунного статуса, повышая выживаемость животных при стафилококковой инфекции. Иммуномодулирующий эффект интерферона II типа ещё более выражен,γ-интерферон активно стимулирует макрофаги, усиливает экспрессию молекул МНС I и II, стимулирует дифференцировку Т-хелперов нулевого типа в Т-хелперы первого типа.
В связи с этим, нами выбран метилглюкаминакридоноацетат- ранний индуктор смешанного (Th1/Th2) типа иммунного ответа, увеличивающий функциональную активность фагоцитирующих клеток и обеспечивающий их бактерицидность[2, 4, 5].
Напомним механизм действия препарата, описанный нами ранее[1].
Циклоферон как индуктор интерферонов. Продукция эндогенного интерферона под воздействием циклоферона обусловлена наличием чувствительных клеточных систем, способных синтезировать интерферон в ответ на индуктор.Иммунокомпетентные клетки (моноциты, лимфоциты, макрофаги, купферовские клетки печени) способны индуцировать интерферон. Циклоферон индуцирует ранний интерферон.
Циклоферон как регулятор цитокинов. При воздействии циклоферона индуцируется целый каскад сигналов, которые задействуют «цитокиновую сеть» организма. Известно, что характер иммунного ответа зависит от доминирующего участия CD4 + клеток Th1- и 2-го типа, которые различаются по продуцируемым цитокинам, стимулируя развитие иммунного ответа по клеточному или гуморальному типу. Активация Th1, продуцирующих ИФН-g, ИЛ-2 и ФНО-a ведет к развитию иммунного ответа по клеточному типу, который играет решающую роль в противовирусной защите. В активации Th1 цитокинов принимает участие ИФН-a, синтезируемый в ранней фазе вирусной инфекции, а при действии циклоферона отмечена способность индуцировать не только повышенную экспрессию ИЛ-12, но и переключать Th0 с синтеза Th2-цитокинов на Th1-ответ.
Одним из важных направлений формирования полноценного иммунного ответа является регуляция синтеза ИФН-g. Продукция ИФН-γTh1 осуществляется благодаря стимуляции ИЛ-12, ИЛ-2 и ФНО-a, а ИЛ-18, являясь потенциальным индуктором синтеза ИФН-g, выступает в роли синергиста ИЛ-12 и оба этих цитокина лидируют в быстрой активации моноцит/макрофагальной системы посредством стимуляции выработки ИФН-g, который также стимулируется при действии циклоферона.
Иммунотропная активность циклоферона. В основе развития иммунного дисбаланса лежат функциональная клеточная блокада (блокада рецепторов и механизмов передачи сигналов); дисбаланс клеточных субпопуляций – хелперов Th1/Th2, супрессоров/цитотоксических лимфоцитов, хелперов/эффекторов и другие. В экспериментальных исследованиях циклоферон индуцировал в линии клеток К562 иммунного происхождения синтез мРНКинтерферона-гамма и IL-2, а также IL-1 и IL-6 (представители гуморального Th-2 типа иммунитета). При этом, циклоферон не индуцирует мРНК цитокинов в линиях клеток неиммунного происхождения (MG-63), что свидетельствует о высокой тропности циклоферона к клеткам иммунной системы.Введение циклоферона приводит к существенным изменениям в составе субпопуляций лимфоцитов (повышается относительное и абсолютное число исходно сниженных общих Т-лимфоцитов (СD3 +), Т-хелперов (СD4 +), иммунорегуляторного индекса и естественных киллеров (СD16 +); снижение СD8 + и СD72 + – лимфоцитов). Повышается уровень иммуноглобулина А (IgA) при одновременном снижении концентрации иммуноглобулина Е (IgE). Циклоферон увеличивает провоспалительный потенциал нейтрофилов периферической крови, а также функциональную активность фагоцитирующих клеток за счет генерации активных форм кислорода, обеспечивая бактерицидность клеток.
Циклоферон как стимулятор образования дефект-интерферирующих вирусных частиц. В ряде случаев размножение вирусов подавляется дефектными частицами, которые известны как дефект-интерферирующие частицы (ДИ-частицы). ДИ-частицы препятствуют нормальной репродукции вируса, что ведет к подавлению его цитоцидного действия. Накопление достаточного количества ДИ-частиц в инфицированном организме приводит к самоограничению инфекции, при этом, дефектные частицы сохраняют цитокин- и интерферон (ИФН)-индуцирующие свойства, стимулируя неспецифический иммунитет.
Противовирусная активность циклоферона. Циклоферон оказывает непосредственное противовирусное действие, восстанавливает способность лейкоцитов крови к синтезу интерферона, подавляет проникновение вирусной частицы в клетку путем ингибирования синтеза мРНК и трансляции вирусных белков, а также через блокирование процессов сборки вирусной частицы и ее выхода из инфицированной клетки. В результате связывания молекулы интерферона с интерфероновыми рецепторами на поверхности клеток происходит активация генов, локализованных в 21 хромосоме у человека. Этот процесс сопровождается формированием более 20 новых внутриклеточных белков, способствующих возникновению резистентности к вирусам. Данные белки отсутствуют в клетках, не подвергшихся воздействию интерферона. К этим белкам относят фермент А-синтетазу, осуществляет расщепление мРНК путем подавления удлинения полипептидных цепей. Также под действием данного фермента продуцируются олигомеры адениловой кислоты, которые блокируют синтез вирусных белков, что приводит к нарушению трансляции с вирусной РНК.
Вышесказанное, определило цель исследования – установить способность меглюминакридонацетата (циклоферона) индуктора раннего эндогенного интерферона смешанного типа влиять на микробиологический пейзаж поверхности миндалин часто болеющих детей.
Материалы и методы исследования
Под наблюдением находилось 16151 детей дошкольного и школьного возраста, которым в период повышенного сезонного подъема респираторной заболеваемости была проведена экстренная неспецифическая профилактика повторных ОРЗ (эпидемиологическое исследование).Препарат назначался детям в соответствии с указаниями инструкции по медицинскому применению.
Также в сезон 2010/11 года наблюдали 68 детей (32 девочки и 36 мальчиков) в возрасте от 4 до 7 лет, медиана (Ме) – 5,1 лет, нижняя квартиль (Q25) – 4,5 года, верхняя квартиль (Q75) – 5,8 лет, посещающих специализированные детские сады (№ 94 и № 95) для часто болеющих детей.
При получении информированного согласия от законных представителей ребенка, отсутствии острых инфекционных заболеваний, наличии в анамнезе 6-и и более эпизодов ОРЗ за последний год, ребенок включался в протокол врачебного наблюдения.
Препарат циклоферон (таблетки по 150 мг) назначали двумя курсами (с перерывом в 1 месяц) 10 мг/кг массы тела, согласно инструкции по медицинскому применению препарата. Двукратно, до начала приема препарата и через 2 недели после окончания приема, выполнили посев микрофлоры с поверхности миндалин. Материал – слизь с поверхности миндалин – брали стерильными ватными тампонами натощак и помещали в универсальную гелевую транспортную среду Стюарта фирмы Copan (Италия). В течение 2 часов полученный материал доставлялся в лабораторию. Для идентификации микрофлоры и определения её чувствительности к антибактериальным препаратам была использована автоматизированная система VITEC-2 фирмы Bio Merieux (Франция).Тестирование чувствительности к антибактериальным препаратам осуществлялось методом минимальных ингибирующих концентраций [8, 9].
Статистический анализ проводился с использованием стандартного пакета прикладных программ Statistica версия 6.0. При сравнении двух независимых групп изучаемой переменной использовали тест Манна-Уитни (U), в случае зависимости групп – тест Вилкоксона (Z). При сравнении долей (процентов) использовался метод Фишера. Нулевая гипотеза об отсутствии различий между переменными отвергалась на уровне значимости α = 0,05 (p £ 0,05) для каждого из использованных тестов. Для представления результатов статистической обработки использовали величины медианы (Me), верхней (Q75) и нижней квартилей (Q25) в формате Me (Q25-Q75).
Результаты исследования и их обсуждение
В раннее проведенных исследованиях[2] нами показано, что циклоферон используется как средство неспецифической профилактики ОРЗ/ОРВИ и гриппа у детей во время эпидемического подъема заболеваемости. Под наблюдением находилось 16151 человек, из них 9299 получали препарат, а 6852 – плацебо (дети в возрасте от 10 до 16 лет). Кроме этого выборка в 1255 детей включала возраст от 7 до 10 лет. Препарат получали 524 ребенка, а 731 человек получали активное плацебо. 114 детей в возрасте от 4 до 7 лет получали циклоферон, в сравнении с ревитом. Индекс эффективности составил 2,9 (колебания от 2,4 до 3,4), показатель защиты 62,8 % (колебания от 58,5 до 67,1 %), снижение заболеваемости более чем в 2,9 раза. Установлена профилактическая эффективность препарата (снижение заболеваемости ОРЗ и гриппом наблюдалось в 2,9–7,2 раза для микст-инфекций респираторного тракта). Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат. Цитопротекторное действие, проявлялось снижением степени деструкции клеток эпителия, усилением в 4,5 раза активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Показано снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза) во вновь организованных коллективах, как у детей, так и у подростков. При проведении курса циклоферона наблюдалась смена структуры ОРЗ среди заболевших. Увеличивались легкие (в 4,3 и более раза), уменьшались тяжелые и осложненные формы заболеваний, число заболевших, получавших циклоферон составило 6 %. Наблюдалось легкое течение ОРЗ, число пропущенных дней по болезни (в пересчете на 1 ребенка) составило 4,8 дня. Среди детей, не получавших средств неспецифической профилактики, уровень заболеваемости составил 58 %, при заболеваемости в 19 % у детей, получавших гриппол. Наблюдая 116 детей в возрасте до 14 лет с неосложненным и осложненным (со стороны ЛОР-органов) течением ОРВИ, установлено, что в 95,7 % случаев заболевание начиналось с лихорадки, симптомов интоксикации, проявляющихся вялостью, адинамичностью, бледностью кожных покровов, головной болью, судорожным синдромом, рвотой. У 17 детей выявлен бронхит, а при отоларингологическом осмотре выделены наблюдавшиеся группы детей: 1-я – ОРВИ с превалированием клиники ринофарингита; 2-я – с наличием острого катарального среднего отита (ОКСО); 3-я – острого гнойного среднего отита (ОГСО); 4-я – острого катарального синусита (ОКС) и 5-я – острого гнойного синусита (ОГС). Вирусная этиология ОРВИ из 116 обследованных детей, была подтверждена в 74,1 % случаев.
Оценка неспецифической резистентности слизистой оболочки, изучена по показателям фагоцитарной активности, фагоцитарного числа, степени завершенности фагоцитоза (на слизистой ротоглотки и в крови), также оценивался уровень SigА. Выявлено снижение фагоцитарной активности нейтрофилов (ФА) и фагоцитарного числа (ФЧ) относительно нормы в начале заболевания, но степень снижения была различна. В группе больных гриппом А показатели достоверно ниже, чем в группе сравнения. Активность фагоцитов падает более чем в 2 раза от нормы как в крови, так и на слизистых оболочках. При выявлении катарального отита или синусита на фоне гриппа А, ФА и ФЧ на слизистых выше, чем в крови. При парагриппозной инфекции эти процессы активированы в крови. ОГСО сопровождается теми же изменениями, но в меньшей степени выраженности. ОГС при парагриппе протекает с высокой активностью фагоцитоза в крови.
Основная функция моноцитов-макрофагов киллинг микроба, оценивалась в НСТ-тесте. Выявлено, что у детей с гриппом А как при осложненном, так и при неосложненном течении, резервы для киллинга бактерий (НСТин./НСТсп.) снижены и составляют 1,4 ± 0,1, а при парагриппе – резервы выше (1,7 ± 0,1, р < 0,05). Функции секреторного IgА (SIgА) – нарушение процессов адгезии микроорганизмов; бактерицидная и антивирусная активность при совместном действии с лизоцимом; регуляция иммунного ответа путем усиления антибактериальной активности фагоцитов. Уровень SIgА, определяемого в смывах ротоглотки, исходно ниже при гриппозной инфекции. У детей низкая местная активация нейтрофилов и низкое содержание SIgА, наблюдаемые при гриппе А, способствуют угнетению процессов фагоцитоза. У детей с парагриппом угнетенный фагоцитоз на слизистой компенсирует высокий уровень SIgА.
В мазках из зева, полученных до лечения, у наблюдаемых нами 68 детей, относящихся к часто болеющим, выделены представители 25 семейств, родов и видов микроорганизмов, но наиболее частой находкой явился золотистый стафилококк, обнаруживаемый в титрах 1∙104–1∙106 у половины обследованных детей. У 44 детей (64,71 %) идентифицирована 1 культура, у 14 (20,58 %) – 2, у 9 (13,24 %) – 3, у 1 (1,47 %) – 4 культуры бактерий. При повторном обследовании спектр микроорганизмов значительно сузился, обнаружены представители только 16 семейств, родов и видов микроорганизмов, как и при первом исследовании, золотистый стафилококк выявлялся у половины обследованных, но в более низких титрах (рисунок). У 11 детей (25,58 %) рост бактерий отсутствовал, у 24 детей (55,81 %) идентифицирована 1 культура, у 6 (13,96 %) – 2, у 2 (13,96 %) – 3 культуры бактерий.
При анализе чувствительности к антибиотикам золотистого стафилококка, высеянного с поверхности миндалин, при повторном исследовании установлено уменьшение доли метициллин-, рифампицин-, эритромицин-, тетрациклин резистентных штаммов и достоверное снижение процента штаммов устойчивых к бензилпенициллинам, по сравнению с исходными показателями.
На фоне приема циклоферона изменилась не только обсемененность поверхности миндалин золотистым стафилококком, но и непатогенной микрофлорой. Среднее количество обнаруженных непатогенных видов бактерий и их титры были ниже (p < 0,05), чем до приема циклоферона (рисунок). Поскольку циклоферон не обладает прямой антибактериальной активностью, можно предположить, что снижение обсемененности и видового разнообразия микроорганизмов поверхности миндалин обусловлено не только иммунокорригирующими свойствами препарата, но и подавлением факторов персистенции бактерий с затруднением их паразитирования внутри клеток.
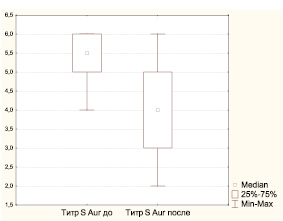
Динамика титра S. аureus у ЧБД, принимавших циклоферон
Ингибирование циклофероном персистентного потенциала внутриклеточных патогенов способствует их элиминации при острых и хронических инфекционных процессах [7].
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам.
Таким образом, препарат циклоферон можно рекомендовать к применению в составе комплексной терапии и для реабилитации часто и длительно болеющих детей.
Выводы
Установлена профилактическая эффективность препарата (снижение заболеваемости ОРЗ и гриппом наблюдалось в 2,9–7,2 раза для микст-инфекций респираторного тракта). Индекс эффективности составил 2,9 (колебания от 2,4 до 3,4), показатель защиты 62,8 % (колебания от 58,5 до 67,1 %), снижение заболеваемости более чем в 2,9 раза.
Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат. Цитопротекторное действие, проявлялось снижением степени деструкции клеток эпителия, усилением в 4,5 раза активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Показано снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза) во вновь организованных коллективах, как у детей, так и у подростков.
Прием препарата снижает видовое разнообразие микрофлоры поверхности миндалин, уменьшает обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком, приводит к значимому снижениюштаммов золотистого стафилококка, устойчивых к бензилпенициллинам.
Библиографическая ссылка
Ляликов С.С., Романцов М.Г., Бедин П.Г., Ермак С.Ю., Янович Р.В. КОРРЕКЦИЯ ЦИКЛОФЕРОНОМ НАРУШЕНИЙ МИКРОФЛОРЫ МИНДАЛИН В ГРУППЕ ДЕТЕЙ С ПОВТОРНЫМИ РЕСПИРАТОРНЫМИ ЗАБОЛЕВАНИЯМИ // Международный журнал прикладных и фундаментальных исследований. 2013. № 10-3. С. 391-396;URL: https://applied-research.ru/ru/article/view?id=4215 (дата обращения: 22.02.2026).

