В отечественной и зарубежной литературе дискутируются вопросы оптимизации хирургического лечения переломов костей и их последствий для сокращения сроков нетрудоспособности пациентов и повышения качества жизни. Совершенствование систем компрессионно-дистракционных аппаратов, конструкций для остеосинтеза, эндопротезирования неизбежно имеет пределы, обусловленные биологическими свойствами тканей, которым они призваны обеспечить оптимальную регенерацию. Клинические наблюдения показывают, что перспективы улучшения результатов лечения переломов и ложных суставов только за счет совершенствования соединения и удержания отломков в основном, исчерпаны [1]. Для повышения эффективности лечения необходимо внутриочагово предпринимать меры для стимуляции компрометированного остеогенеза. [2,7,8]. Анализ большого количества способов стимуляции репаративного процесса, в том числе с применением имплантационных материалов, свидетельствует о существенных различиях в принципах решения этой проблемы [3,8]. В последние годы в связи с бурным развитием клеточных и нанотехнологий активно исследуются методы воздействия на звенья репаративной костной регенерации с использованием стволовых мезенхимальных клеток и аутологичного костного мозга. Однако эти перспективные методы воздействия на остеогенез в настоящее время либо находятся в стадии изучения, либо малодоступны из-за технической сложности [4, 5, 6, 9,1 0].
Цель исследования. Экспериментальная оценка эффективности механических и гидродинамических воздействий на костную ткань и костный мозг в зоне перелома при стимуляции процессов заживления костной раны.
Материалы и методы исследования
Объектом исследования явились 24 экспериментальных животных (кролика), в возрасте 6-7 месяцев, с массой тела 3,3 – 4,5 кг. Нами выбрана хорошо зарекомендовавшая себя модель и опыт эксперимента с использованием чрескостного остеосинтеза аппаратом внешней фиксации на голени животного. Были изготовлены облегченные модели аппарата Илизарова. Подготовка животных к эксперименту соответствовала санитарным нормам содержания животных в вивариях («Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденные Главным Государственным санитарным врачом №1045-73 от 06.04.1973 г.).
В асептических условиях операционной вивария опыты выполнялись под комбинированным наркозом (р-р Золетила из расчёта 7 мг/кг массы тела совместно с 2 %-м р-ром Ксилазина из расчёта 1-3 мг/кг массы тела). Техника оперативных вмешательств заключалась в следующем: на конечность надевали в собранном виде аппарат Илизарова, включающий четыре кольца из сплавов алюминия (вес в собранном виде составляет 190 г., то есть 5 % от массы тела животного).
Проксимальное кольцо располагали на уровне бугристости большеберцовой кости, проксимальное промежуточное – отступя 3 см, дистальное промежуточное – на 3 см ниже синостозирования берцовых костей и дистальное – на 0,5 см выше скакательного сустава. В плоскости поперечного сечения проксимального кольца перпендикулярно большеберцовой кости в метафиз проводили две перекрещивающиеся спицы диаметром 0,8 мм и фиксировали в натянутом положении к кольцу. Дистальную пару перекрещивающихся спиц под углом 30-45° проводили в метафизарной зоне, на 6 мм проксимальнее дистального конца большеберцовой кости и с натяжением закрепляли в дистальной базовой опоре аппарата, а дистальная промежуточная спица проходила во фронтальной плоскости на 2,5 см проксимальнее. Затем во фронтальной плоскости проводили 2 промежуточные спицы и с натяжением фиксировали их к проксимальному и дистальному промежуточным кольцам. В месте синостозирования малоберцовой и большеберцовой костей (в средней трети голени) тонким сверлом производили веерообразное сверление большеберцовой кости на протяжении 1 см с последующей её остеоклазией. Промежуточные спицы располагали на расстоянии 1,8 и 2,4 см от концов проксимального и дистального фрагментов.
Затем производили один из трех видов стимулирующего воздействия на репаративный процесс, в зависимости от которых определены группы эксперимента.
У животных 1-й группы (контрольной) дополнительных воздействий на зону перелома не осуществляли. Кроликам 2-й группы выполняли туннелизацию проксимального и дистального отломков в двух плоскостях на расстоянии 5 мм от линии перелома. В 3-й экспериментальной группе производили гидродинамическое воздействие на костномозговое содержимое, путём вытеснения последнего под давлением жидкостью (3 мл) через иглу, введённую в проксимальный метадиафиз большеберцовой кости. После операции выполняли контрольную рентгенографию костей голени, и кролика помещали в клетку вивария.
Для изучения гистологической, гистохимической и цитологической картины в процессе заживления костной раны животных выводили из эксперимента на сроках 1, 2 и 3 недели после операции. Забой животных производили быстрым внутриплевральным введением летальной дозы тиопентала натрия. Материал для морфологического исследования помещали в 10 %-й раствор нейтрального формалина для фиксации с последующей проводкой материала, изготовлением препаратов, их гистологической и гистохимической окраской, с последующим изучением, описанием и микросъёмкой. Использовали микроскоп Olympus CX-31 c видеонасадкой «VIDI-CAM».
Результаты исследования и их обсуждение
В первой группе эксперимента через 3 недели после операции рентгенологически концы отломков имели нечёткие контуры. В большинстве случаев формировались массивные периостальные костные разрастания средней плотности, муфтообразно окружающие линию перелома. В области костномозговых полостей, вблизи линии перелома в дистальном и проксимальном фрагментах, определялись слабые тени эндостального регенерата. Перестройка костной ткани была завершена не полностью. Гистологическая и гистохимическая картина в основном веществе первой экспериментальной группы характеризовалась интенсивными процессами формирования и перестройки костного регенерата. Видна массивная периостальная костная мозоль с новообразованными костными балками, заполнением межбалочного пространства коллагеновым матриксом и остеобластами на разных этапах дифференцировки. В красном костном мозге отмечались опустошение, уменьшение количества кроветворных островков, ячеистость структуры элементов жировой ткани, очаги разрастания элементов соединительной ткани, неравномерное полнокровие с признаками плазмостаза в отдельных сосудах.
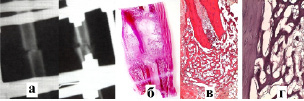
Рис. 1. Рентгенограммы (а) и гистотопограммы (б) сформированного костного регенерата через 3 недели после операции у животного 1-й группы; (в) сформированный остеоид (окр. г-э., ув.×40); (г) неравномерность окраски, высокий уровень обменных процессов в компактном веществе, обменные нарушения в эндосте (окр. г-э., ув.×400)
У животных второй экспериментальной группы через 3 недели после операции на рентгенограммах костей голени линия перелома прослеживалась неотчётливо, контуры концов отломков становились менее чёткими, сглаженными в сравнении с послеоперационной картиной, местами не определялись. Очаги просветления после туннелизации были размытые, с нечёткими контурами. К этому сроку межотломковую щель перекрывали тени разной интенсивности. Периостальные наслоения находились в стадии компактизации. Тени эндостального регенерата были ярко выражены.
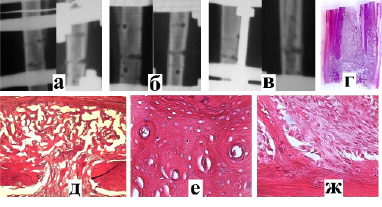
Рис. 2. Рентгенологическая картина заживления перелома во 2-й группе через 1 неделю (а), 2 недели (б) и 3 недели (в) после операции; г) гистотопограмма и д) гистологическая картина (окр. альц.синь., ув.×40) сформированного костного регенерата; е) дистальный фрагмент перелома, компактное вещество (окр. г-э., ув.×400): полиморфность остеонов, чёткая структура клеточных элементов; ж) компактное вещество и остеоид (окр. г-э., ув.×400): формирующиеся костные балочки, остеогенные клетки на разных этапах дифференцировки
Морфологическая картина через 1 неделю после операции в основном веществе характеризовалась выраженным полнокровием сосудов и равномерным их ходом. Все структуры отличались нормохромностью. Метаболические показатели соответствовали норме. В периосте формировались костные балочки с хорошим метаболизмом. Межбалочное пространство содержало остеогенные клетки на разных этапах дифференцировки. Происходило формирование нежного коллагенового матрикса. Через 2 недели отмечалась полиморфность остеонов с чёткой структурой клеточных элементов, основных и вставочных пластин: присутствовали как молодые остеоны с начинающим формироваться каналом, так и зрелые остеоны. Через 3 недели межотломковый диастаз полностью был заполнен костным регенератом. Наблюдалась дальнейшая перестройка регенерата.
В третьей группе эксперимента к 21 дню после операции рентгенологически отмечалась неровная, с нечётким контуром линия перелома, структура диафиза большеберцовой кости в области перелома была неоднородна за счёт участков уплотнения в проекции костномозговых полостей. Видны лишь элементы периостальной реакции, муфтообразно окружающей линию перелома. Перестройка костной ткани была не завершена, дифференцировка структуры не наступила.
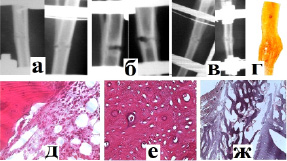
Рис. 3. Рентгенологическая картина заживления перелома в 3 группе эксперимента через 1 неделю (а), 2 недели (б) и 3 недели (в) после операции; г) гистотопограмма костного регенерата; (д) эндост (окр. г-э., ув.×400): истончение костных балок, опустошение красного костного мозга, с замещением его жировой тканью; е) в компактном веществе: полиморфизм гаверсовых каналов, уплотнение структур, базофилия; ж) граница компактного вещества и периоста (окр. г-э., ув.×100): островки новообразованной костной ткани
Гистологическая картина через 1 неделю после операции отражала резкое истончение костных балок, признаки опустошения красного костного мозга, с замещением его жировой тканью. Через 2 недели отмечался полиморфизм гаверсовых каналов с уплотнением их стенки, уплотнением границ основных и вставочных пластин, базофилия. Местами отмечалось отсутствие вставочных структур. Все эти изменения свидетельствовали о нарушении кровообращения и обменных процессов в зоне перелома. На сроке 3 недели наблюдалось формирование островков новообразованной костной ткани. Преобладали молодые элементы костной ткани, имелись сформированные остеогенные островки.
Выводы. Таким образом, обобщив данные морфологического исследования и рентгенографии, наилучшие результаты отмечены нами во второй экспериментальной группе, в которой в качестве метода стимуляции регенерации костной ткани использовалась туннелизация фрагментов экспериментального перелома. Механическое раздражение в зоне перелома, с формированием поперечных каналов, способствует притоку крови к этой зоне, улучшению оксигенации и микроциркуляции.
Известно, что дифференцировка клеток в направлении остеогенеза тесно связана с ангиогенезом. В зонах с достаточным парциальным давлением кислорода происходит образование остеобластов и остеоцитов, снижение же содержания кислорода, гипоксия, ацидоз ведёт к формированию хрящевой ткани. Использование для стимуляции остеогенеза искусственного гидродинамического воздействия на содержимое костномозгового канала с вытеснением его в зону перелома (третья группа) показало худшие результаты вследствие опустошения красного костного мозга и замещения последнего жировой тканью, а также расстройства микроциркуляции и гипоксии.
Библиографическая ссылка
Барабаш Ю.А., Богомолова Н.В., Кауц О.А., Барабаш А.П., Матвеева О.В., Русанов А.Г., Балаян В.Д. ОЦЕНКА СТИМУЛЯЦИИ ЗАЖИВЛЕНИЯ ПЕРЕЛОМА ПРИ ХИРУРГИЧЕСКОМ И ГИДРОДИНАМИЧЕСКОМ ВОЗДЕЙСТВИИ НА КОНЦЫ ОТЛОМКОВ И КОСТНОМОЗГОВОЕ СОДЕРЖИМОЕ // Международный журнал прикладных и фундаментальных исследований. 2014. № 9-2. С. 58-61;URL: https://applied-research.ru/ru/article/view?id=5831 (дата обращения: 07.03.2026).

