После внедрения во второй половине прошлого века в стоматологическую практику титановых имплантатов диапазон показаний для их клинического применения непрерывно расширяется, но пока не охватил собой всех потенциальных пациентов. Тем не менее, дентальная имплантация приобрела статус самой современной и модной технологии замещения утраченных зубов [6, 11]. Более того, становится очевидным, что замена отсутствующих зубов путем иных традиционных технологий не выдерживает конкуренции. Поэтому стратегия развития стоматологических технологий замещения утраченных зубов не мыслима без дентальной имплантации [6, 8].
К сегодняшнему дню детально разработано несколько технологий дентальной имплантации для замещения отсутствующих зубов на верхней и нижней челюсти при различных клинических ситуациях, но, к сожалению, не при всех. В частности, не достаточно совершенными остаются технологии дентальной имплантации при выраженной атрофии кости и мягких тканей челюсти [8]. Дело в том, что установка имплантатов в «тонкую» челюсть при дефиците кости и/или мягких тканей, покрывающих ее, не обеспечивает достаточную прочность и надежность фиксации имплантатов. Поэтому для повышения качества дентальной имплантации предварительно необходимо увеличить объем кости челюсти до «нужного» размера.
Для увеличения объема тканей ранее традиционно проводились сложные хирургические операции, включающие пересадку кости, либо иных специальных материалов. Причем, до последнего времени в трансплантологии отсутствовали технологии и материалы, гарантирующие приживление трансплантатов и регенерацию костей в присутствии таких инородных тел, как металлические имплантаты (представляющие собой по сути дела толстые металлические шурупы). Более того, общепринятые технологии трансплантации тканей допускали высокую вероятность их отторжения, появление которого ожидалось каждый день на протяжении нескольких месяцев и лет после пересадки. Поэтому сложившиеся технологии трансплантации тканей в медицине были ориентированы на тревожное многомесячное ожидание скорее отторжения, чем приживления пересаженных тканей [9].
Тем не менее, в последние годы лидеры хирургической стоматологии смогли перевернуть общепринятые представления в трансплантологии, продемонстрировав возможность получения гарантированного приживления трансплантатов и имплантатов при однократном оказании стоматологической помощи пациентам в условиях обычной стоматологической клиники [6, 8, 11]. Достигнуть такого поразительного результата во многом удалось благодаря разработке новых биоматериалов и хирургических технологий, которые обеспечивают высокую приживаемость пересаженных биоматериалов и интенсивность регенерации кости до «нужного» размера, надежность дентальной трансплантации и имплантации. Особую роль в достигнутом успехе сыграли ксеногенные коллагенсодержащие биоматериалы, производимые компанией OsteoBiol® [7].
Результаты многолетнего клинического применения этих материалов свидетельствуют об очень высокой их биосовместимости, надежности приживления и способности вызывать регенерацию и реконструкцию кости при дентальной имплантации в самых востребованных клинических ситуациях [7]. Практика показала, что ассортимент указанных биоматериалов достаточно широк и разнообразен. В целом он отвечает потребностям клиники. Однако известные хирургические технологии не обеспечивают их эффективное применение для расширения показаний к срочной дентальной имплантации у пациентов с выраженной атрофией твердых и мягких тканей челюсти [6, 8, 11].
В связи с этим для эффективной и безопасной дентальной трансплантации биоматериалов с целью срочной имплантации титановых имплантатов пациентам с выраженной атрофией тканей челюстей требуются разработки новых хирургических технологий трансплантации биоматериалов.
Цель исследования – разработка инновационных способов трансплантации биоматериалов в области челюсти с целью повышения скорости и качества дентальной имплантации.
Материалы и методы исследования
Исследование основано на результатах хирургических операций, которые были осуществлены в 2003–2012 годах у 1100 мужчин и женщин в возрасте от 22 до 74 лет в стоматологической клинике «РеСто» города Ижевска. Анализировались особенности выполнения операций дентальной трансплантации и имплантации у пациентов с дефицитом твердых и/или мягких тканей в верхних и/или в нижних челюстях. В период с 2003 по 2007 для трансплантации применялись аутогенные трансплантаты, полученные из донорских областей самих пациентов (подбородок, область наружной косой линии, ветвь нижней челюсти, бугор верхней челюсти, гребень подвздошной кости, большеберцовая кость, венозная кровь), а также различные ксеногенные биоматериалы нескольких различных производителей, за исключением материалов компании OsteoBiol®. В период с 2008 по 2012 г. для трансплантации применялись костно-пластические ксеногенные биоматериалы компании OsteoBiol®. При этом для существенного увеличения объема кости использовался материал «mp3» (гетерологичная кортикально-губчатая предварительно увлаженная коллагенсодержащая костная смесь с размером гранул 600–1000 мкм), препарат «Genos» (кортикально-губчатая коллагенсодержащая костная смесь с размером гранул 250–1000 мкм) и препарат «Evolution» (гетерологичный перикард) [7].
У всех пациентов при имплантации применялись имплантаты марки Nobel Biocare® модели Replace Select соответствующих («нужных») размеров. Имплантаты устанавливались в верхние и нижние челюсти по стандартным технологиям [11].
Хирургические операции были проведены в амбулаторных условиях под местной анестезией, которая достигалась применением анестетиков амидного ряда. Оценка функционального состояния пациентов и предоперационная подготовка их к хирургической операции проведена в соответствии с соответствующими стандартами оказания стоматологической помощи. Планирование и оценка результатов операций дентальной трансплантации и имплантации осуществлялись с применением рентгеновского и инфракрасного метода диагностики. Рентгенографическое и рентгеноскопическое исследование проведено с помощью ортопантомографа марки «Planmeca Prolane EC» с системой «Dimax 3» и визиографа марки «Planmeca Infra», соединенных с помощью оптоволоконного кабеля с монитором индивидуального компьютера, экран которого находился над стоматологическим креслом у изголовья пациента. Инфракрасная диагностика проведена с помощью тепловизора марки TH91XX (NЕC, США) в диапазоне температуры 26–37 °С в помещении стоматологической клиники с температурой воздуха 24–25 °C [2, 5, 10]. Данные, полученные при инфракрасной термографии, были обработаны с помощью программного обеспечения Термографии Explorer и Image Processor. При этом оценивалась локализация отсутствующего зуба, дефекта твердых и/или мягких тканей челюсти, степень деформации альвеолярных гребней, степень локальной гипертермии.
В соответствии с общепринятыми стандартами оказания амбулаторной помощи и с учетом объема осуществленной операции в послеоперационном периоде пациентам назначали антибиотики, десенсибилизирующие и обезболивающие лекарственные средства. Период наблюдения за состоянием здоровья пациентов продолжался на протяжении 2-х лет после установки имплантатов.
При анализе результатов все пациенты были разделены на несколько групп. Первая группа состояла из 250 пациентов, у которых операции производились в период с 2003 по 2007 без применения биоматериалов компании OsteoBiol®. Из них у 90 пациентов хирургическая операция была осуществлена в области нижней челюсти, у 105 – в области верхней челюсти и у 55 пациентов – в области обеих челюстей. Вторая группа состояла из 850 пациентов, которым операции были проведены в период с 2008 по 2012 год с трансплантацией биоматериалов компании OsteoBiol®. Из них у 323 пациентов операция дентальной трансплантации и имплантации была осуществлена в области нижней челюсти, у 357 – в области верхней челюсти и у 170 пациентов – в области обеих челюстей.
При этом у 307 пациентов отсутствовали жевательные зубы в верхней челюсти и в ней имелась атрофия костной ткани, приведшая к уменьшению расстояния от поверхности альвеолярного гребня верхней челюсти до дна гайморовой пазухи менее 5 мм [8]. Этим пациентам перед имплантацией производилась костнопластическая операция открытого синус-лифтинга для поднятия дна верхнечелюстной пазухи в области отсутствующего зуба на «нужную» высоту. Всего произведено 379 операций синус-лифтинга. У 287 пациентов доступ к гайморовой пазухе формировали через окно в переднебоковой стенке кости верхней челюсти по известной технологии [6, 8], а у 20 пациентов – по оригинальной технологии [4].
При отсутствии у пациентов жевательных зубов в нижней челюсти и при наличии в ней выраженной атрофии твердых и мягких тканей дентальная трансплантация осуществлялась путем пластики с фиксацией трансплантационного материала «внакладку» и/или пластики с фиксацией материала внутри кости. Из этих пациентов нами выделена группа, состоящая из 25 человек, у которых с двух сторон нижней челюсти отсутствовало по 1 жевательному зубу. Одновременно с этим у них имелась выраженная симметричная атрофия твердых и мягких тканей. Через 4 месяца после двухсторонней дентальной трансплантации и одноэтапной имплантации раскрывались вживленные имплантаты, производилась ревизия качества произведенной хирургической имплантации и устанавливались коронки на имплантаты по общепринятой технологии [11]. Причем, в одной стороне челюсти перед установкой коронок вокруг раскрытого имплантата осуществлялась трансплантация биоматериала по оригинальной технологии, при которой сначала готовился трансплантат-трансформер в виде круга с дыркой посередине, а затем этот трансплантат одевался как юбка на вживленный имплантат [3].
Статистическая обработка результатов проведена с помощью статистической программы BIOSTAT на персональном компьютере Samsung NC 110 (China). Вычисляли среднюю арифметическую (M), ошибку средней арифметической (m), коэффициент достоверности (±). Степень различий показателей определяли в каждой серии по отношению к исходным показателям в контрольной серии. Разницу значений считали достоверной при Р ≤ 0,05.
План научного исследования был ранее одобрен этическим Комитетом Ижевской государственной медицинской академии Ижевска на основании принципов, которые изложены во Всемирной медицинской декларации в Хельсинках [12].
Результаты исследования и их обсуждение
Анализ полученных результатов позволил установить, что за 10 лет работы клиники в ней произошел определенный прогресс в оказании стоматологической помощи пациентам, однако сохранилось несколько нерешенных клинических проблем, которые оказались связанными с трансплантацией биоматериалов у пациентов, имеющих выраженную атрофию твердых и мягких тканей в челюстях. Дентальная трансплантация и имплантация были произведены в период 2003–2007 гг. – 250 пациентам и большинству из них пересаживались аутогенные биоматериалы, а в период 2008–2012 гг. – 850 пациентам и большинству из них пересаживались ксеногенные биоматериалы.
В частности, в период 2002–2007 гг. из 250 пациентов при осуществлении дентальной трансплантации из-за отсутствия в эти годы безальтернативных биоматериалов у 175 пациентов были применены аутогенные материалы (в основном, костные блоки), а у 75 пациентов – ксеногенные трансплантационные материалы. Синус-лифтинг с трансплантацией тканей для последующей установки имплантатов в боковые отделы верхней челюсти был применен у 160 пациентов. При этом было выполнено в общей сумме 180 операций синус-лифтингов. Продолжительность хирургической операции синус-лифтинга составила в эти годы в среднем 2,33 ± 0,12 часов (Р ≤ 0,05, n = 180). При этом значения этого показателя в отдельных операциях находились в диапазоне от 1,5 до 3,0 часов.
Показано, что самые сложные и продолжительные хирургические операции были выполнены у пациентов с отсутствием жевательных зубов в сочетании с чрезмерно выраженной атрофией кости в боковых отделах верхней челюсти. В частности, у 32 пациентов с атрофией кости в боковом отделе верхней челюсти высота альвеолярного гребня верхней челюсти составила менее 5 мм, поэтому в соответствии с общепринятыми рекомендациями этим пациентам первоначально осуществляли синус-лифтинг с трансплантацией биоматериала. Хирургическую операцию по установке имплантатов производили через 6–9 месяцев после трансплантации и подтверждения высокого качества костной регенерации в области отсутствующего зуба. Показано, что в указанные сроки после однократной трансплантации тканей дентальная имплантация была проведена только у 23 пациентов (то есть у 72 % пациентов). У 9 пациентов (то есть у 28 % пациентов) качество регенерации костной тканей после трансплантации было признано недостаточным, поэтому этим пациентам была выполнена повторная хирургическая операция синус-лифтинга с трансплантацией аутогенного биоматериала. При этом сама хирургическая операция дентальной имплантации длилась в среднем 1,46 ± 0,08 часов (Р ≤ 0,05, n = 32), причем, значения этого показателя во всех исследуемых операциях находились в диапазоне от 1,0 до 2,0 часов.
Проведенный нами анализ полученных результатов показал, что использование аутогенных материалов осложнялось, прежде всего, «кровавым» методом их получения. Дело в том, что для этого каждый пациент подвергался дополнительной хирургической операции, представляющей собой «само-добычу» трансплантата в совершенно здоровом части полости его рта. Для изъятия трансплантата использовались внутри ротовые источники пересаживаемых тканей. При выборе типа и места хирургического «забора» трансплантата учитывалось состояние здоровья пациента и нуждаемость в трансплантате. Во всех случаях хирургический путь получения трансплантата представлял собой травматическое воздействие, похожее на варварский способ добычи куска «мяса». Кроме этого, результаты проведенных нами рентгеновских исследований динамики структуры костных блоков, пересаженных во время синус-лифтинга, показали, что на протяжении практически 2-х месяцев после удачной пересадки они подвергались процессу атрофии. Истинная регенерация кости наступала позже и завершалась не ранее, чем через 6 месяцев после трансплантации.
В свою очередь, проведенный нами анализ результатов применения всевозможных ксеногенных биоматериалов (за исключением костно-пластических ксеногенных биоматериалов компании OsteoBiol®) выявил наличие у них такого существенного недостатка, как неготовность к пересадке. Дело в том, что все известные ксеногенные биоматериалы хранились в состоянии, которое обеспечивало им сохранность, но не гарантировало приживаемость при пересадке. Более того, для повышения приживаемости консервированных ксеногенных биоматериалов требовалось изменить их состояние при трансплантации. Для этого перемещенный в хирургическую рану ксеногенный биоматериал-консервант смачивали биологической жидкостью пациента, то есть с аутогенным материалом. Чаще всего с этой целью использовалась венозная кровь пациента. Причем, в 83 % случаев венозная кровь забиралась у пациентов из локтевых вен. Реже использовалась кровь, взятая из раневой поверхности пациента.
При этом традиционная технология смешивания ксеногенных материалов с аутогенной тканью (с кровью пациента) не отличалась высокой точностью, поскольку представляла собой смешивание «на глаз» и «как попало» (то есть без четких критериев готовности материала к пересадке), которое осуществлялось без контроля качества конечного продукта. Такая технология «доработки» биоматериала приводила к неконтролируемому изменению его свойств, включая степень приживаемости после пересадки. Поэтому не случайно, что успешное приживление такого биоматериала после его пересадки и вызванная им эффективная регенерация тканей до «нужного» объема были достигнуты только в 72 % хирургических операций.
Таким образом, в период 2003–2007 гг. дентальная трансплантация производилась в основном с пересадкой аутогенных биоматериалов (в основном костных блоков), которые вырезались из здоровых участков полости рта пациентов и успешно приживались у них после пересадки только в 72 % случаев. Поэтому каждая трансплантация сопровождалась «лишней» хирургической операцией, которая производилась для «добычи» биоматериала, а в каждом третьем случае пересаженный биоматериал не приживал и поэтому через несколько месяцев операция трансплантации проводилась повторно. При этом вновь вырезали биоматериал в здоровой части полости рта пациента и пересаживали биоптат. В свою очередь, у меньшей части пациентов применялись консервированные ксеногенные биоматериалы, которые в тот период времени поставлялись производителями неготовыми для пересадки. Поэтому трансплантация также не гарантировала успех. Все это снижало безопасность и эффективность хирургических операций и подрывало репутацию восстановления зубов методом дентальной имплантации.
В период 2008–2012 гг. операции дентальной трансплантации с имплантацией были произведены с пересадкой костно-пластических ксеногенных биоматериалов компании OsteoBiol® у 850 пациентов. В частности, для поднятия дна гайморовой пазухи, увеличения объема кости и увеличения высоты альвеолярного отростка кости верхней челюсти применялись материалы «mp3» и «Genos», а для прикрытия оголенной мембраны Шнейдера в костном «окне» верхней челюсти применялся материал «Evolution». При этом операция синус-лифтинга с трансплантацией биоматериалов была применена у 247 пациентов, у которых было выполнено 344 синус-лифтингов. При этом продолжительность операции синус-лифтинга составила в среднем 1,27 ± 0,06 часов (Р ≤ 0,05, n = 344), а значения этого показателя в отдельных операциях находились в диапазоне от 1,0 до 1,5 часов.
Результаты рентгеновского исследования показали, что выполненная трансплантация костно-пластических ксеногенных биоматериалов компании OsteoBiol® обеспечила регенерацию костной ткани в ожидаемые сроки после всех 344 синус-лифтингов у всех 247 пациентов. Причем, все 3 типа биоматериалов компании OsteoBiol® обеспечивали начало регенерации кости практически сразу же после их пересадки.
Следовательно, все 100 % синус-лифтингов с трансплантацией биоматериалов mp3, Genos и Evolution, (биоматериалы компании OsteoBiol®), выполненные у пациентов без наличия чрезмерно выраженной атрофии костной ткани в верхней челюсти, обеспечили приживление трансплантатов и регенерацию костной ткани у всех без исключения пациентов.
Полученный результат надежного приживления биоматериалов mp3, Genos и Evolution компании OsteoBiol® в самых простых клинических ситуациях позволил нам расширить показания к применению одномоментной дентальной имплантации. На основании полученных результатов в дополнение к существующим показаниям было принято решение о применении одноэтапной дентальной имплантации у пациентов с уменьшением высоты альвеолярного гребня верхней челюсти вплоть до 2,0 мм. Синус-лифтинг с трансплантацией ксеногенных биоматериалов компании OsteoBiol® в сочетании с одномоментной дентальной имплантацией был выполнен у 25 пациентов, имевших высоту альвеолярного гребня верхней челюсти 2,0 мм. Результаты выполненных хирургических операций показали, что трансплантация биоматериалов mp3, Genos и Evolution компании OsteoBiol®, дополненная одномоментной имплантацией имплантатов марки Nobel Biocare® модели Replace Select, обеспечила приживление трансплантатов, регенерацию костной ткани и приживление имплантатов у всех 25 пациентов.
Несмотря на явные преимущества дентальной трансплантации, выполняемой с помощью костно-пластических ксеногенных биоматериалов компании OsteoBiol®, нами был проведен критический анализ известных технологий. При этом была констатирована высокая сохранность биоматериалов при консервации, полная готовность их к пересадке, высокая приживаемость и интенсивность регенерации кости после пересадки, но, в то же время, низкая «виртуозность» их применения из-за недостатка разработанных хирургических технологий их применения. В частности, результаты показали, что из 344 стандартных операций синус-лифтинга в 87 операциях (в 25 %) была допущена перфорация мембраны Шнейдера. Кроме этого, после установки коронок на вживленные имплантаты у 689 пациентов из 850 прооперированных был выявлен чрезмерно выраженный дефицит мягких тканей. Этот дефицит явился причиной появления осложнения дентальной имплантации в виде образования щели между мягкими тканями челюсти и пришеечной частью коронки после ее установки на вживленный имплантат.
Проведенный нами анализ известных технологий синус-лифтинга показал, что известные технологии не содержат рекомендаций по предотвращению сквозного разреза мембраны Шнейдера при перфорации кости в области переднебоковой стенки гайморовой пазухи. Установлено, что известные способы лишены рекомендаций по обеспечению оптимального и безопасного углубления стоматологического бора и распатора в кость верхней челюсти и не содержат рекомендаций по мониторингу сохранности мембраны Шнейдера при ее отслаивании от кости. Иными словами, известные технологии синус-лифтинга лишены критерия адекватности углубления стоматологических инструментов в кость верхней челюсти при отслаивании ее от мембраны Шнейдера, что допускает многократную перфорацию гайморовой пазухи, проникновение в нее крови и других тканей, что затем может вызвать воспаление гайморовой пазухи.
Для решения указанной проблемы первоначально нами была изучена возможность применения инфракрасной термографии. Для этого с помощью тепловизора была исследована динамика локальной температуры в раневой поверхности при выполнении операции синус-лифтинга у 5 пациентов с умеренной атрофией кости верхней челюсти. Результаты показали, что инфракрасный видео контроль температуры тканей в области раны с помощью тепловизора расширяет информацию о состоянии открытых для обзора частей поверхности кости верхней челюсти, мягких тканей, покрывающих ее, и мембраны Шнейдера. Показано, что использование тепловизора позволяет контролировать динамику локальной температуры всех доступных для обзора и открытых участков мягких и твердых тканей лица на всех этапах синус-лифтинга. Выяснено, что введение в область хирургической раны холодных жидкостей, растворов лекарственных средств, хирургических инструментов и трансплантатов вызывает в ней появление зоны локальной гипотермии (рис. 1).
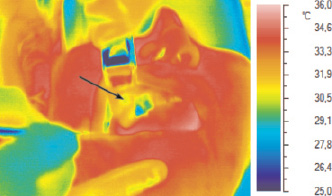
Рис. 1. Изображение лица пациентки П. в инфракрасном спектре излучения тканей через 15 секунд после инъекции в десну 1,7 мл раствора септанеста при температуре 24 °С (стрелкой показано место инъекции)
Кроме этого, результаты показали, что современная технология хирургической операции синус-лифтинга лишена мероприятий, направленных на контроль температуры тканей в ране и на создание в ней зон локальной гипо- или гипертермии. Более того, современная технология синус-лифтинга допускает введение в рану инструментов, лекарств и биоматериалов без учета их температуры, поэтому температура тканей в области хирургической раны не является стабильной и остается неизвестной врачу-стоматологу. Показано, что во время выполнения всех операций синус-лифтинга по общепринятой технологии происходило охлаждение мягких и твердых тканей верхней челюсти в области хирургической раны. Результаты показали, что температура в десне верхней челюсти в области планируемой операции понижалась еще до хирургического разреза. Причиной формирования очага локальной гипотермии оказалась инъекция раствора местного анестетика, который вводится без предварительного нагревания до температуры тела пациента (рис. 2).
Исследования показали, что зона локальной гипотермии в области раны сохранялась на протяжении всей операции при выполнении синус-лифтингов у всех 5 пациентов. Температура приближалась к исходному значению только через несколько минут после полного завершения операции закрытия полости рта.
В то же время, мониторинг динамики температуры в области хирургической раны не позволил нам предотвратить перфорацию мембраны Шнейдера при отслаивании от нее кости верхней челюсти во время выполнения операции синус-лифтинга у 2-х пациентов. В связи с этим было решено попытаться найти решение в видимом диапазоне спектра излучения тканей.
С целью разработки новой технологии было решено исследовать возможность дополнительной подсветки мембраны Шнейдера изнутри (со стороны гайморовой пазухи). При этом для дополнительного освещения мембраны Шнейдера мы отдали предпочтение назофарингоскопу. Опыт его применения у 10 пациентов с отсутствием жевательных зубов и с наличием умеренной атрофии кости верхней челюсти показал, что введение назофарингоскопа в полость носа и размещение в носу источника света напротив естественного отверстия в гайморову пазуху позволяет освещать гайморову пазуху и просвечивать оголенную мембрану Шнейдера.
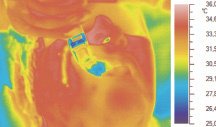 а
а  б
б
Рис. 2. Изображение лица пациентки К. в инфракрасном (а) и видимом (б) диапазоне спектра излучения тканей после формирования окна в кости верхней челюсти и оголения мембраны Шнейдера во время операции синус-лифтинга
Во время выполнения операций синус-лифтинга нами было проведено исследование степени просвечивания кости и мембраны Шнейдера при использовании источника света с различной яркостью и длиной волны испускаемого света. Полученные результаты и проведенные теоретические расчеты показали перспективу просвечивания твердых и мягких тканей верхней челюсти во время синус-лифтинга с помощью холодного сине-фиолетового света. При этом нам удалось найти путь профилактики осложнений и разработать новый способ синус-лифтинга.
Для профилактики перфорации мембраны Шнейдера нами был разработан «Способ синус-лифтинга при дентальной имплантации» (Заявка на изобретение РФ № 2014132778) [4]. Суть его сводится к тому, что предварительно соответствующая гайморова полость освещается изнутри холодным сине-фиолетовым светом, а формирование с помощью бора кольцевой канавки и последующее отслаивание с помощью распатора мембраны Шнейдера от кости производится при непрерывном визуальном контроле освещенности тканей под рабочими концами инструментов. При этом их углубляют в кость только до момента появления сине-фиолетового цвета под ними.
Указанный способ был применен нами у 10 пациентов, у которых отсутствовали жевательные зубы и имелась умеренная атрофия кости верхней челюсти. Для освещения гайморовой пазухи изнутри перед формированием кольцевой канавки в кости верхней челюсти в соответствующую половину полости носа мы вводили гибкий модифицированный назофарингоскоп марки «Atmos» диаметром 3,2 мм, который был снабжен источником холодного сине-фиолетового света. Размещали источник света в месте расположения естественного отверстия в гайморову пазуху, направляли в нее через это отверстие луч света, которым равномерно освещали ее наружную стенку. Затем при непрерывном визуальном контроле степени освещенности тканей под рабочими концами инструментов формировали с помощью бора кольцевую канавку в кости верхней челюсти, отслаивали с помощью распатора мембрану Шнейдера от вырезанного сегмента кости и от других костных участков, углубляя инструменты в кость только до момента появления сине-фиолетового света под их рабочими концами.
Результаты показали, что применение предложенного способа у пациентов этой группы позволило избежать перфорацию мембраны Шнейдера при синус-лифтинге у всех 10 человек.
Следовательно, предложенный способ позволяет предотвратить перфорацию мембраны Шнейдера как при формировании канавки с помощью бора, так и при отслаивании мембраны от кости с помощью распатора. Дело в том, что дополнительное освещение мембраны Шнейдера холодным сине-фиолетовым светом изнутри гайморовой пазухи дает врачу дополнительную информацию о толщине ее стенки, поскольку кость верхней челюсти непрозрачна, а мембрана Шнейдера прозрачна и практически бесцветна. Поэтому формирование с помощью хирургических инструментов канавки в кости и отслаивание от нее мембраны Шнейдера в проходящем свете является способом контроля толщины кости и сохранности мембраны. Появление прозрачной сине-фиолетовой мембраны под хирургическими инструментами является симптомом оптимальности углубления в ткани. Своевременное прекращение увеличения глубины обеспечивает сохранность мембраны Шнейдера и исключает ее перфорацию.
Параллельно с этим нами был проведен анализ известных технологий дентальной трансплантации и имплантации с целью профилактики дефекта мягких тканей под пришеечной частью коронки после установки ее на вживленный имплантат. Результаты исследования показали, что указанный недостаток известных технологий дентальной трансплантации и имплантации может быть связан с отсутствием в них эффективных «противощелевых» мероприятий. В частности, отсутствуют указания на использование специальных «выкроек» для подготовки трансплантатов к пересадке. К тому же, отсутствуют технологии изготовления «юбок-трансплантатов» и пересадки их вокруг вживленных имплантатов. Поэтому при выраженной атрофии мягких тканей известные технологии дентальных трансплантаций не обеспечивают «нужное» увеличение объема мягких тканей вокруг вживленных имплантатов. В связи с этим после установки коронок на вживленные имплантаты остаются щели между коронками и поверхностью этих тканей.
Через некоторое время каждая такая щель становится своего рода «мусорным полигоном» и «инкубатором заразы» во рту пациента, поскольку она заполняется остатками пищи во время ее жевания. Остатки пищи разлагаются в щели под действием микроорганизмов и создают при этом агрессивную среду, которая преждевременно разрушает установленную стоматологическую конструкцию и повреждает мягкие и костные ткани [1]. Это ведет к появлению дурного запаха изо рта, к развитию пародонтита и к воспалению других мягких и твердых тканей полости рта.
В связи с тем, что причиной формирования щелей под пришеечной частью коронки является выраженный дефицит мягких тканей в челюсти, было решено попытаться найти решение путем придания пересаживаемому биоматериалу специальной «противощелевой» формы и путем разработки оптимальной технологии его трансплантации вокруг имплантата. С целью увеличения объема мягких тканей вокруг имплантата с преимущественным увеличением высоты мягких тканей по гребню челюсти мы разработали специальную форму биоматериала, специальную выкройку для его выкраивания по специальному «лекалу» с учетом размера вживленного имплантата и специальную оригинальную технологию одномоментной трансплантации вкруговую вокруг вживленного имплантата.
При этом мы исходили из того, что для устранения выраженного дефицита мягких тканей вокруг вживленного имплантата требуется пересадка трансплантата, имеющего особую (специальную) форму. В частности, для эффективного увеличения объема мягких тканей вокруг имплантата трансплантат должен иметь уплощенную форму с увеличением толщины посередине в форме валика, центральная часть которого должна иметь поперечный разрез с возможностью трансформации этого разреза в отверстие для одевания на имплантат. Поэтому разрез должен иметь размеры, обеспечивающие его трансформацию в отверстие с диаметром, соответствующим диаметру вживленного имплантата. Укладывание готового трансплантата такой формы вокруг имплантата осуществляется по типу одевания юбки на него.
Разработанная нами технология придания особой формы используемому биоматериалу и дентальной трансплантации была применена при установке коронок на вживленные имплантаты у 14 пациентов с отсутствием жевательных зубов и с наличием выраженной атрофии мягких тканей нижней челюсти. При этом при осмотре пациентов, который осуществлялся в плановые сроки после проведенной стоматологической имплантации, стандартный перечень контролируемых показателей качества оказанной помощи дополняли оценкой толщины регенерированных мягких тканей над заглушкой имплантата. У всех пациентов данной группы было констатировано наличие мягких тканей менее 1 мм над заглушкой. Для профилактики формирования щели между коронкой и мягкими тканями на каждый вживленный имплантат «одевали как юбку» соединительнотканный биоптат, иссеченный с бугорка верхней челюсти пациента, придав перед этим иссеченному биоптату специальную форму.
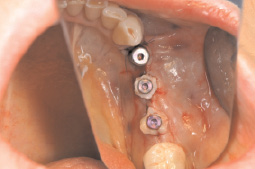
Соединительнотканный биоптат вырезался с бугорка верхней челюсти пациента в виде ленты толщиной 2–3 мм и длиной, превышающей величину радиуса имплантата на 3 мм. Затем вырезанный кусочек трансформировали с помощью хирургических инструментов в равнобедренный треугольник, основание которого имело длину 3–4 мм, а высота его имела размер, на 2–3 мм превышавший размер радиуса имплантата. В готовом треугольнике производили сквозной поперечный разрез биоптата в направлении от основания в сторону вершины треугольника по линии его высоты длиной, превышающей величину радиуса имплантата на 1 мм. Затем разрезали биоптат параллельно его плоскости посередине его толщины. Разрез производили от вершины в сторону основания треугольника, завершали разрез на расстоянии 1–2 мм от основания и расправляли образованные листки плоскости треугольника до образования из них фигуры ромба с гребнем утолщения посередине. После этого в мягких тканях вокруг выбранного вживленного имплантата формировали искусственную полость, заменяли заглушку имплантата на формирователь мягких тканей с диаметром, равным диаметру имплантата, размещали биоптат центром линии его разреза над центром верхушки формирователя мягких тканей, расположив биоматериал валиком кверху и разместив длинником валика по линии продольной оси челюсти. Затем растягивали трансплантат за концы его валиков , расширяя этим отверстие вплоть до соответствия его размеров размерам формирователя, одевали трансплантат этим отверстием на формирователь, плотно усаживали трансплантат на посадочное место, расправляли и размещали его в расправленном виде внутри искусственной полости в мягких тканях, после чего ушивали рану (рис. 3).
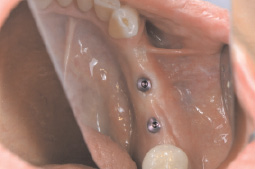 а
а
 б
б
Рис. 3. Часть нижней челюсти пациента Ш. через 2,5 месяца после проведенной имплантации 3-х мплантатов на месте отсутствующих 34, 35 и 36 зубов до (а) и сразу после завершения одевания юбок-трансплантатов на 2 имплантата, ставшие «голыми» из-за дефицита мягких тканей (б)
Результаты профилактики дефекта дентальной имплантации оценивались на протяжении 2-х лет после проведенной операции. Установлено, что применение разработанного способа «противощелевой» дентальной трансплантации привело к профилактике щелей между коронками и мягкими тканями у всех 14 пациентов. При этом у всех пациентов была полностью восстановлена функция жевания пищи, слизистые оболочки полости рта у них имели розовый цвет и одинаковую нормальную локальную температуру. У всех этих пациентов отсутствовал дурной запах изо рта, отсутствовали воспаления мягких и твердых тканей полости рта, а также другие признаки микробной агрессии в области установленных стоматологических конструкций.
Следовательно, при чрезмерно выраженной атрофии мягких тканей в челюсти трансплантация биоматериала, осуществляемая по разработанной нами оригинальной технологии перед установкой коронок на вживленные имплантаты, гарантирует отсутствие щелей под коронками.
Изложенная технология трансплантации легла в основу изобретения «Способ коррекции дефекта дентальной имплантации» (Заявка на изобретение РФ № 2014123087) [3]. Суть новой хирургической технологии сводится к изготовлению из биоматериала лоскута-трансформера оригинальной формы с валиком утолщения и разрезом посередине, который одевается как юбка на вживленный в кость имплантат, а свободные края юбки-трансплантата укрываются предварительно отслоенными мягкими тканями челюсти.
Таким образом, разработаны оригинальные способы трансплантации биоматериалов при выраженной атрофии твердых и мягких тканей челюсти, которые существенно повышают точность, эффективность и безопасность синус-лифтинга с одномоментной дентальной имплантацией, установку коронок на вживленные имплантаты и расширяют применение костно-пластических ксеногенных биоматериалов компании OsteoBiol®.
Библиографическая ссылка
Ураков А.Л., Ураков А.Л., Решетников А.П. ОРИГИНАЛЬНЫЕ СПОСОБЫ ПРИМЕНЕНИЯ БИОМАТЕРИАЛОВ ДЛЯ ДЕНТАЛЬНОЙ ТРАНСПЛАНТАЦИИ И ИМПЛАНТАЦИИ ПРИ АТРОФИИ ТВЕРДЫХ И МЯГКИХ ТКАНЕЙ ЧЕЛЮСТИ // Международный журнал прикладных и фундаментальных исследований. 2014. № 10-1. С. 22-31;URL: https://applied-research.ru/ru/article/view?id=5920 (дата обращения: 03.03.2026).

