Сформированные в результате добычи и переработки медно-колчеданных руд кислые минерализованные промышленные воды по качественно-количественным показателям сопоставимы с забалансовыми рудами и образуют техногенное гидроминеральное сырьё [1-3]. Вовлечение этого вида гидроминерального сырья в переработку связано с необходимостью совершенствования уже имеющихся и с разработкой новых инновационных технологий глубокой переработки техногенных кислых рудничных вод, обеспечивающих предотвращение сброса токсичных гидроминеральных стоков в природные водоемы; это позволит повысить рентабельность производства, улучшить состояние атмосферы и водных ресурсов, сократить накопление отходов и отчуждение земель под их хранение.
С целью практической реализации для технологического процесса, основываясь на общей схеме мероприятий, осуществляемых при проектировании систем переработки кислых минерализованных промышленных вод с помощью методов нейтрализации/осаждения [7-10], экспериментально изучается химия процесса извлечения методом известкования катионов черных и цветных металлов и, в первую очередь, меди (II) из технологических растворов горных предприятий медного комплекса, матричный состав которых примерно известен. Основными компонентами катионного состава этих технологических растворов, наряду с ионами меди (II), являются катионы железа (II), железа (III) и цинка [1, 4-6].
Цель исследования. Экспериментальное изучение закономерностей процесса извлечения ионов меди (II), цинка с применением метода нейтрализации из двухкомпонентных модельных систем в широком интервале рН.
Материалы и методы исследования
Использовали: фотометрический метод с реактивом пикрамин эпсилон и метод прямой потенциометрии с использованием медьселективного электрода для определения меди, гексацианоферратный и трилонометрический титриметрические методы для определения цинка.
Исследуемый интервал рН: от 0,90 до 12,50. Исходные концентрации металлов в модельных системах задавались в следующих пределах: для ионов меди (II) – от 0,1 до 1,0 г/дм3; для ионов цинка – от 0,1 до 2,5 г/дм3. В качестве реагентов-осадителей использовали растворы химически чистых щелочей.
Результаты исследования и их обсуждение
При изучении влияния характера среды модельных двухкомпонентных систем Cu2+ – Zn2+ на степень извлечения из них меди и цинка выяснено, что свежеполученные осадки гидроксидов представляют собой неустойчивые аморфные образования, сорбционная способность которых быстро меняется и зависит от условий их получения, что согласуется с литературными данными [1].
Кривые остаточного содержания ионов Cu2+ и Zn2+, представленные на рис. 1, для модельных систем Cu2+ – Zn2+ с исходным отношением массовых концентраций меди и цинка 1:6,25 свидетельствуют о том, что до pH 5,0 содержание ионов Cu2+ в растворах остается практически равным исходному. В интервале pH от 5,0 до 6,5 наблюдается резкое снижение остаточного содержания ионов Cu2+ в растворах в связи с образованием осадка гидроксида меди (II). При дальнейшем повышении pH до 11,0 остаточное содержание ионов Cu2+ практически не изменяется и находится в интервале 0,013 – 0,025 г/дм3.
Таким образом, при рН выше 6,5 степень извлечения меди из модельных растворов составляет 93,8 – 96,7 %. Осаждение катионов Zn2+ начинается при рН выше 6,5. При рН 8,0 – 11,0 остаточное содержание цинка в модельных растворах минимально (0,016 – 0,020 г/дм3). Степень извлечения цинка при этом составляет 99,2 – 99,4 %. В области значений pH больше 11 наблюдается некоторое увеличение остаточного содержания ионов Cu2+ и Zn2+ в растворах, связанное с частичным растворением осадков Cu(OH)2 и Zn(OH)2 и образованием гидроксокомплексов.
Кривые остаточного содержания ионов Cu2+ и Zn2+ (рис. 2) для модельных систем Cu2+ – Zn2+ с отношением массовых концентраций меди и цинка 1:2,5 отражают незначительное снижение концентрации ионов меди и цинка в растворах в интервале рН 3,0 ÷ 6,0, а затем, при рН больше 6, наблюдается резкое снижение содержания ионов в растворе, связанное с образованием осадков гидроксидов Cu(OH)2 и Zn(OH)2, которое для Cu(OH)2 заканчивается примерно при рН 7, а для Zn(OH)2 – примерно при рН9.
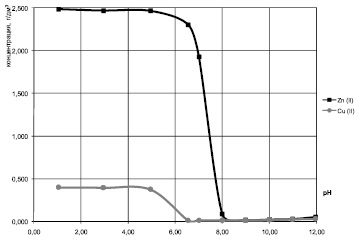
Рис. 1. Влияние pH на остаточное содержание ионов Cu2+ и Zn2+ в двухкомпонентных модельных растворах с исходными концентрациями ионов Cu2+ 0,4 г/дм3, ионов Zn2+ 2,5 г/дм3
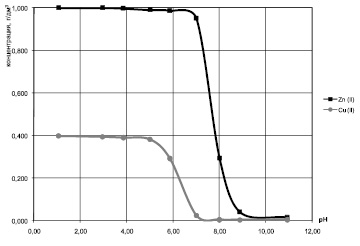
Рис. 2. Влияние pH на остаточное содержание ионов Cu2+ и Zn2+ в двухкомпонентных модельных растворах с исходными концентрациями ионов Cu2+ 0,4 г/дм3, ионов Zn2+ 1,0 г/дм3
Таким образом, уменьшение исходной концентрации ионов Zn2+ в модельных растворах приводит к увеличению рН начала осаждения гидроксидов Cu(OH)2 и Zn(OH)2.
Аналогичные результаты представлены и на рис. 3 для модельных систем с соотношением массовых концентраций ионов меди (II) и цинка 1:0,25. Остаточное содержание ионов меди начинает снижаться только после рН > 6 и достигает минимума примерно при рН 8. Извлечение основной массы цинка в виде его гидроксида начинается примерно при рН 8 и заканчивается при рН около 9.
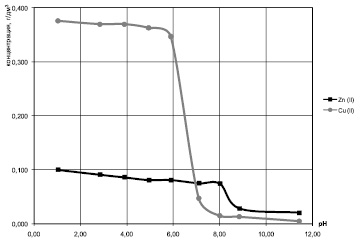
Рис. 3. Влияние pH на остаточное содержание ионов Cu2+ и Zn2+ в двухкомпонентных модельных растворах с исходными концентрациями ионов Cu2+ 0,4 г/дм3, ионов Zn2+ 0,1 г/дм3
Сравнительные данные по изменению остаточного содержания ионов Cu2+ при разных исходных концентрациях ионов Zn2+, представленные на рис. 4, наглядно свидетельствуют о влиянии на рН начала извлечения меди (II) исходного содержания ионов цинка в растворе.
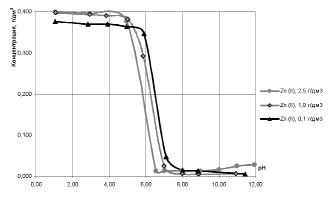
Рис. 4. Влияние pH на остаточное содержание ионов Cu2+ в двухкомпонентных модельных растворах с исходной концентрацией ионов Cu2+ 0,4 г/дм3 и с различным исходным содержанием ионов Zn2+
Данные, представленные на рис. 5, отображают такую же зависимость для рН начала извлечения цинка от исходного содержания ионов цинка в растворе.
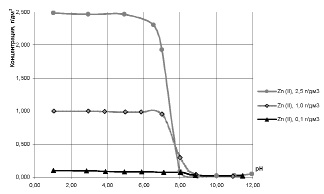
Рис. 5. Влияние pH на остаточное содержание ионов Zn2+ в двухкомпонентных модельных растворах с исходной концентрацией ионов Cu2+ 0,4 г/дм3 и с различным исходным содержанием ионов Zn2+
Анализ кривых остаточного содержания ионов Cu2+ и Zn2+, представленных на рис. 1 – 5, позволяет сделать вывод о необходимости повышения рН для увеличения степени извлечения меди в присутствии цинка.
Как установлено ранее [1], в отсутствие ионов Zn2+, Fe2+ и Fe3+ основное количество ионов Cu2+ извлекается в интервале pH от 5,0 до 7,0, при pH 8,0 остаточное содержание ионов Cu2+ достигает минимального значения. В присутствии ионов Zn2+ остаточное содержание меди начинает снижаться только после рН > 6 и достигает минимума примерно при рН 8.
Следовательно, чем меньше исходная концентрация цинка в растворах, тем при более высоком значении рН извлекаются и медь, и цинк.
Полученные результаты согласуются с расчетными значениями рН осаждения Cu(OH)2 и Zn(OH)2 из чистых растворов с теми же исходными концентрациями ионов Cu2+ и Zn2+, которые использовались в ходе экспериментальной работы. Расчеты проводились на основе табличных значений ПР (Cu(OH)2) =2,2∙10-20 и ПР(Zn(OH)2) = =1∙10-17 при 18-25оС.
Если исходные концентрации ионов цинка в однокомпонентных растворах составляют 2,5; 1,0; 0,1 г/дм3, то расчетные значения рН начала осаждения Zn(OH)2 соответственно равны 6,21; 6,40; 6,90. При исходной концентрации ионов меди (ІІ) в однокомпонентном растворе 0,4 г/дм3 рН начала их осаждения равно 5,17.
По результатам данного этапа исследования можно сделать следующие выводы:
– Уменьшение исходной концентрации ионов Zn2+ в модельных растворах Cu2+ – Zn2+приводит к увеличению рН начала извлечения из них гидроксидов Cu(OH)2 и Zn(OH)2.
– Для количественного извлечения меди из различных техногенных растворов в присутствии цинка необходимо повышать их кислотность.
Библиографическая ссылка
Амангусова Л.А., Захарова В.С., Калугин Ю.А. ИЗУЧЕНИЕ ЗАКОНОМЕРНОСТЕЙ ИЗВЛЕЧЕНИЯ МЕДИ И ЦИНКА ИЗ ДВУХКОМПОНЕНТНЫХ РАСТВОРОВ // Международный журнал прикладных и фундаментальных исследований. 2015. № 6-2. С. 277-281;URL: https://applied-research.ru/ru/article/view?id=6887 (дата обращения: 03.03.2026).

