Разнообразные N-алкилзамещенные производные пиримидиновых и пуриновых оснований, содержащие терминальные ненасыщенные и ароматические фрагменты, составляют новый класс ненуклеозидных ингибиторов вирусной репродукции широкого спектра действия [6, 9]. В частности, 1-аллилоксиметилурацил и его аналоги продемонстрировали высокую активность в отношении вируса герпеса простого типа 1 in vitro [5] и in vivo, в том числе в отношении штамма, устойчивого к действию ацикловира [4]. Феноксиалкилпроизводные урацила проявляют заметную активность в отношении ВИЧ-1 [3, 8], цитомегаловируса человека [10] и гепатита С [1]. Наибольший практический интерес среди соединений этого класса представляют производные 1-(2-феноксиэтил)урацила, содержащие в орто-положении фенольного ядра бензоильный заместитель [7]. Среди этих веществ был выявлен 1-[2-(2-бензоилфенокси)этил]-6-метилурацил, продемонстрировавший равный с Эфавиренцем уровень анти-ВИЧ-1 активности in vitro при сходном профиле резистентности. Препаративному синтезу этого соединения и разработке метода его количественного определения посвящена настоящая статья.
Цель исследования. Разработка препаративного метода синтеза и количественного определения 1-[2-(2-бензоилфенокси)этил]-6-метилурацила методом спектрофотометрии в ультрафиолетовом диапазоне.
Материалы и методы исследования
Для синтеза 1-[2-(2-бензоилфенокси)этил]-6-метилурацила был использован метод «сплавления» путем нагревания субстрата – триметилсилилпроизводного 6-метилурацила и алкилирующего агента – 1-бром-2-(2-бензоилфенокси)этана без растворителя при температуре 180-185 оС в течение 4 ч, как это описано для других алкилирующих агентов с невысокой реакционной способностью [2]. Спектры ЯМР регистрировали на спектрометре Bruker AMXIII (400 МГц) в растворах диметилсульфоксида-D6, внутренний стандарт – тетраметилсилан. Температуру плавления определяли на приборе Mel-Temp 3.0 (Laboratory Devices Inc). Тонкослойную хроматографию выполняли на пластинах Sorbfil ПТСХ-АФ-А-УФ, подвижная фаза – изопропиловый спирт, проявление – в парах иода. Оптическую плотность растворов целевого соединения в 95 % этиловом спирте определяли на спектрофотометре Shimadzu UV mini-1240 при длине волны 251,5 нм.
1-[2-(2-Бензоилфенокси)этил]-6-метилурацил. 2,0 г (0,016 Моль) урацила, 25 мл (0,120 моль) гексаметилдисилазана и 0,25 г (0,005 моль) хлорида аммония кипятят с защитой от влаги воздуха до полного растворения осадка (12 ч), избыток гексаметилдисилазана отгоняют на кипящей водяной бане при остаточном давлении не менее 10 мм рт. ст., к остатку добавляют 3,0 г (0,010 моль) 1-(2-бензоилфенокси)-2-бромэтана и нагревают при периодическом перемешивании при температуре 180-185оС в течение 4 ч. Реакционную массу охлаждают, растворяют в 25 мл этилацетата, добавляют 25 мл изопропилового спирта, через 30 мин выделившийся осадок отфильтровывают и фильтрат упаривают в вакууме. Остаток растворяют в 50 мл хлороформа, фильтруют, фильтрат упаривают в вакууме, остаток кристаллизуют из 50 мл изопропилового спирта и получают 2,7 г 1-[2-(2-бензоилфенокси)этил]-6-метилурацила, Т. пл. 227-230оС, Rf 0,70, выход 49 %.
Спектр ЯМР 1Н: 1,86 с (3Н, СН3); 3,85 т (2Н, 5 Гц, СН2-N); 4,18 т (2Н, 5 Гц, СН2-O); 5,15 с (1Н, Н5); 7,07-7,73 м (9Н, арил); 11,87 с (1Н, NH).
Спектр ЯМР 13С: 23,56; 47,24; 70,30; 195,41; 117,28; 125,40; 132,75; 133,37; 135,94; 137,60; 141,07; 155,62; 158,10; 159,68; 166,39; 199,64.
Результаты исследования и их обсуждение
Синтез 1-[2-(2-бензоилфенокси)этил]-6-метилурацила, содержащего фрагмент бензофенона в составе заместителя при атоме азота N1, был осуществлен по схеме:
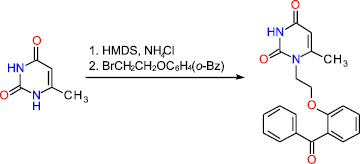
Схема синтеза 1-[2-(2-бензоилфенокси)этил]урацила
При этом алкилирование 6-метилурацила 1-(2-бензоилфенокси)-2-бромэтаном в среде безводного диметилформамида в присутствии карбоната калия в интервале температур 20-125 оС при различных соотношениях субстрата и алкилирующего агента оказалось значительно менее эффективным и приводило главным образом к продукту N1,N3-дизамещения в 6-метилурациле.
Полученное целевое соединение представляет собой белое кристаллическое вещество, мало растворимое в воде, растворимое в спирте и ДМСО. Наличие в структуре соединения двух ароматических ядер, сопряженных посредством карбонильной группы, а также ядра урацила обусловливает интенсивное поглощение этим веществом электромагнитного излучения в ультрафиолетовом диапазоне, что предопределяет выбор метода количественного определения этого потенциального лекарственного вещества. Измерение оптической плотности различных растворов 1-[2-(2-бензоилфенокси)этил]-6-метилурацила в 95 % этиловом спирте при длине волны 251,5 нм, что соответствует его максимуму поглощения, показало линейную зависимость от концентрации (табл. 1).
Использование в качестве растворителя 0,1 М раствора кислоты хлористоводородной или 0,1 М раствора калия гидроксида в 95 % этиловом спирте практически не влияло на величину максимума поглощения исследуемого вещества, из чего следует, что положение этого максимума в УФ-спектре определяется бензофеноновым фрагментом, а не ядром 6-метилурацила, способного образовывать соли как в сильнокислой, так и в высокоосновной среде.
Таблица 1
Концентрационная зависимость оптической плотности растворов 1-[2-(2-бензоилфенокси)этил]-6-метилурацила
|
Концентрация, С, г/л |
Оптическая плотность, D |
|
0,0082 |
0,6113 |
|
0,0138 |
0,9036 |
|
0,0206 |
1,2634 |
|
0,0275 |
1,6236 |
|
0,0361 |
2,0755 |
|
0,0444 |
2,4987 |
|
0,0531 |
2,9491 |
Таблица 2
Метрологические характеристики метода количественного определения 1-[2-(2-бензоилфенокси)этил]-6-метилурацила
|
Показатель |
Значение |
|
Специфичность |
Методика специфична |
|
Линейность |
y = 51,83x + 0,2102 |
|
Коэффициент корреляции |
r = 0,9995 |
|
Стандартное отклонение, SD, г/л |
0,00035 |
|
Относительное стандартное отклонение, RSD, % |
0,66 |
Концентрационная зависимость имеет вид С = 0,01929*D – 0,00406 (г/л) и может быть использована для определения чистоты субстанции 1-[2-(2-бензоилфенокси)этил]-6-метилурацила и ее количественного содержания в лекарственной форме. Метрологические характеристики разработанного метода анализа представлены в табл. 2.
Заключение
Разработан усовершенствованный метод синтеза 1-[2-(2-бензоилфенокси)этил]-6-метилурацила, основанный на модифицированной реакции Гилберта-Джонсона, проводимой без растворителя при повышенной температуре. Обоснован и апробирован метод количественного определения этого соединения методом спектрофотометрии в ультрафиолетовом диапазоне.
Библиографическая ссылка
Сысуева Ю.В., Луганченко А.И., Солодунова Г.Н., Озеров А.А. СИНТЕЗ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ 1-[2-(2-БЕНЗОИЛФЕНОКСИ)ЭТИЛ]-6-МЕТИЛУРАЦИЛА МЕТОДОМ СПЕКТРОФОТОМЕТРИИ // Международный журнал прикладных и фундаментальных исследований. 2015. № 8-1. С. 113-115;URL: https://applied-research.ru/ru/article/view?id=7051 (дата обращения: 21.02.2026).

