Цитомегаловирус (ЦМВ) является широко распространенным патогеном в человеческой популяции, которым инфицировано до 90 % взрослого городского населения. У здоровых людей ЦМВ-инфекция обычно протекает бессимптомно, в то время как у людей с пониженным иммунным статусом, в частности у больных СПИДом и реципиентов трансплантированных органов, получающих иммуносупрессоры, эта инфекция вызывает ряд заболеваний, включая ЦМВ-пневмонию, гастроинтестинальные заболевания и ретинит, которые угрожают жизни пациента [6, 8]. ЦМВ является основной причиной врожденных пороков развития у новорожденных, что часто приводит к глухоте и умственной отсталости [9]. В настоящее время для лечения ЦМВ-инфекции в клинике используются несколько препаратов, ингибирующих репликацию вируса: ганцикловир, фоскарнет и цидофовир [5, 7]. Однако данные лекарственные препараты имеют ряд существенных недостатков: низкую биодоступность, высокую токсичность и ограниченную эффективность. Кроме того, серьезной проблемой является появление в ходе лечения резистентных к действию этих препаратов вариантов ЦМВ. Поскольку все применяемые анти-ЦМВ препараты имеют сходный механизм действия – ингибирование вирусной ДНК-полимеразы, мутантные варианты вируса часто проявляют кросс-резистентность [10]. В этой связи поиск новых высокоэффективных анти-ЦМВ агентов является важной и актуальной задачей.
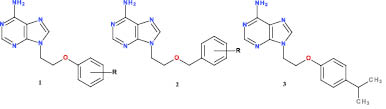
Недавно нами был описан новый класс высокоактивных 9-[2-(фенокси)этил]- (1) [2] и 9-[2-(бензилокси)этил]производных аденина (3) [3], которые проявили мощное анти-ЦМВ действие в наномолярных концентрациях в HEL клеточной культуре. В настоящее время для соединения-лидера – 9-[2-(4-изопропилфенокси)этил]аденина (3), продемонстрировавшего также высокую антидепрессантную и противострессорную активность, в полном объеме завершены доклинические исследования [1, 4].
Цель исследования
Поиск новых ингибиторов репродукции ЦМВ на основе аза-аналогов 9-[2-(фенокси)этил]производных аденина, дополнительно содержащих п-толуолсульфонамидный фрагмент при экзоциклическом атоме азота в боковой цепи.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254» (Германия), используя в качестве элюента этилацетат-гексан (1:1) (А) и 1,2-дихлорэтан – метанол (9:1) (Б). Пластины проявляли с помощью УФ-лампы VL-6.LC (Франция). Для флэш-хроматографии использовали Kieselgel 60-200 μm, 60 A (Acros Organics). Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
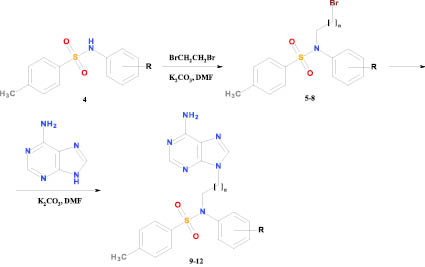
Общий метод получения N-(ω-бромалкил)-N-арил-п-толуолсульфонамидов 5-8. Смесь 19,1 ммоль соответствующего п-толуолсульфонамида 4, 3,5 г (25,3 ммоль) карбоната калия и 8,0 мл (92,8 ммоль) 1,2-дибромэтана перемешивают в 50 мл безводного диметилформамида при температуре 80–85 °С в течение 36 ч. Реакционную массу охлаждают, фильтруют, фильтрат упаривают в вакууме, остаток растирают с 20 мл диэтилового эфира и помещают на ночь в холодильник. Закристаллизовавшийся продукт отфильтровывают, промывают диэтиловым эфиром (3×10 мл), растворяют в 25 мл этилацетата и очищают методом флэш-хроматографии на силикагеле. Элюат упаривают при пониженном давлении, остаток кристаллизуют из смеси этилацетат-гексан (1:1).
N-(2-Бромэтил)-N-(3,5-диметилфенил)-п-толуолсульфонамид (5). Выход 79 %, Т. пл. 89–90,5 °С, Rf 0,68 (А). Спектр 1H ЯМР, d, м. д.: 2,20 с (6Н, 2×СН3); 2,39 с (3Н, СН3); 3,39 т (2Н, J = 6,4 Гц, NСН2); 3,88 т (2Н, J = 6,5 Гц, BrСН2); 6,68 с (2Н, H-2, H-6); 6,97 с (1Н, Н-4); 7,38 д (2Н, J = 8,5 Гц, H-3’, H-5’); 7,48 д (2H, J = 8,3 Гц, H-2’, H-6’). Спектр 13C ЯМР, δ, м. д.: 20,3; 21,0; 30,6; 51,8; 126,2; 127,4; 129,6; 129,7; 135,0; 138,2; 138,3; 143,6.
N-(2-Бромэтил)-N-(3,5-дихлорфенил)-п-толуолсульфонамид (6). Выход 84 %, Т. пл. 123–124,5 °С, Rf 0,60 (А). Спектр 1H ЯМР, d, м. д.: 2,40 с (3Н, СН3); 3,46 т (2Н, J = 6,2 Гц, NСН2); 3,98 т (2Н, J = 6,3 Гц, BrСН2); 7,20 д (2Н, J = 1,8 Гц, H-2, H-6); 7,41 д (2Н, J = 8,2 Гц, H-3’, H-5’); 7,51 д (2H, J = 8,2 Гц, H-2’, H-6’); 7,57 д (1Н, J = 1,8 Гц, Н-4). Спектр 13C ЯМР, δ, м. д.: 25,2; 35,0; 55,4; 131,59; 131,64; 132,2; 134,1; 138,3; 144,9; 148,4.
N-(3-Бромпропил)-N-(3,5-диметилфенил)-п-толуолсульфонамид (7). Выход 80 %, Т. пл. 103–105 °С, Rf 0,77 (А). Спектр 1H ЯМР, d, м. д.: 1,85 квин (2Н, J = 6,6 Гц, СН2); 2,19 с (6Н, 2 ×СН3); 2,39 с (3Н, СН3); 3,48 т (2Н, J = 6,5 Гц, NСН2); 3,61 т (2Н, J = 6,8 Гц, BrСН2); 6,66 с (2Н, H-2, H-6); 6,95 с (1Н, Н-4); 7,38 д (2Н, J = 8,2 Гц, H-3’, H-5’); 7,47 д (2H, J = 8,2 Гц, H-2’, H-6’). Спектр 13C ЯМР, δ, м. д.: 24,0; 24,1; 24,4; 34,6; 51,8; 129,3; 130,7; 130,8; 132,9; 136,9; 141,6; 142,0; 146,8.
N-(3-Бромпропил)-N-(3-хлорфенил)-п-толуолсульфонамид (8). Выход 86 %, Т. пл. 87–88 °С, Rf 0,69 (А). Спектр 1H ЯМР, d, м. д.: 2,02 квин (2Н, J = 6,6 Гц, СН2); 2,44 с (3Н, СН3); 3,42 т (2Н, J = 6,6 Гц, NСН2); 3,66 т (2Н, J = 6,9 Гц, BrСН2); 6,97 дт (1H, J = 7,6 и 1,7 Гц, H-6); 7,07 т (1H, J = 7,6 Гц, H-5); 7,26–7,30 м (4Н, H-2, H-4, H-3’, H-5’); 7,47 д (2H, J = 8,4 Гц, H-2’, H-6’). Спектр 13C ЯМР, δ, м. д.: 21,5; 29,7; 31,4; 48,9; 126,6; 127,6; 128,2; 128,7; 129,5; 129,9; 134,3; 134,4; 140,3; 143,8.
Общий метод получения N-[ω-(6-амино-9H-пурин-9-ил)алкил]-N-арил-п-толуолсульфонамидов. Суспензию 0,8 г (5,92 ммоль) аденина и 1,25 г (9,04 ммоль) карбоната калия перемешивают в 20 мл безводного диметилформамида при температуре 100–105 °С в течение 1 ч, добавляют 5,92 ммоль соответствующего бромида и перемешивают при той же температуре в течение 16 ч. Реакционную массу охлаждают, фильтруют, осадок на фильтре промывают диметилформамидом (3×10 мл), фильтрат упаривают в вакууме, остаток растирают с 25 мл воды (100 мл) и помещают на ночь в холодильник. Закристаллизовавшийся продукт отфильтровывают, сушат на воздухе и кристаллизуют из смеси изопропиловый спирт – диметилформамид (2:1).
N-[2-(6-Амино-9H-пурин-9-ил)этил]-N-(3,5-диметилфенил)-п-толуолсульфонамид (9). Выход 81 %, Т. пл. 242,5–244,5 °С, Rf 0,75 (Б). Спектр 1H ЯМР, d, м. д.: 2,16 с (6Н, 2×СН3); 2,39 с (3Н, СН3); 4,04 т (2Н, J = 5,8 Гц, NСН2); 4,22 т (2Н, J = 5,6 Гц, NСН2); 6,53 с (2Н, H-2’, H-6’); 6,80 уш. с (2Н, NH2); 6,87 с (1Н, Н-4’); 7,30 д (2Н, J = 8,1 Гц, H-3’’, H-5’’); 7,41 д (2H, J = 8,1 Гц, H-2’’, H-6’’); 7,91 c (1H, H-2); 8,07 c (1H, H-8). Спектр 13C ЯМР, δ, м. д.: 24,8; 25,2; 46,6; 53,7; 130,0; 130,2; 131,5; 133,5; 133,6; 139,3; 142,2; 142,7; 145,0; 147,7; 153,8; 156,4; 160,1.
N-[2-(6-Амино-9H-пурин-9-ил)этил]-N-(3,5-дихлорфенил)-п-толуолсульфонамид (10). Выход 77 %, Т. пл. 234–236 °С, Rf 0,38 (Б). Спектр 1H ЯМР, d, м. д.: 2,36 с (3Н, СН3); 4,10 т (2Н, J = 6,0 Гц, NСН2); 4,22 т (2Н, J = 6,0 Гц, NСН2); 7,02 д (2Н, J = 1,8 Гц, H-2’, H-6’); 7,18 уш. с (2Н, NH2); 7,32 д (2Н, J = 8,2 Гц, H-3’’, H-5’’); 7,37 д (2H, J = 8,3 Гц, H-2’’, H-6’’); 7,48 д (1Н, J = 1,6 Гц, Н-4); 8,01 c (1H, H-2); 8,06 c (1H, H-8). Спектр 13C ЯМР, δ, м. д.: 25,2; 46,3; 53,4; 122,8; 131,3; 131,4; 131,8; 134,0; 138,0; 138,1; 144,8; 145,0; 148,4; 153,6; 156,4; 160,1.
N-[3-(6-Амино-9H-пурин-9-ил)пропил]-N-(3,5-диметилфенил)-п-толуолсульфонамид (11). Выход 87 %, Т. пл. 193–195 °С, Rf 0,47 (Б). Спектр 1H ЯМР, d, м. д.: 1,85 квин (2Н, J = 6,8 Гц, СН2); 2,16 с (6Н, 2×СН3); 2,38 с (3Н, СН3); 3,50 т (2Н, J = 6,8 Гц, NСН2); 4,17 т (2Н, J = 6,9 Гц, NСН2); 6,60 с (2Н, H-2’, H-6’); 6,92 с (1Н, Н-4’); 7,17 уш. с (2Н, NH2); 7,35 д (2Н, J = 8,2 Гц, H-3’’, H-5’’); 7,41 д (2H, J = 8,2 Гц, H-2’’, H-6’’); 8,05 c (1H, H-2); 8,12 c (1H, H-8). Спектр 13C ЯМР, δ, м. д.: 24,0; 24,4; 31,3; 43,8; 50,9; 122,2; 129,4; 130,7; 132,8; 132,9; 138,1; 141,5; 141,7; 144,3; 146,8; 152,8; 155,7; 159,3.
N-[3-(6-Амино-9H-пурин-9-ил)пропил]-N-(3-хлорфенил)-п-толуолсульфонамид (12). Выход 82 %, Т. пл. 184–185 °С, Rf 0,40 (Б). Спектр 1H ЯМР, d, м. д.: 1,85 квин (2Н, J = 6,8 Гц, СН2); 2,38 с (3Н, СН3); 3,57 т (2Н, J = 6,6 Гц, NСН2); 4,17 т (2Н, J = 6,8 Гц, NСН2); 7,00 д (1H, J = 7,5 Гц, H-6’); 7,21 уш. с (3H, H-5’, NH2); 7,35–7,41 м (6Н, H-2’, H-4’, H-3’’, H-5’’, H-2’’, H-6’’); 8,08 c (1H, H-2); 8,12 c (1H, H-8). Спектр 13C ЯМР, δ, м. д.: 21,4; 28,1; 40,6; 47,4; 119,1; 127,0; 127,7; 128,4; 129,1; 130,1; 130,8; 133,4; 140,2; 141,2; 144,2; 149,8; 152,7; 156,3.
Результаты исследования и их обсуждение
Синтез целевых соединений был осуществлен в две стадии. На первой стадии обработка п-толуолсульфонамида 4 4-х кратным молярным избытком 1,2-дибромэтана или 1,3-дибромпропана в среде безводного диметилформамида в присутствии карбоната калия при температуре 80–85 °С привела к образованию N-(2-бромэтил)- (5, 6) и N-(3-бромпропил)- (7, 8) производных п-толуолсульфонамида с выходом 79–86 %. На втором этапе синтеза исходный аденин-основание алкилировали бромидами 5–8 в среде безводного диметилформамида в присутствии карбоната калия при температуре 100–105 °С, что привело к образованию конечных 9-замещенных производных аденина 9–12, выход которых составил 77–87 %.
Выход и физико-химические свойства синтезированных соединений 9–12 представлены в таблице.
Физико-химические свойства синтезированных соединений
|
Соединение |
R |
n |
Выход, % |
Т. пл.., °С |
Rf (Б) |
|
9 |
3,5-(CH3)2 |
1 |
81 |
242,5-244,5 |
0,75 |
|
10 |
3,5-Cl2 |
1 |
77 |
234-236 |
0,38 |
|
11 |
3,5-(CH3)2 |
2 |
87 |
193-195 |
0,47 |
|
12 |
3-Cl |
2 |
82 |
184-185 |
0,40 |
Заключение
Осуществлен синтез 4 новых, ранее не описанных в литературе N-[ω-(6-амино-9H-пурин-9-ил)алкил]-N-арил-п-толуолсульфонамидов. Исследованы физико-химические и спектральные свойства полученных веществ. Новые соединения представляют значительный интерес в качестве потенциальных ненуклеозидных ингибиторов репродукции цитомегаловируса человека.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 13-04-01391а.
Библиографическая ссылка
Новиков М.С., Озеров А.А. СИНТЕЗ N-АРИЛ-П-ТОЛУОЛСУЛЬФОНАМИДНЫХ ПРОИЗВОДНЫХ АДЕНИНА КАК ПОТЕНЦИАЛЬНЫХ ИНГИБИТОРОВ РЕПРОДУКЦИИ ЦИТОМЕГАЛОВИРУСА ЧЕЛОВЕКА // Международный журнал прикладных и фундаментальных исследований. 2015. № 9-3. С. 503-506;URL: https://applied-research.ru/ru/article/view?id=7359 (дата обращения: 11.02.2026).

