Ранее [1–3] нами была показана возможность использования методов спектрофотометрии для количественного изучения процессов комплексообразования ионами редкоземельных элементов (РЗЭ) в растворах. Позднее методы спектрофотометрии были успешно применены [4–5] для изучения комплексообразования ионами празеодима, неодима, еврония, гадолония и тербия с антроловой кислотой (Н2Аnt).
Материалы и методы исследования
Растворы и реагенты. Раствор с концентрацией 0,1 мг/мл празеодима, неодима, эрбия, гадолония и тербия приготовлен из нитратов: Pr(NO3)3∙6H2O(x.r), Nd(NO3)3∙6H2O(x.r), Er(NO3)3∙6H2O(x.r), Gd(NO3)3∙6H2O(x.r), Tb(NO3)3∙6H2O(x.r). Более разбавленные растворы готовят разбавлением. Концентрацию раствора установили комплексонометрически [6].
Использовали 2,3-антрациловой кислоты (Н2Аnt) очищенной двухкратным переосаждением из насыщенного щелочного раствора соляной кислотой и высушена при 90 °С. В качестве исходного раствора 2,3-Аnt использован в виде 2,5∙10-2 М растворе в водных растворах щелочей. Все остальные использованные реагенты и растворители имели квалификацию «х.ч.» не подвергались дополнительной очистке. Ионная сила растворов в большинстве случаев создавалась за счет соли редкоземельного элемента и комплексообразующего вещества.
Аппаратура измерения величин оптических плотностей проводились с помощью спектрофотометра СФ-26 в кюветах l = 1 см. Определение величин рН растворов производили на лабораторном рН-метре рН-673 со стеклянным электродом. Опыты были проведены при температуре 18–20 °С.
Результаты исследования и их обсуждения
В изучении комплексообразования были проведены произношения рН растворов, равных 5,5-9,80. При первом из них доминирующей формой лиганда является анион НАnt– , при втором – в растворах содержится НАnt– и НАnt2– [7].
Таблица 1
Длины волн выбранные для изучения комплексообразования
|
Ионы РЗЭ |
Длина волны, λ нм |
|
Pr3+ |
560, 580, 590 |
|
Nd3+ |
540, 580, 625 |
|
Eu3+ |
500, 510, 540 |
|
Gd3+ |
Бесцветный |
|
Tb3+ |
490, 500, 520 |
На основании предварительных опытов были выбраны длины волн, при которых имело место наибольшее различие в величинах оптических плотностей растворов нитрата, РЗЭ и этих же растворов, но с добавкой Н2Аnt. С этой целью после измерения величин оптических плотностей строили кривые светопоглощения растворов и находили по ним зависимость разностей величин оптических плотностей ∆А от длины волны λ.
Для дальнейших опытов выбирали длины волн, соответствующих максимумам или минимумам на последних кривых, либо близкие к ним значения (табл. 1).
Некоторые кривые, построенные по данным предварительных опытов, представлены на рис. 2.
Определение состава комплексов, образуемых ионами, выбранных нами РЗЭ с Н2Аnt, проводили при рН 4-9 методами молярных отношений и относительного выхода [6] постоянных значений рН для Pr3+(8-9) неодима (6,6-7,5) Eu3+(6,2-6,5), Gd3+(5,1-5,8), Tb3+(4,4-5,2). Концентрация ионов РЗЭ в растворах не превышала 1∙10-2М, ввиду того, что при больших ее значениях в некоторых случаях имело место выпадания гидрооксей.
Результаты опытов приведены в табл. 2. Кроме того, часть из них показано на рис. 2.

Рис. 1. Зависимость оптической плотности растворов комплексов РЗЭ с Н2Ant от рН: 1 – Сpr = 7∙10-4M (pH 7-8); λ = 580 nт, 2 – СNd = 6,9∙10-4M (pH 6,6-7,5); λ = 560 nт, 3 – СEu = 6,5∙10-4M (pH 6,4-6,6); λ = 510 nт, 4 – СGd = 6,4∙10-4M (pH 5,0-5,8); λ = 310 nт, 5 – СTb = 6,4∙10-4M (pH 4,4-5,1); λ = 520 nт

Рис. 2. Спектр поглощения: 1 – раствор Pr(NO3)3; 2 – раствор Pr(NO3)3+H2Ant(C Pr(NO3)3): = 1:6; 3 – ∆A = f(λ)
= 1:6; 3 – ∆A = f(λ)
Таблица 2
Определение состава комплексов (отношение ион РЗЭ:Н2Аnt) методом молярных отношений
|
Ионы РЗЭ |
РН-раствора |
РЗЭ:Н2Аnt |
|
Pr3+ |
7,0 – 8,0 |
1:3; 1:2,98; 1:3,08 |
|
Nd3+ |
6,6 – 7,5 |
1:3,05; 1:3,0; 1:3,10 |
|
Eu3+ |
6,4 – 6,6 |
1:2,96; 1:2,98; 1:3,05 |
|
Gd3+ |
5,0 – 5,80 |
1:3,0; 1:3,0; 1:2,94 |
|
Tb3+ |
4,4 – 5,1 |
1:3,0; 1:3,15; 1:2,96 |
Таким образом, было установлено, что ионы РЗЭ (Pr3+, Nd3+, Eu3+, Gd3+, Tb3+,), с анионами Н2Аnt при значениях рН 4,4-9,0 образуют комплексы с соотношением РЗЭ:Н2Аnt = 1:3 (для всех указанных ранее длин волн и рН раствора).
Было также проведено изучение серий растворов с постоянным содержанием лиганды и переменным центрального иона-празеодима при постоянном значении рН 8,0; неодима (6,6-7,5), европия рН 6-6,5; гадолиния рН 5-5,5; тербия рН 4-5.
Изучение данной серии было выполнено для выяснения возможности образования поля ядерных комплексов. В результате установлено, что полиядерных комплексов в условиях данного опыта не образуется.
Как уже упоминалось, в данной работе показана также возможность расчета константы нестойкости комплексов, образуемых ионами РЗЭ, не обладающими собственным светополощением.
Метод расчета предпологает исследование серии растворов с постоянным содержанием двух центральных ионов (окрашенного и неокрашенного) и переменным лиганды при постоянном значении рН (рис. 3). Константа нестойкости комплексного соединения окрашенного иона должна быть известна. Предполагаются известными также механизм комплексообразования и состав образующихся комплексов. Кроме того, окрашенный комплекс должен быть менее прочен, чем неокрашенный (рис. 3).
При увеличении концентрации комплексообразующего вещества в первую очередь связываются ионы РЗЭ, образующие более прочный комплекс. Постоянное значение оптической плотности достигается при полном связывании в комплекс ионов обоих РЗЭ. Как видно по графику на рис. 3 полученному нами для смеси нитратов празеодима и иттрия, на кривой А = f (ΣРЗЭ:Н2Ant) наблюдаются два излома. Первый из них отвечает связыванию в комплекс иттрия, второй – неодима.
В качестве примера была рассчитана константа нестойкости неокрашенного иттриевого комплекса. При рН, близком к 4,0 Н2Аnt практически всецело дислоцирована на однозарядные анионы НАnt–, и мы можем воспользоваться схемой комплексообразования, предложенной В.А. Назаренко [8].
 (1)
(1)
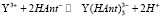 (2)
(2)
Константы равновесия реакций (1) и (2) будут иметь следующий вид:
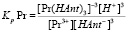 (3)
(3)
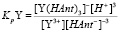 (4)
(4)
Запишем также уравнения материального баланса для иттрия, празеодима и комплексообразующего лиганда:
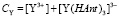 (5)
(5)
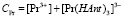 (6)
(6)
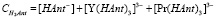 (7)
(7)
Из уравнений (5) и (7) находим.
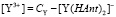 (8)
(8)
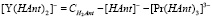 (9)
(9)

Рис. 3. Определение [РЗЭ] состава антролота РЗЭ методом молярных отношений. CРЗЭ = 6,4∙10-4M; pH 9-9; λ = 520-590 nm; l = 5 cm
Подставим в выражение для константы равновесия (4) величины равновесных концентраций:
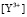 и
и 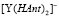 из (8) и (9)
из (8) и (9)
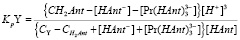 (10)
(10)
Найдя равновесную концентрацию анионов (HAnt–] из выражения для 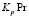 (3):
(3):
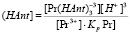
И подставив ее значение в выражение для KpY (10) получим:
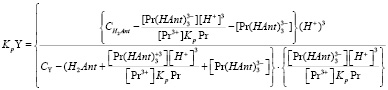 (11)
(11)
Величины равновесных концентраций 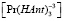 и
и 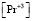 могут быть выражены (1, 2) через оптические плотности:
могут быть выражены (1, 2) через оптические плотности:
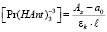 (12)
(12)
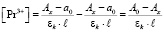 (13)
(13)
где a0 – оптическая плотность раствора нитрата РЗЭ без добавления комплексообразующего вещества;
А0 – максимальное значение оптической плотности, достигаемое при полном связывании РЗЭ в комплексе; Ах – текущее значение оптической плотности; εk – молярный коэффициент погашения комплексного соединения; l – длина кюветы в см.
Величина молярного коэффициента погашения комплекса εk может быть найдена по величине оптической плотности (А0-a0), отвечающей полному связыванию ионов празеодима в комплекс, имея в виду, что концентрация комплекса в этом случае будет равна известной общей концентрации празеодима СPr:
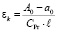 (14)
(14)
Нетрудно показать, что константа равновесия, константа нестойкости комплекса и константы диссоциации H2Ant на двойных ступенях (К2) связаны между собой следующим соотношением:
КР∙КН = К1∙К2 (15)
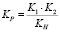 (16)
(16)
Использовав литературные данные относительно величины константы нестойкости празеодимого комплекса (4) и констант диссоциации H2Ant (5) найдем величину константы равновесия (КР):
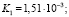
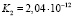 (17)
(17)
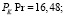
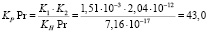
Подставив выражения для равновесных концентраций 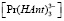 и
и  (12) и (13), молярного коэффициента погашения εK (14), а также найденное нами (17) численное значение KPPr в выражении для KPY (11), произведя несложные преобразования, получим:
(12) и (13), молярного коэффициента погашения εK (14), а также найденное нами (17) численное значение KPPr в выражении для KPY (11), произведя несложные преобразования, получим:
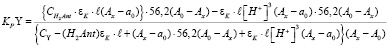
Данные произведенного нами опыта и результаты расчета величин, констант равновесия и нестойкости иттриевого комплекса представлены в табл. 3.
Таблица 3
Данные опыта по определению величин констант равновесия и нейкости иттриевого комплекса: рН 4,3; μ = 0,1; t ° = 20 °C; CY = CPr = 3∙10–3M; λ = 580 nm
|
|
|
Ах |
Аx-a0 |
|
|
|
|
примечание |
|
0 |
1:0,0 |
0,091 |
0,000 |
0,164 |
– |
– |
– |
Ах = 0,254 |
|
1,2 |
1:0,2 |
0,107 |
0,017 |
0,077 |
1,64 |
2,4∙10–18 |
6,63 |
|
|
2,4 |
1:0,4 |
0,118 |
0,022 |
0,136 |
3,52 |
5∙10–12 |
5,92 |
|
|
3,60 |
1:0,6 |
0,162 |
0,072 |
0,092 |
1,64 |
22,6∙10–18 |
16,65 |
|
|
4,80 |
1:0,8 |
0,245 |
0,155 |
0,009 |
0,117 |
32,2∙10–18 |
15,49 |
|
|
6,0 |
1:1,0 |
0,253 |
0,263 |
0,000 |
0,000 |
– |
– |
|
|
7,2 |
1:1,2 |
0,260 |
– |
– |
– |
– |
– |
|
|
8,4 |
1:1,4 |
0,253 |
– |
– |
– |
– |
– |
|
|
9,6 |
1:1,6 |
0,255 |
– |
– |
– |
– |
– |
|
|
10,80 |
1:1,8 |
0,246 |
– |
– |
– |
– |
– |
|
|
12,0 |
1:2,0 |
0,264 |
– |
– |
– |
– |
– |
|
|
14,40 |
1:2,6 |
0,251 |
– |
– |
– |
– |
– |
|
|
18,0 |
1:3,0 |
0,270 |
– |
– |
– |
– |
– |
Как видно, величина константы нестойкости иттриевого комплекса близко совпадает с литературными данными (4), при соотношении  т.е. когда
т.е. когда  .
.
Библиографическая ссылка
Гурбанов А.Н., Юсифова С.С. ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗОВАНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ С АНТРОЛОВОЙ КИСЛОТОЙ // Международный журнал прикладных и фундаментальных исследований. 2015. № 10-1. С. 57-61;URL: https://applied-research.ru/ru/article/view?id=7382 (дата обращения: 07.01.2026).








 = 0,090
= 0,090
 = 10,0 sm
= 10,0 sm
 = 5,46∙103
= 5,46∙103