Гуминовые кислоты (ГК) представляют собой нерегулярные сополимеры ароматических оксиполикарбоновых кислот, включающие карбоксильные, гидроксильные, метоксильные группы, наличие которых определяет их способность вступать в окислительно-восстановительные реакции и образовывать хелатные комплексы с экотоксикантами. На этом основывается защитная функция гуминовых веществ, поддерживающих равновесие в экосистемах при антропогенной нагрузке [1].
Реакционная способность ГК во многом определяется количеством и составом функциональных групп. Для повышения окислительно-восстановительных и хелатирующих свойств гуминовых препаратов используют направленную химическую модификацию, заключающуюся в обогащении гидрохинонными, пирокатехиновыми, орто- и пара-бензохинонными и другими хиноидными фрагментами путем конверсии фенолов в хиноны в щелочной среде или методом привитой сополимеризации с гидрохиноном, пирокатехином или п-бензохиноном [2, 3]. Препараты, полученные с использованием окислительных процессов, обычно оказываются более активными. В [4] показано, что защитное действие гуминовых веществ по отношению к растениям в условиях абиотических стрессов усиливается с введением хиноидных фрагментов в их структуру.
В процессе переработки торфа показана возможность окисления и активации ГК и получения на их основе высокоэффективных стимуляторов роста растений. В результате окислительно-гидролитических процессов в торфе происходит деструкция полисахаридов и протеинов, переход в жидкую фазу активированных ГК, обогащенных кислородсодержащими функциональными группами, меланоидинов, пектинов, аминокислот. Согласно этой технологии разработаны гуминовые препараты для растениеводства: оксидат торфа, гидрогумат и оксигумат [5, 6].
Один из эффективных способов целенаправленного изменения функционального состава ГК – механохимическая модификация, основанная на твердофазных превращениях веществ со специально подобранными реагентами. Немаловажную роль в этом процессе играет адсорбированная вода на поверхности ГК. Образующиеся в результате разрыва химических связей при механическом воздействии радикалы взаимодействуют во влажных образцах с молекулами воды, что приводит к уменьшению длины молекулярной цепи и накоплению гидроксилсодержащих фрагментов [7, 8].
Материалы и методы исследования
Объектами исследования являлись твердые каустобиолиты: бурый уголь и окисленный уголь. Бурый уголь характеризуется высокой зольностью 30% мас., в окисленном угле зольные элементы составляют 16% мас.
Механоактивация (МА) углей проводилась в мельнице-активаторе планетарного типа АГО-2С (разработка ИХТТМ СО РАН, г. Новосибирск) в нескольких режимах: МА без реагента, МА в присутствии 6, 8, 12% NaOH (чда), МА в присутствии 10% NaOH и 5% Na2CO3 ∙ 1.5H2O2. Технические характеристики мельницы-активатора АГО-2С: частота вращения барабанов – 1820 об/мин-1, центробежное ускорение – 600 м/с2. В качестве мелющих тел использовали стальные шары диаметром 8–10 мм. Масса шаров при загрузке одного барабана – 0.2–0.5 кг, навеска образца – 15–20 г, время обработки – 2 мин.
Гуминовые кислоты выделяли несколькими способами: из необработанных углей по методике Инсторфа – 0.1 н. NаОН при нагревании до 90оС в течение 1 часа; из механообработанных без реагентов углей – экстракцию проводили 0,1 н. NаОН при температуре 200С при перемешивании в течение 1 часа; из углей, механообработанных с NаОН – водой при температуре 20оС в течение 2 часов при перемешивании. Осаждение ГК осуществляли 10% НCl до рН=1-2.
Методом потенциометрического титрования гуматов натрия 0,1 н раствором соляной кислоты в областях рН 10 - 11, рН 6.9 – 9.5 и рН 2.5 – 6.0 установлено количество трех титруемых групп – фенольных гидроксилов, карбоксильных групп при ароматическом кольце и карбоксильных групп в углеводородных цепях. Во время титрования ГК ионная сила раствора поддерживалась на определенном уровне насыщенным раствором хлорида натрия [9]. Расчет точки эквивалентности проводили методом численной интерполяции.
Каталитические свойства препаратов ГК определялись на анализаторе «АОА» (г. Томск) вольтамперометрическим методом катодного восстановления кислорода с использованием ртутного пленочного электрода [9]. Фоновым электролитом являлся фосфатный буфер (рН 6,8). Навеска анализируемого вещества 5*10-3 г растворялась в 5 мл 0.1 н NaOH. В электрохимическую ячейку помещался раствор анализируемого вещества с концентрацией 10-4 % мас. и перемешивался при помощи магнитной мешалки. Вольтамперограммы фиксировались каждый раз после выдерживания исследуемого раствора при потенциале предельного тока ЭВ О2 (Е= -0.3 В для водных сред) в течение 3 минут. По результатам вольтамперограмм строились графики зависимости функции 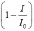 от времени протекания процесса в присут ствии одной концентрации ГК. По линейной части графика и по тангенсу угла наклона касательной к данному участку кривой рассчитывался кинетический критерий антиоксидантной активности (АОА) образцов – K, мкмоль/(л∙мин) по формуле:
от времени протекания процесса в присут ствии одной концентрации ГК. По линейной части графика и по тангенсу угла наклона касательной к данному участку кривой рассчитывался кинетический критерий антиоксидантной активности (АОА) образцов – K, мкмоль/(л∙мин) по формуле:
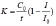
Таблица 1
|
Условия МА |
Содержание ГК, % мас. |
|
|
БУ |
ОУ |
|
|
Без МА |
33.8 |
53.1 |
|
МА без реагента |
36.9 |
55.4 |
|
МА + 6% NaOH |
11.4 |
47.8 |
|
МА + 8% NaOH |
29.2 |
57.3 |
|
МА + 12% NaOH |
41.4 |
70.2 |
|
МА + 10%NaOH + 5%Na2CO3 *1.5H2O2 |
55.9 |
80.4 |
Методом потенциометрического титрования гуматов натрия раствором HCl в областях рН 10 - 11, рН 6.9 – 9.5 и рН 2.5 – 6.0 установлено количество трех титруемых групп - фенольных гидроксилов ArOH, карбоксильных групп при ароматическом кольце ArСОOН и карбоксильных групп в углеводородных цепях CnCOOН. В табл. 2 приведено содержание кислых групп в ГК в зависимости от условий МА. В силу полиэлектролитного характера гуминовых кислот одним из основных факторов, влияющих на гидрофобность их молекул, является рН среды. По мере уменьшения рН в результате протонирования карбоксильных групп будет увеличиваться гидрофобность и усиливаться акцепторные свойства макромолекул. По результатам табл. 2 видно, что при МА бурого угля без реагента в функциональном составе ГК снижается, а в ГК из ОУ повышается содержание ArOH. Основным процессом превращения структуры ГК являются гидролиз, в результате которого происходит отщепление полисахаридной периферии, распад сложных эфиров, и окисление ароматического скелета. Соотношение наиболее устойчивого к превращениям ароматического скелета и полисахаридной периферии в значительной степени отражают изменения в структуре ГК. Немаловажную роль в этом процессе играет адсорбированная вода на поверхности ГК. Образующиеся в результате разрыва химических связей при механическом воздействии радикалы взаимодействуют с молекулами воды, что приводит к уменьшению длины молекулярной цепи и накоплению гидроксилсодержащих фрагментов. Влажность ОУ составляет 16.7% мас, а БУ – 6.8% мас.
Таблица 2
Влияние механоактивации углей на функциональный состав выделенных ГК
|
Условия МА |
Содержание, мг-экв/г |
|||||
|
БУ |
ОУ |
|||||
|
ArOH |
ArСОOН |
CnCOOН |
ArOH |
ArСОOН |
CnCOOН |
|
|
Без МА |
10.5 |
6.1 |
2.4 |
9.1 |
6.3 |
1.6 |
|
МА без реагента |
8.7 |
6.1 |
3.1 |
10.2 |
6.2 |
1.3 |
|
МА + 6% NaOH |
9.5 |
6.0 |
2.5 |
10.1 |
5.0 |
1.3 |
|
МА + 8% NaOH |
1.7 |
7.2 |
2.6 |
10.0 |
5.6 |
2.2 |
|
МА + 12% NaOH |
13.1 |
8.3 |
2.5 |
11.8 |
7.4 |
2.4 |
|
МА + 10%NaOH + 5%Na2CO3 *1.5H2O2 |
12.7 |
7.9 |
2.5 |
10.5 |
6.9 |
3.2 |
В функциональном составе ГК из БУ после механоактивации с добавками реагентов возрастает содержание фенольных гидроксилов и карбоксильных групп в ароматическом кольце. С увеличением количества NaOH в твердофазной механохимической реакции образования гуматов наблюдается рост общей кислотности ГК.
Для оценки каталитических свойств ГК и влияния на них механоактивации в качестве модельной реакции использован процесс электровосстановления (ЭВ) кислорода, протекающего по механизму, аналогичному восстановлению кислорода в живой клетке [9, 10]. Активные формы кислорода (АФК) постоянно образуются в живой клетке как продукты нормального метаболизма кислорода. Способствуют образованию АФК различные факторы, такие как действие ионизирующего излучения. Некоторые АФК могут играть роль медиаторов важных внутриклеточных сигнальных путей.
Из-за сложности состава ГК, наличия в них значительного количества функциональных групп, способных выполнять в определенных условиях роль ингибиторов или инициаторов процесса ЭВ кислорода, требуется более детальное изучение влияния ряда факторов на окислительно-восстановительные свойства препаратов.
На рис. приведены вольтамперограммы фонового электролита и с добавлением ГК, свидетельствующие об увеличении тока электровосстановления кислорода. При этом происходит сдвиг потенциала в сторону отрицательных значений. Поэтому критерий К имеют в данной области рН отрицательное значение.
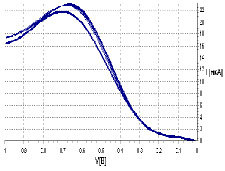
Вольтамперограммы фонового электролита с добавлением ГК
Сдвиг потенциала полуволны тока ЭВ О2 в отрицательную область позволил предположить наличие механизма с последующей реакцией диспропорционирования продукта реакции и частичной регенерацией деполяризатора – молекулярного кислорода [10]. Такой механизм является каталитическим или ферментативным. К данной группе веществ помимо ГК относятся: фермент антиоксидантной природы (каталаза), порфирины, фталоцианины металлов. Все эти вещества очень разные по своей природе объединяет одно общее свойство: они являются металлокомплексами, имея в своей структуре ионы переходных металлов. Это свойство может обусловливать каталитический характер влияния на процесс ЭВ О2.
Предполагается также, что функциональными группами, ответственными за реакции переноса электронов с участием ГК, являются хиноидные фрагменты, которые при одноэлектронном восстановлении образуют свободные радикалы [11, 12]. Хиноны, присоединяя один электрон, образуют семихиноновый анион-радикал, в кислой среде превращающийся в двухатомный фенол:
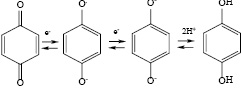
Помимо хиноидных фрагментов вклад могут вносить фенольные группы, окисляющиеся до феноксильных радикалов [13].
В табл. 3 приведены значения кинетического критерия К каталитической активности исследованных гуминовых кислот. При рН 9.5 независимо от способа выделения ГК в разной степени инициируют процесс электровосстановления кислорода. В сравнении со стандартным образцом гуминовых веществ Aldrich, для которого К = - 0.129, ГК, выделенные из необработанных углей, имеют более высокие значения критерия К.
Для ГК после механоактивации углей без реагента наблюдается некоторое снижение значения К, что отмечалось нами ранее и для других каустобиолитов в процессе механоактивации и связано с изменением состава ГК [9].
Таблица 3
Величина кинетического критерия К каталитической активности гуминовых кислот углей
|
Условия МА |
Условия экстракции ГК, ТоС, время час |
К, мкмоль/л* мин |
|
|
БУ |
ОУ |
||
|
Без МА |
0,1н NaOH 90оС, 1 час |
-0,271 |
-0,368 |
|
МА без реагента |
0,1н NaOH, 20оС, 1 час |
-0,164 |
-0,278 |
|
МА + 6% NaOH |
Н2О, 20оС, 2 час |
-0,257 |
-0,301 |
|
МА + 8% NaOH |
Н2О, 20оС, 2 час |
-0,297 |
-0,390 |
|
МА + 12% NaOH |
Н2О, 20оС, 2 час |
-0,568 |
-0,668 |
|
МА + 10%NaOH + 5%Na2CO3 *1.5H2O2 |
Н2О, 20оС, 2 час |
-0,610 |
-0,805 |
Гуминовые кислоты, выделенные из углей после механоактивации с 6% и 8% NaOH, характеризуются также невысокими значениями критерия К, что объясняется низкой концентрацией NaOH, не обеспечивающей полного выделения ГК и проведения деструктивно-гидролитических процессов, при которых возможно образование фрагментов, ответственных за перенос электронов. Механоактивация углей при повышении концентрации NaOH до 12% в присутствии окислителя приводит к существенному увеличению каталитической активности ГК.
В заключение следует отметить, что для получения гуминовых препаратов из углей одним из эффективных способов является интенсивная механоактивация твердых каустобиолитов. Результатом твердофазных реакций в щелочной среде является образование водорастворимых гуматов, изменение функционального состава ГК, возрастание степени окисленности ароматических фрагментов. Количество щелочного реагента должно соответствовать стехиометрии образования гуматов. Для снижения процесса осмоления реакцию следует проводить в присутствии окислителя, что приводит к обогащению ГК кислородсодержащими функциональными группами и повышению их каталитической активности в процессе электровосстановления кислорода.
Библиографическая ссылка
Буркова В.Н., Юдина Н.В., Мальцева Е.В., Савельева А.В. ВЛИЯНИЕ ТВЕРДОФАЗНОЙ МЕХАНОАКТИВАЦИИ НА ФУНКЦИОНАЛЬНЫЙ СОСТАВ ГУМИНОВЫХ КИСЛОТ ИЗ УГЛЕЙ // Международный журнал прикладных и фундаментальных исследований. 2015. № 9-1. С. 84-87;URL: https://applied-research.ru/ru/article/view?id=7444 (дата обращения: 15.12.2025).

