В современной литературе внутрикостную опухоль, построенную из гиалинового хряща, классифицируют как хондрому [4]. Согласно международной гистологической классификации костных опухолей ВОЗ, 2002 года, хондрома костей относится к доброкачественным хрящеобразующим костным опухолям. По частоте такие опухоли занимают второе место (20 %) среди всех доброкачественных новообразований скелета [9]. В 21,7–68,4 % случаев, течение хондроматозного процесса осложняется патологическим переломом пораженной кости, возникающим при незначительной физической нагрузке, зачастую являющимся клиническим дебютом опухоли [8].
В настоящее время в реконструктивно-восстановительной хирургии отдается предпочтение следующим видам оперативных вмешательств: резекции очага поражения в пределах здоровой ткани и замещению сформированного пострезекционного дефекта кортикально – губчатыми аутотрансплантатами [1].
Известно, что хондрома растет экспансивно, обычно не инфильтрируя в ткани [7]. Однако она склонна рецидивировать. По данным различных авторов рецидивы при оперативном лечении хондромы костей варьируют от 1,4 до 5,7 % [7]. При прогнозировании результата лечения необходимо учитывать, что клетки хондромы обладают большой способностью к имплантации. Известна их способность прорастать в сосуды и метастазировать, не меняя строения, свойственного доброкачественной форме данного образования [3].
В связи с этим возрастает роль гистологического исследования биопсийного материала пациентов с хондромами как с целью более точной диагностики, так и в плане возможности прогнозирования качества приживления и длительности срока перестройки пластического материала при замещении пострезекционного дефекта, а также развития рецидива.
Цель исследования – на основании результатов морфологического исследования хондром определить рациональный объем оперативного вмешательства и создания оптимальных условий для органотипической перестройки костнопластического материала в условиях чрескостного остеосинтеза, обозначить критерии возможного рецидивирующего развития опухолевого процесса.
Материалы и методы исследования
В клинике «РНЦ «ВТО им. акад. Г.А. Илизарова» с 1996 по 2015 годы было пролечено 76 больных с доброкачественными опухолевыми и опухолеподобными заболеваниями трубчатых костей. Возраст пациентов составил от 10 до 44 лет.
Показанием к оперативному вмешательству в виде внутрикостной резекции очагов поражения трубчатых костей было наличие у пациентов внутрикостного (чаще в области диафиза трубчатой кости) очага хрящеобразующей опухоли без вовлечения в патологический процесс суставного конца кости и без выраженных деструктивных изменений кортикального слоя, косметического дефицита оперируемого сегмента, а так же наличие стабильного внесуставной локализации патологического перелома без смещения. Больным была выполнена внутрикостная резекция патологического очага в пределах здоровых тканей и замещение пострезекционного дефекта трубчатой кости аутотрансплантатом либо костнопластическим материалом «КоллапАн» в условиях чрескостного остеосинтеза. У всех пациентов (100 %) пострезекционные дефекты трубчатых костей были замещены, после чего производили демонтаж аппаратов и удаление спиц. Клинико-рентгенологический диагноз был подтвержден гистологически у всех прооперированных пациентов.
В данном исследовании проанализирован резекционный материал, полученный при оперативном лечении 64 пациентов с энхондромами трубчатых костей.
Исследования проводились с соблюдением «Этических принципов проведения научных медицинских исследований с участием человека» и в соответствии с «Правилами клинической практики в Российской Федерации». Все пациенты подписали информационное согласие на публикацию данных проведенных исследований без идентификации личности.
Фрагменты резецированных во время операции тканей фиксировали в 10 % растворе нейтрального формалина, декальцинировали, дегидратировали в спиртах восходящей концентрации (от 70 ° до абсолютного) и заливали в парафин. Гистологические срезы толщиной 5–7 мкм готовили на санном микротоме фирмы «Reichard» (Германия). Срезы окрашивали гематоксилином Вейгерта и эозином. Световую микроскопию гистологических препаратов осуществляли с использованием микроскопа марки «Микмед-5» фирмы «ЛОМО» (Россия). Получение иллюстративного материала осуществляли путем оцифровывания изображений полей зрения гистологических препаратов с использованием большого исследовательского фотомикроскопа фирмы «Opton» (Германия) и аппаратно-программного комплекса «ДиаМорф» (Россия).
Результаты исследования и их обсуждение
В обозначенных 64 случаях были верифицированы доброкачественные (или зрелые) опухоли, представленные участками гиалинового хряща с выраженным тканевым атипизмом (рис. 1, а, б), граничащие с деструктивно измененной компактной пластинкой. Так как очаг деструкции был локализован внутри кости, опухоли классифицировали как энхондромы.
Резецированные опухоли чаще всего представляли собой образование дольчатой структуры, где гиалиновая хрящевая ткань была разделена прослойками плотной соединительной ткани, граничащей с трабекулами губчатой кости. Дольчатость строения в литературе объясняется диффузным типом питания хондромы [7].
Фрагменты хрящевой ткани состояли из беспорядочно расположенных зрелых хондроцитов, заключенных в основное вещество, окрашенное чаще всего слабо базофильно.
У некоторых пациентов наблюдали выраженную базофилию межклеточного вещества, что свидетельствовало о малом содержании в матриксе хряща кислых и слабокислых гликозаминоглианов. Нарушалась его гомогенность. Отмечали умеренный полиморфизм клеточного состава (рис. 2, а–в).
Если участок опухоли был окружен капсулой соединительнотканного строения – в составе хондромного образования чаще определялись клетки веретеновидной формы (рис. 3, а, б).
Хондроциты содержали объемное эллипсовидное ядро и оксифильную цитоплазму, были радиально расположены внутри каждой дольки.
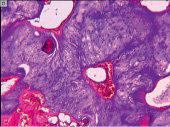
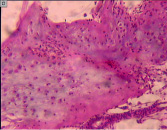
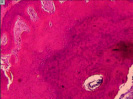
а б
Рис. 1. Участки очагов деструкции, обнаруженные: на уровне основной фаланги V пястной кости правой кисти (А); на уровне IV пястной кости левой кисти (Б). Препараты окрашены гематоксилином и эозином. Увеличение: А – 25х; Б – 40х
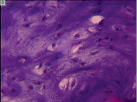
а б в
Рис. 2. Разная выраженность базофилии межклеточного матрикса, полиморфизм хрящевых клеток. Препараты окрашены гематоксилином и эозином. Увеличение: а, б – 63х; в – 160х
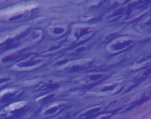
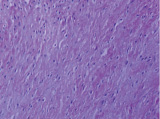
а б
Рис. 3. Состав хондромного образования, ограниченного соединительнотканной капсулой: а – хрящевые клетки веретеновидной формы; б – соединительная ткань капсулы хондромы. Препараты окрашены гематоксилином и эозином. Увеличение: а – 400х; б – 100х
Плотность хондроцитов в отдельных участках опухоли была различной. В плане прогноза малигнизации хондромы – этот вариант опухоли, контактно изолированной от окружающих тканей бессосудистой волокнистой соединительной тканью, является благоприятным, так как создается определенный тканевой барьер между опухолью и индуцирующими ее рост факторами внутренней среды организма, препятствующий миграции новых малодифференцированных клеток [7].
Независимо от возраста пациентов, в составе каждой доли опухолевого образования размеры и количество хондроцитов сильно варьировали. В центральных областях опухоли определяли как более крупные одиночные клетки, так и 2-х, 3-х, 4-х членные изогенные группы гипертрофированных хондроцитов с вакуолизированной цитоплазмой. Степень дифференцированности хондроцитов повышалась от центра доли опухоли к периферии.
В некоторых случаях наблюдали участки слизистого перерождения межуточной субстанции, где хрящевые клетки веретенообразной или звездчатой формы были заключены в ослизненное межуточное вещество. Встречались участки деструктурированной субстанции, очаги некроза.
Участки хрящевой ткани опухоли, граничащие непосредственно с губчатой костью в месте перехода, отличались большей базофильной окраской, хрящевые клетки располагались достаточно плотно, без образования изогенных групп (рис. 4, а). Ткань, формирующаяся на границе с хондромой, имела промежуточное строение между остеоидом и хондроидом. Межклеточный матрикс был окрашен достаточно гомогенно.
Хрящевые клетки располагались в лакунах, имели чаще округлую форму, и крупное, центрально расположенное ядро, большее либо равное объему, занимаемому цитоплазмой.
Граничащая с зоной гипертрофированных хондроцитов костная ткань отличалась редко расположенными остеоцитами с пикнотически измененными ядрами, находящимися в узких лакунах. В ней обнаруживали большое количество пустых лакун (рис. 4, б). Отсутствие кровеносных сосудов в пограничных зонах, наблюдаемое на препаратах, являлось неблагоприятным фактором в плане замедления прогрессии опухоли.
В более удаленных от опухоли участках кости отмечали клетки, дифференцирующиеся в остеогенном направлении (рис. 4, в).
В некоторых случаях костные трабекулы на границе с соединительнотканной капсулой имели остеоидное строение, образуя трабекулярную сеть и формируя новообразованный слой губчатой кости.
На некоторых гистологических препаратах обнаруживали участки сохраненного эндоста, что с одной стороны препятствовало остеонекрозу и сохраняло гомеостаз неорганических веществ, с другой – способствовало активной остеокластической резорбции кортикальной пластинки, обеспечивая разрастание хрящевой ткани, ее экспансию в кость, что в плане развития заболевания являлось неблагоприятным фактором [2].
Встречались случаи атрофии и остеопороза прилежащей кости (рис. 4, г), иногда в ней выявляли фрагменты с признаками некроза (рис. 4, д).

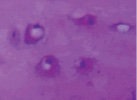
а б в
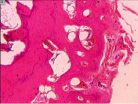
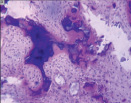
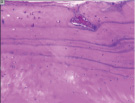
г д е
Рис. 4. Гистоструктурные особенности зоны перехода опухоли в прилегающие ткани и в корковом слое пястных костей, непосредственно прилежащих к очагу деструкции: а – граница собственно костной ткани кортикальной пластинки фаланги пальца кисти и хондромы; б – измененная костная ткань; в – малодифференцированные клетки, с признаками остеогенной дифференцировки; г – выраженность остеопороза; д – участки некроза и лизиса костной ткани; е – участок пластинчатой костной ткани кортикальной пластинки (крайняя область резекции). Препараты окрашены гематоксилином и эозином. Увеличение: а, д, е – 63х; б – 400х; в – 1000х
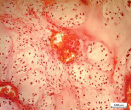
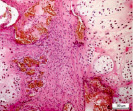
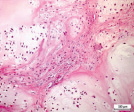
а б в
Рис. 5. Гистоструктурные особенности опухоли ключичной кости, имеющей начальные признаки возможного перерождения хондромы хондросаркому G1: а – обилие кровеносных сосудов, врастание опухолевого комплекса в сосудистый просвет; б – гиперплазия стромального мелкоклеточного компонента опухоли в котором определяются очаги хондроидной дифференцировки, формирование многочисленных микрососудов и сосудистых щелей; в – выраженная хондроидная дифференцировка в междольковой строме опухоли. Препараты окрашены гематоксилином и эозином. Увеличение:а,б,в – 250х
На границе резецированных опухолей в большинстве гистологических препаратов определяли участки неизмененной пластинчатой кости, сохраняющей остеонное строение и имеюших микрососуды (рис. 4, е), что с позиций использования костных трансплантатов и успешности их приживления является перспективным, поскольку сохраняется возможность ангиогенеза и ремоделирования костной ткани (наличие клеток остеобластического и остеокластического дифферонов) на основе имплантата в соответствии с прилагаемыми векторами механической нагрузки [2].
Несмотря на многолетний накопленный опыт в патоморфологической диагностике значительные трудности до настоящего времени представляет процесс малигнизации хондром и определение признаков формирования хондросарком гистологической классификации G1.
Мы располагаем наблюдением одного случая хрящевой опухоли ключичной кости, который, по нашему мнению отражает начальные признаки пограничного или переходного состояния «перерождения» хондромы в хондросаркому G1 (рис. 5, а–в). Данное наблюдение характеризуется разной величиной долек опухоли, выраженной васкуляризацией с признаками врастания опухолевых масс в просвет тонкостенных сосудов (рис. 5, а), различной клеточностью в дольках (рис. 5, б) и гиперплазией междольковой стромы опухоли с очагами хондроидной дифференцировки (рис. 5, в). При этом характерных проявлений злокачественного процесса в виде клеточного и ядерного атипизма, наличия митотической активности не определялось. Перечисленные признаки характеризуют прогрессирование опухолевого роста, что может свидетельствовать об одном из вариантов пограничного этапа перехода энхондромы в хондросаркому квалификации G1.
В известной литературе одним из признаков отличия энхондромы от хондросаркомы отмечено выраженное чередование хряща и губчатой кости [6].
Т.П. Виноградовой была отмечена способность тканевого субстрата хондром прорастать в сосуды и метастазировать, не меняя строения, свойственного доброкачественной форме данного образования [3]. Обозначенные факты соотносятся с полученными нами результатами и требуют дополнительного диагностического обследования пациентов с подобной гистологической картиной резецированной опухоли для определения дальнейшей тактики лечения.
Таким образом, проведенное гистологическое исследование показало, что во всех исследованных случаях обнаружен тканевой атипизм и умеренный клеточный полиморфизм, что характерно для доброкачественных или зрелых опухолей. Выявлено нарушение органо- и гистотипической дифференцировки резецированного участка кости. Дифференцированность структур в хондрогенном направлении, экспансивный рост опухоли, ее внутрикостная локализация позволили верифицировать опухоли как энхондромы. Отмечено, что остеокластическая резорбция обеспечивает разрастание хрящевой ткани опухоли и ее экспансию в кость, что в плане развития заболевания является неблагоприятным фактором, также как и отсутствие кровеносных сосудов в пограничных зонах (имеется в виду измененная костная ткань).
Изоляция опухоли от окружающих тканей бессосудистой волокнистой соединительной тканью создает определенный тканевой барьер, препятствующий миграции новых малодифференцированных клеток.
Выраженная васкуляризация с признаками врастания опухолевых масс в просвет тонкостенных сосудов междольковой стромы опухоли может служить критерием неблагоприятного прогноза развития заболевания (возможного перерождения опухоли в злокачественную форму).
Заключение
В связи с вариативностью гистологической картины резецированной хондромы и обнаруженными выраженными изменениями костной ткани компактной пластинки на границе с хондромой следует, что удаление костной опухоли необходимо осуществлять с захватом неизмененной (интактной) кости (выполнение внутрикостной резекции, а не экскохлеации), что обеспечивает исключение рецидивов заболевания в виде дальнейшего прогрессирования роста хондром, а также является адекватным вариантом подготовки реципиентной зоны пострезекционного дефекта для костнопластического его замещения. Выявленные критерии неблагоприятного развития заболевания являются показанием для расширенного диагностического обследования пациентов.
Библиографическая ссылка
Горбач Е.Н., Мигалкин Н.С., Моховиков Д.С. ПАТОМОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ДОБРОКАЧЕСТВЕННЫХ ХОНДРОИДНЫХ ОПУХОЛЕЙ ТРУБЧАТЫХ КОСТЕЙ КАК ПРОГНОСТИЧЕСКИЕ КРИТЕРИИ, ОПРЕДЕЛЯЮЩИЕ ХИРУРГИЧЕСКУЮ ТАКТИКУ ЛЕЧЕНИЯ // Международный журнал прикладных и фундаментальных исследований. 2015. № 10-3. С. 507-512;URL: https://applied-research.ru/ru/article/view?id=7532 (дата обращения: 08.02.2026).

