Введение
Инфекционные заболевания являются одной из самых серьезных проблем современного здравоохранения. В настоящее время доля вирусных инфекций в структуре общей инфекционной заболеваемости составляет около 90%. Традиционные терапевтические стратегии используют в качестве мишеней химиотерапевтического воздействия специфические вирусные белки, ответственные за ключевые этапы вирусной репродукции. Основные недостатки этих подходов заключаются в том, что для лечения вирусных заболеваний используется большое число лекарственных средств, специфических только для определенного вируса [3]. Кроме того, в силу высокого темпа и высокой частоты ошибок репликации, вирусы быстро мутируют, и это неизбежно приводит к появлению их лекарственно устойчивых вариантов. Это обстоятельство вынуждает постоянно искать ингибиторы новых поколений для того, чтобы опережать развитие резистентности [8].Ограниченная емкость геномов вирусов требует для их репликации использования многочисленных клеточных факторов (ферментов, клеточных органелл и структур) [4]. В связи с этимперспективным направлением является поиск таких противовирусных агентов, которые используют исключительно их в качестве мишеней. Известно, что оболочечные вирусы (ВИЧ, ВГС, вирус гриппа, вирус Эбола, аренавирусы) окружают свои нуклеокапсиды липидной мембраной, которую они получают при отпочковывании вириона от клетки-хозяина. Для того, чтобы инфицировать клетку-мишень, такие вирусы должны пройти этот процесс в обратном порядке и слить свою мембрану с клеточной. Этому шагу способствуют некоторые отличия состава вирусной мембраны от клеточной: наличие в вирусной мембране гликопротеинов, опосредующих процесс слияния, которые активируются при взаимодействии с конкретным клеточным рецептором (или несколькими клеточными рецепторами) и/или кислым значением рН среды в эндосомах [9].
Недавно был описан класс клиновидных жестких амфипатических ингибиторов слияния, способных блокировать инфекционность неродственных оболочечных вирусов через придание положительного искривления их липидным мембранам. Данные соединения способны противодействовать хорошо сбалансированному действию вирусных гликопротеинов через липидную фазу без непосредственного взаимодействия с вирусными белками. Нуклеозидные аналоги, содержащие в своей структуре периленовый фрагмент, связанный ацетиленовым мостиком с 2’-дезоксиуридином (1) и 1-(β-D-арабинофуранозил)урацилом (2), не ингибировали прикрепления вируса к клеточному рецептору, но блокировали стадию, предшествующую входу вируса в клетку. Было обнаружено, что соединения взаимодействуют с гидрофобными структурами в мембране вирионов и блокируют образование отрицательной кривизны, необходимой для слияния вируса с клеткой. Было показано, что эти соединения подавляют инфекционность оболочечных вирусов в наномолярных концентрациях, включая такие важные патогены человека, как вирус гриппа А H1N1 и H3N2, ВГС, вирус Синдбис, ВВС, ВГП-1, ВГП-2 и ЦМВ. В противоположность этому, они не влияли на инфекционность вирусов, не имеющих липидной оболочки (полиовирус, аденовирус или реовирус) [2].
В литературе был описан ряд производных урацила, содержащих в положении 3 остатка урацила 3,5-диметилбензильный фрагмент. Данные соединения проявили выраженный ингибиторный эффект как в отношении ЦМВ, так и ВИЧ-1 [5]. Нами также был обнаружен ряд 1-циннамил-3-бензилпроизводных урацила, которые были активны в отношении этих оболочечных вирусов [7]. Недавно нами были описаны 1-[5-(фенокси)пентил]производные урацила, проявшие мощную анти-ЦМВ активность [6].
Представленные данные подтверждают возможность создания новых противовирусных препаратов, которые были бы способны действовать на широкий ряд вирусов, и механизм действия которых был бы основан на некоторых общностях жизненного цикла вируса, а не на блокировании функций конкретных вирусных ферментов.
Цель исследования
Поиск новых противовирусных агентов широкого спектра действия на основе 1-[5-(фенокси)пентил]производных урацила, содержащих в положении 3 пиримидинового цикла (антрацен-9-ил)метильный заместитель.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254» (Германия), используя в качестве элюента этилацетат (А) или смесь этилацетат – 1,2-дихлорэтан (1:1) (Б). Пластины проявляли с помощью УФ-лампы VL-6.LC (Франция). Для флэш-хроматографии использовали силикагель Kieselgel 60-200 μm, 60 A (Acros Organics). Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
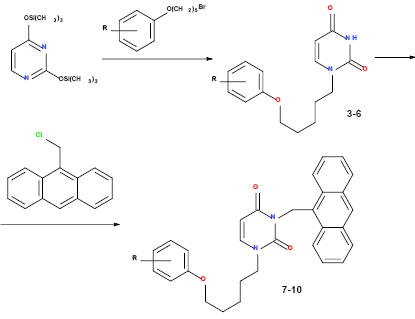
Общий метод получения 1-[5-(фенокси)пентил]производных урацила (3-6). Смесь 1,0 г (8,92 ммоль) урацила и 0,15 г (2,80 ммоль) хлорида аммония кипятят в 20 мл гексаметилдисилазана в течение 12 ч с защитой от влаги воздуха до образования прозрачного раствора. Избыток ГМДС удаляют при пониженном давлении, к остатку добавляют эквимолярное количество соответствующего 1-бром-5-(фенокси)пентана, нагревают с защитой от влаги воздуха при 160-170 °С в течении 1 ч и оставляют на ночь при комнатной температуре. К реакционной массе добавляют 40 мл этилацетата и 10 мл изопропилового спирта, перемешивают 30 мин при комнатной температуре, фильтруют, фильтрат упаривают в вакууме досуха, остаток растворяют в 10 мл хлороформа хроматографируют на колонке с силикагелем, элюируя смесью хлороформ - метанол (10:1). Фракции, содержащие целевой продукт, объединяют, упаривают в вакууме и кристаллизуют из смеси изопропиловый спирт – ДМФА (1:1).
1-[5-(Фенокси)пентил]урацил (3). Выход 88%, Т. пл. 151-153 оC, Rf 0,53 (А). Спектр 1H ЯМР, δ, м. д.: 1,39 квин (2H, J = 5,3 Гц, CH2); 1,63 квин (2H, J = 7,2 Гц, CH2); 1,72 квин (2H, J = 7,2 Гц, CH2); 3,67 т (2H, J = 7,2 Гц, NCH2); 3,93 т (2H, J = 6,5 Гц, OCH2); 5,55 дд (1H, J = 7,7 и 2,1 Гц, H-5); 6,89-6,92 м (3H, H-2’, H-4’, H-6’); 7,26 т (2H, J = 8 Гц, H-3’, H-5’); 7,64 д (1H, J = 7,8 Гц, H-6); 11,25 с (1H, NH). Спектр 13C ЯМР, δ, м. д.: 22,9; 28,6; 28,7; 47,8; 67,5; 101,2; 114,8; 120,8; 129,9; 146,2; 151,4; 159,3; 164,3.
1-[5-(2-Бромфенокси)пентил]урацил (4). Выход 70%, Т. пл. 149-150,5 оС, Rf 0,38 (А). Спектр 1H ЯМР, δ, м. д.: 1,43 квин (2H, J = 7,6 Гц, CH2); 1,64 квин (2H, J = 7,4 Гц, CH2); 1,75 квин (2H, J = 7,3 Гц, CH2); 3,67 т (2H, J = 7,2 Гц, NCH2); 4,02 т (2H, J = 6,2 Гц, OCH2); 5,54 дд (1H, J = 7,8 и 2,0 Гц, H-5); 6,86 т (1H, J = 6,8 Гц, Н-4’); 7,07 д (1H, J = 8,2 Гц, H-6’); 7,31 т (1H, J = 7,0 Гц, H-5’); 7,54 дд (1H, J = 7,9 и 1,4 Гц, H-3’); 7,65 д (1H, J = 7,8 Гц, H-6); 11,23 с (1H, NH). Спектр 13C ЯМР, δ, м. д.: 25,7; 31,5; 31,50; 50,7; 71,6; 104,2; 114,4; 117,1; 125,2; 132,3; 136,3; 149,1; 154,3; 158,1; 167,1.
1-[5-(3-Бромфенокси)пентил]урацил (5). Выход 82%, Т. пл. 124,5-126 оC, Rf 0,42 (А). Спектр 1H ЯМР, δ, м. д.: 1,38 квин (2H, J = 7,6 Гц, CH2); 1,62 квин (2H, J = 7,5 Гц, CH2); 1,71 квин (2H, J = 7,5 Гц, CH2); 3,66 т (2H, J = 7,2 Гц, NCH2); 3,97 т (2H, J = 6,5 Гц, OCH2); 5,53 дд (1H, J = 7,8 и 2,2 Гц, H-5); 6,93 дд (1H, J = 8,3 и 2,2 Гц, H-6’); 7,06-7,14 м (2H, H-2’, H-4’); 7,22 т (1H, J = 8,2 Гц, H-5’); 7,65 д (1H, J = 7,8 Гц, H-6); 11,22 с (1H, NH). Спектр 13C ЯМР, δ, м. д.: 22,6; 28,4; 47,6; 67,9; 101,1; 114,3; 117,5; 122,4; 123,6; 131,5; 146,0; 151,3; 160,0; 164,1.
1-[5-(4-Бромфенокси)пентил]урацил (6). Выход 76%, Т. пл. 125-127 оC, Rf 0,50 (А). Спектр 1H ЯМР, δ, м. д.: 1,39 квин (2H, J = 8,3 Гц, CH2); 1,62 квин (2H, J = 7,2 Гц, CH2); 1,71 квин (2H, J = 7,2 Гц, CH2); 3,66 т (2H, J = 7,2 Гц, NCH2); 3,92 т (2H, J = 6,3 Гц, OCH2); 5,55 дд (1H, J = 7,8 и 2,2 Гц, H-5); 6,87 д (2H, J = 9 Гц, H-3’, H-5’); 7,41 д (2H, J = 8,9 Гц, H-2’, H-6’); 7,64 д (1H, J = 7,8 Гц, H-6); 11,23 с (1H, NH). Спектр 13C ЯМР, δ, м. д.: 22,8; 28,6; 47,8; 68,0; 101,3; 112,2; 117,1; 132,5; 146,2; 151,4; 158,3; 164,3.
Общий метод получения 1-[5-(фенокси)пентил]-3-[(антрацен-9-ил)метил]-производных урацила (7-10). Смесь 1,70 ммоль соответствующего 1-[5-(фенокси)-пентил]урацила (3-6) и 0,35 г (2,53 ммоль) безводного карбоната калия перемешивают в 10 мл ДМФА при температуре 80-85 оС в течение 1 ч, охлаждают до комнатной температуры, добавляют 0,4 г (1,76 ммоль) 9-хлорметилантрацена, перемешивают в течение 24 ч, фильтруют и фильтрат упаривают в вакууме. Остаток растворяют в смеси этилацетат – гексан (1:3), фильтруют через слой силикагеля на фильтре Шотта (3 × 3 см), после чего сорбент промывают этилацетатом. Элюат, содержащий продукт, упаривают при пониженном давлении, остаток кристаллизуют из смеси этилацетат – гексан (1:1).
1-[5-(Фенокси)пентил]-3-[(антрацен-9-ил)метил]урацил (7). Выход 66%, Т. пл. 126-127 оC, Rf 0,76 (Б). Спектр 1H ЯМР, δ, м. д.: 1,25 квин (2H, J = 5,6 Гц, CH2); 1,52 квин (2H, J = 7,3 Гц, CH2); 1,60 квин (2H, J = 7,6 Гц, CH2); 3,57 т (2H, J = 7,1 Гц, NCH2); 3,81 т (2H, J = 6,3 Гц, OCH2); 5,70 д (1H, J = 7,8 Гц, H-5); 6,00 с (2Н, СН2); 6,83-6,87 м (3H, H-2’, H-4’, H-6’); 6,90 тд (1Н, J = 6,4 и 1,0 Гц); 7,26 тд (2H, J = 8,5 и 1,2 Гц, H-3’, H-5’); 7,43-7,53 м (5Н); 7,64 д (1H, J = 7,8 Гц, H-6); 8,04 д (2H, J = 8,1 Гц); 8,46 д (2H, J = 8,8 Гц), 8,52 с (1Н, H-10”). Спектр 13C ЯМР, δ, м. д.: 22,6; 28,3; 28,5; 38,1; 48,7; 67,3; 100,4; 114,7; 120,7; 125,1; 125,2; 126,0; 127,9; 129,1; 129,2; 129,8; 130,8; 131,2; 144,6; 151,5; 158,9; 163,4.
1-[5-(2-Бромфенокси)пентил]-3-[(антрацен-9-ил)метил]урацил (8). Выход 76%, Т. пл. 121,5-123 оC, Rf 0,76 (Б). Спектр 1H ЯМР, δ, м. д.: 1,30 квин (2H, J = 7,8 Гц, CH2); 1,55 квин (2H, J = 7,1 Гц, CH2); 1,64 квин (2H, J = 7,3 Гц, CH2); 3,58 т (2H, J = 7,1 Гц, NCH2); 3,91 т (2H, J = 6,3 Гц, OCH2); 5,70 д (1H, J = 7,9 Гц, H-5); 6,00 с (2Н, СН2); 6,86 т (1H, J = 7,6 Гц, Н-4’); 7,02 д (1H, J = 8,3 и 1,3 Гц, H-6’); 7,31 тд (2H, J = 8,8 и 1,5 Гц, H-5’); 7,43-7,50 м (5Н); 7,54 дд (1Н, J = 7,9 и 1,5 Гц, H-3’); 7,65 д (1H, J = 7,8 Гц, H-6); 8,04 д (2H, J = 8,8 Гц); 8,45 д (2H, J = 8,8 Гц); 8,53 с (1Н, H-10”). Спектр 13C ЯМР, δ, м. д.: 22,5; 28,25; 28,33; 38,1; 48,7; 68,5; 100,4; 111,4; 114,0; 122,2; 125,2; 126,0; 127,9; 129,1; 129,2; 129,3; 130,7; 131,2; 133,2; 144,6; 151,5; 155,0; 163,4.
1-[5-(3-Бромфенокси)пентил]-3-[(антрацен-9-ил)метил]урацил (9). Выход 70%, Т. пл. 131-132,5 оC, Rf 0,77 (Б). Спектр 1H ЯМР, δ, м. д.: 1,22 квин (2H, J = 7,8 Гц, CH2); 1,51 квин (2H, J = 7,3 Гц, CH2); 1,58 квин (2H, J = 7,6 Гц, CH2); 3,56 т (2H, J = 7,1 Гц, NCH2); 3,81 т (2H, J = 6,4 Гц, OCH2); 5,70 д (1H, J = 7,8 Гц, H-5); 5,99 с (2Н, СН2); 6,87 дд (1H, J = 8,3 и 2,2 Гц, H-6’); 7,07-7,09 м (2H, H-2’, H-4’); 7,21 т (1H, J = 8,0 Гц, H-5’); 7,43-7,50 м (4Н, H-2”, H-3”, H-6”, H-7”); 7,63 д (1H, J = 7,5 Гц, H-6); 8,03 д (2H, J = 9,3 Гц, H-1”, H-8”); 8,46 д (2H, J = 8,6 Гц, H-4”, H-5”); 8,51 c (1H, H-10”). Спектр 13C ЯМР, δ, м. д.: 22,5; 28,28; 28,32; 38,1; 48,7; 67,8; 100,4; 114,2; 117,5; 122,4; 123,6; 125,1; 125,2; 126,0; 127,9; 129,1; 129,2; 130,7; 131,2; 131,5; 144,6; 151,5; 159,9; 163,3.
1-[5-(4-Бромфенокси)пентил]-3-[(антрацен-9-ил)метил]урацил (10). Выход 79%, Т. пл. 159,5-160,5 оC, Rf 0,78 (Б). Спектр 1H ЯМР, δ, м. д.: 1,31 квин (2H, J = 6,8 Гц, CH2); 1,59 квин (2H, J = 7,6 Гц, CH2); 1,67 квин (2H, J = 7,6 Гц, CH2); 3,54 т (2H, J = 7,1 Гц, NCH2); 3,77 т (2H, J = 6,1 Гц, OCH2); 5,68 д (1H, J = 7,8 Гц, H-5); 6,13 с (2Н, СН2); 6,72 д (1H, J = 8,8 Гц, H-3’, H-5’); 6,93 т (1H, J = 7,6 Гц, H-6); 7,37 д (2H, J = 8,8 Гц, H-2’, H-6’); 7,45 т (2H, J = 6,8 Гц, H-3”, H-6”); 7,54 т (2H, J = 6,8 Гц, H-2”, H-7”); 7,98 д (2H, J = 8,3 Гц, H-1”, H-8”); 8,41 c (1H, H-10”); 8,53 д (2H, J = 9,1 Гц, H-4”, H-5”). Спектр 13C ЯМР, δ, м. д.: 22,7; 28,4; 28,5; 38,4; 49,2; 67,4; 101,3; 112,6; 116,1; 124,6; 124,7; 125,8; 127,9; 128,2; 129,0; 131,0; 131,2; 132,1; 142,1; 151,3, 163,5.
Результаты исследования и их обсуждение
Синтез целевых соединений был осуществлен путем конденсации эквимолярных количеств 2,4-бис(триметилсилилокси)пиримидина, который получали путем кипячения исходного урацила в избытке гексаметилдисилазана, с соответствующими 1-бром-5-(фенокси)пропанами при температуре 160-170 °С в течение 1 ч с защитой от влаги воздуха без использования какого-либо растворителя в соответствии с ранее описанным методом [1]. При этом образовывались исключительно N1-монозамещенные 1-[5-(фенокси)пентил]-производные урацила 3-6, выход которых составил 70-88%. Последующее N3-алкилирование соединений 3-6 9-(хлорметил)антраценом в растворе ДМФА в присутствии карбоната калия привело к целевым 1-[5-(фенокси)пентил]-3-[(антрацен-9-ил)метил]производным урацила 7-10 с выходом 66-79%.
Таблица 1
Выход и физико-химические свойства синтезированных соединений
|
Соединение |
R |
Выход, % |
Т.пл., °С |
Rf |
|
3 |
H |
88 |
151-153 |
0,53 (А) |
|
4 |
2-Br |
70 |
149-150,5 |
0,38 (А) |
|
5 |
3-Br |
82 |
124,5-126 |
0,42 (А) |
|
6 |
4-Br |
76 |
125-127 |
0,50 (А) |
|
7 |
H |
66 |
126-127 |
0,76 (Б) |
|
8 |
2-Br |
76 |
121,5-123 |
0,76 (Б) |
|
9 |
3-Br |
70 |
131-132,5 |
0,77 (Б) |
|
10 |
4-Br |
79 |
159,5-160,5 |
0,78 (Б) |
Полученные производные антрацена 7-10 представляют собой белые кристаллические вещества, практически не растворимые в воде, растворимые в спирте, ДМСО и других органических растворителях. Физико-химические свойства новых веществ представлены в табл. 1.
Выводы
Синтезировано четыре новых, ранее не описанных в литературе 1-[5-(фенокси)пентил]производных урацила, содержащих в положении 3 пиримидинового цикла фрагмент антрацена, связанный с атомом азота N3 коротким метиленовым мостиком. Изучены спектральные и физико-химические свойства полученных соединений. Новые производные урацила представляют значительный интерес в качестве потенциальных противовирусных агентов широкого спектра действия.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 15-44-02299 р_поволжье_а.
Библиографическая ссылка
Парамонова М.П., Озеров А.А., Новиков М.С. СИНТЕЗ АНТРАЦЕНОВЫХ ПРОИЗВОДНЫХ 1-[5-(ФЕНОКСИ)ПЕНТИЛ]УРАЦИЛА КАК ПОТЕНЦИАЛЬНЫХ ПРОТИВОВИРУСНЫХ АГЕНТОВ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ // Международный журнал прикладных и фундаментальных исследований. 2015. № 9-4. С. 741-744;URL: https://applied-research.ru/ru/article/view?id=7587 (дата обращения: 11.02.2026).

