Костная ткань – сложная динамическая структура, состоит из определенной комбинации специализированных клеток, сосудов и межклеточного вещества, которые претерпевают непрерывное ремоделирование в процессах физиологической и репаративной регенерации. В попытках воздействовать на эти процессы применяются различные материалы, обладающие остеоиндуктивными и остеокондуктивными свойствами: аутотрансплантаты, материалы, обогащенные культивируемыми аутогенными детерминированными костными клетками, содержащие факторы роста, стимулирующие процессы пролиферации и дифференцировки остеогенного пула костной ткани и выполняющие роль матрицы, вдоль которой происходит новообразование кости [1]. Основная проблема этих исследований сводится к биосовместимости материала имплантата и ткани. Приживление и функционирование имплантата зависит от реакции окружающей ткани, обуславливающей быстрое заживление раны и последовательность стадий остеогенеза. Особое внимание уделяется разработке пористых поверхностных структур, увеличивающих площадь соединения материала с тканью и усиливающих механический эффект сцепления в зоне контакта. Кроме того, такая поверхность обладает повышенным уровнем химической активности, что ускоряет процесс резорбции материала и проникновения тканевых элементов в его пористость. Наибольший интерес представляют имплантаты титановых и магниевых сплавов с биоактвными биорезорбируемыми покрытиями, позволяющие сохранить механическую прочность имплантата в течение времени, необходимом для срастания кости и восстановления ее функций, и способствующие процессам остеогенеза, протекающим в это период [1, 8].
Цель исследования – изучить динамику репаративной регенерации кости на поверхности титановых имплантатов с биоактивным кальций-фосфатным и гидроксиапатитным покрытием.
Материалы и методы исследования
Образцы имплантационного материала. В качестве материала, на который наносилось покрытие, в работе использован технически чистый титан марки ВТ1-0 (Fe 0,25 %; Si 0,12 %; С 0,07 %; О 0,12 %; N 0,04 %; Н 0,01 %, остальное Ti). Перед нанесением покрытий имплантаты механически обрабатывались до определенного уровня шероховатости (Ra = 0.12 мкм). Затем их промывали в дистиллированной воде и обезжиривали спиртом. Плазменное электролитическое оксидирование проводили в электролите, содержащем 30 г/л глицерофосфата кальция (C3H7O6P)Ca·2H2O и 40 г/л ацетата кальция Ca(CH3COOO)2·H2O. Раствор готовили путем смешивания компонентов при тщательном перемешивании. Оксидирование проводили в биполярном режиме ПЭО. Для проведения эксперимента использованы 2 типа имплантатов: стандартные титановые винты марки титана ВТ-6 (производители НПО «Деост», «Остеомед», Россия) и аналогичные имплантаты с нанесенным биоактивным кальций-фосфатным и гидроксиапатитным покрытием.
Экспериментальные животные и моделирование перелома. Работа выполнена на 12 половозрелых крысах-самцах линии Wistar, весом 200-250 г в соответствии с Правилами проведения работ и использования экспериментальных животных (Приложение 3 к Приказу МЗ СССР № 755 от 12.08.1977 г.), дизайн исследования одобрен этическим комитетом ГБОУ ВПО ТГМУ Минздрава России. Животных содержали в виварии в соответствии с «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник» (от 6.04.1993 г.). Животных распределили на 2 группы по 6 крыс в каждой. У животных опытной группы использовали имплантат с покрытием, контрольной группы – имплантат без покрытия.
Оперативное вмешательство осуществлялось в асептических условиях под легким эфирным наркозом. После обработки операционного поля через межмыщелковую ямку тонким троакаром формировалось входное отверстие в костномозговой канал бедренной кости. Входное отверстие в межмыщелковой ямке расширялся зенкером для последующего погружения шляпки винта в субхондральный слой бедренной кости. В канал вводился винт до середины его длины, таким образом, что в средней трети диафиза бедра конец винта выступал как упор. После чего ручным сгибательным усилием моделировался закрытый перелом. Репозиция и фиксация отломков осуществлялись также закрытым ручным способом. Таким образом, в эксперименте воспроизводился закрытый малоинвазивный вид остеосинтеза, обеспечивающий непрямое сращение перелома. Рана ушивалась наложением одного-двух швов и обрабатывалась антисептиком.
По три крысы из опытной и контрольной группы выводили из эксперимента через 7 и 30 дней. Для эвтаназии использовался общий наркоз путем внутрибрюшинного введения 3 %-ного тиопентала натрия, после чего животных декапитировали (приложение 4 к Приказу № 755 МЗ СССР).
Материал фиксировали в 10 % нейтральном формалине на фосфатном буфере в течение 24 часов, после чего промывали 0.1 М Na-фосфатном буфере (рН 7,2) с 6-7 кратной сменой раствора. Образцы декальцинировали в 25 % растворе трилона Б (pH 7,0) при комнатной температуре на Orbital Shaker OS-20 biosan. После чего промывали в дистиллированной воде, обезвоживали и заливали в парафин по обычным правилам. Срезы толщиной 10 мкм окрашивали гематоксилином и эозином по общепринятой методике. Препараты просматривали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали с помощью цифровой камеры AxioCam ICc3 (Carl Zeiss, Германия). Количественный анализ данных проводили с помощью окуляр-морфометрической сетки при увеличении объектива 40. Значение каждого показателя вычисляли не менее чем в 20 полях зрения. Морфометрическую обработку полученных фотографий проводили с помощью пакета программ AxioVision 4.8.1.
Результаты исследования и их обсуждение
В контрольной группе животных на 7-е сутки после операции в области периоста зоны перелома наблюдается умеренная пролиферация клеток внутреннего слоя надкостницы, плотность их распределения на 1 мм2 82,3 ± 2,3 мкм, которые вместе с коллагеновым матриксом формируют клеточно-волокнистые тяжи (рисунок, А). Эти тяжи плотно соединяются с новообразованным умеренно базофильным диффузно-волокнистым костным веществом с тонкой базофильной линией склеивания. Ширина надкостницы в этот период колеблется от 142,3 до 160,4 мкм, в среднем 152,7 ± 4,2 мкм. Со стороны эндоста имеется небольшое количество пролиферирующих клеток. Их концентрация на 1 мм2 составляет 32,4 ± 1,3 мкм. В компактном веществе рядом с местом перелома можно увидеть пустые, без остеоцитов, лакуны и зоны резорбции (рисунок, Б). В отдаленных от места перелома зонах редкие сформированные и разрушающиеся остеоны с многочисленными, но не регулярно расположенными остеоцитами, плотность распределения которых колеблется от 112,8 до 139,5, в среднем 123,6 ± 2,8 в 1 мм2.
В опытной группе на этих же сроках идет активное формирование со стороны краев костного дефекта мощных трабекулярных костных структур с грубо-волокнистым матриксом, образующих дугообразные фигуры (рисунок, В). По краю новообразованных костных трабекул располагаются остеобласты. По соседству наблюдаются обширные участки фиброзной соединительной ткани с большим количеством полнокровных сосудов. В компактном веществе обнаруживаются немногочисленные «молодые» остеоны с более или менее ровными линиями склеивания и клеточными элементами, имеющими морфологическое сходство с остеоцитами. Численная плотность клеток немного превышает аналогичные значения в контрольной группе и в среднем составляет 139,2 ± 3,1 в 1 мм2. В зоне непосредственного контакта с имплантатом выявляются базофильные, близко расположенные друг к другу лини склеивания и клетки, слагающиеся в колонки (рисунок, Г). Новообразование костного вещества происходит в условиях значительного кровоснабжения и сопровождается развитием сети новых капилляров. Пролиферативные процессы в периосте и эндосте выражены умеренно. Ширина надкостницы в среднем составляет 148,7 ± 3,2 мкм. Количественная плотность клеток камбиального слоя надкостницы и эндоста на 1 мм2 98,2 ± 2,1 и 49,3 ± 1,8 соответственно.
Через месяцев от начала эксперимента в контрольной группе возникают признаки незавершенного костеобразования, а пластинчатая костная ткань здесь часто сочетается с очагами грубоволокнистой структуры. В компактном веществе определяются узкие немногочисленные остеоны с расширенным каналом и длинными, темными, слегка волнистыми линиями склеивания. Остеоциты в большом количестве рассеяны в пластинчатом матриксе. Их количество колеблется от 92,3 ± 2,1 до 129,6 ± 3,2, и в среднем на 1 мм2 приходится 112,3 ± 3,1. Ширина надкостницы в среднем составляет 141,3 ± 4,1 мкм. Плотность клеток камбиального слоя надкостницы так же снижена по сравнению с аналогичными показателями до 70,3 ± 2,1 на 1 мм2. Со стороны эндоста достоверных различий в плотности камбиальных клеток не выявлено и их количество составляет 29,2 ± 1,3 на 1 мм2.
В опытной группе костная ткань имеет более зрелое строение. Компактная кость окрашена однородно и слабо, в основном представлена регулярными слоями пластинчатой кости с небольшим количеством равномерно распределенных клеточных элементов без признаков дегенеративных изменений и умеренно выраженным сосудистым компонентом. Компактное вещество в основном построено остеонами различной толщины. Аппозиционные линии склеивания выглядят более или менее ровными. Клетки имеют типичную морфологию остеоцитов, располагаются упорядоченно, в лакунах, и образовывают отростки в виде тонких нитей, пронизывающих костный матрикс, что свидетельствует о высокой степени дифференцировки. Плотность распределения остеоцитов в компактной кости составляет в среднем 118,9 ± 1,7 на 1 мм2. Об интенсивности костеобразовательного процесса свидетельствует и появление остеокластов, на высоте своей активности представляющих собой типичные гигантские многоядерные клетки со слабобазофильной цитоплазмой (рисунок, Д).

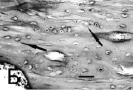
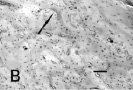
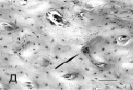

Зона репаративной регенерации бедренной кости крысы при разной экспозиции имплантата с биоактивным покрытием. А. Тяжи коллагеновых волокон с пролиферирующими клетками (стрелка) на 7-е сутки эксперимента. Контрольная группа животных. Б. Дистрофически измененная костная ткань в области перелома. Лакуны в компактном веществе кости (стрелки) без видимых перикарионов остеоцитов. Контрольная группа животных, 7-е сутки. В. Образование грубоволокнистого матрикса в виде дугообразных фигур (стрелка) и остеоны вокруг полнокровных сосудов (звездочки) около имплантата без покрытия. 7-е сутки эксперимента. Г. Многочисленные линии склеивания (стрелки) в области локализации имплантата с покрытием на 7-е сутки эксперимента. Д. Компактный слой с остеокластом в лакуне в области имплантата с покрытием на 30-е сутки (стрелка). Окраска гематоксилином и эозином. Масштаб: А, В – 150 мкм, Г – 75 мкм, Б, Д – 50 мкм
В области периоста генеральные пластинки параллельными рядами обрамляют большую часть поверхности диафиза. Наблюдается снижение морфометрических показателей. Так, ширина надкостницы на поздней стадии регенерации составляет уже в среднем 135,3 ± 3,1 мкм, а плотность клеток камбиального слоя 82,2 ± 2,8 на 1 мм2. Со стороны эндоста по ровному краю костной балки зрелые округлые остеобласты формируют непрерывный слой или образуют скопления. Плотность их распределения также снижена до 37,3 ± 1,2 на 1 мм2.
Мы наблюдали процессы последовательных клеточных реакций при регенерации во всех отделах кости: в области периоста, между концами отломков и со стороны эндоста. Обнаруженные нами морфологические изменения в зоне контакта с имплантатом с нанесенным биоактивным кальций-фосфатным и гидроксиапатитным покрытием указывают на активность репаративных процессов. Об этом свидетельствуют активный аппозиционный рост ниже волокнистого слоя периоста, многочисленные линии склеивания, указывающие на процессы резорбции и новообразование костного вещества, пролиферирующие остеобласты. Эту картину дополняют остеокласты, обнаруженные нами на поверхности костных структур, в лакунах. Важным моментом в процессе костного ремоделирования является полноценное кровоснабжение зоны перелома, определяющее тканевую направленность этого процесса.
Одним из основных условий, определяющих скорость заживления перелома, регулирующих пролиферацию и дифференцировку стромальных стволовых клеток в остеогенные, является микроокружение, создаваемое сложным тканевым комплексом [10]. Известно, что основную роль здесь играют костно-морфогенетические белки ВМР-2 и ВМР-7 [2, 6]. В зоне перелома кости, особенно в периостальной ткани и в межотломковом пространстве, отмечается гиперэкспрессия фактора стромальных клеток-1 (SDF-1) [9]. Сразу после травмы развивается острое воспаление и макрофаги, мигрирующие в очаг повреждения, начинают синтезировать провоспалительные цитокины, в том числе фактор некроза опухоли-α (TNF-α) и интерлейкины 1 и 6, стимулирующие ангиогенез за счет активации эндотелиального фактора роста (VEGF) [2]. Следом за первичной гематомой происходит преобразование ее в богатую фибрином соединительную ткань, так называемую мягкую мозоль. Далее происходит активация интрамембранозной оссификации в субпериостальной зоне, и мягкая мозоль замещается новыми костными генерациями. На этой стадии проявляют активность стромальные стволовые клетки, находящиеся окружающих мягких тканях, кортикальной кости, надкостнице, костном мозге [9, 10]. Молекулярные сигнальные механизмы запускают продукцию коллагенов 1 и 2 типов. В этом процессе основную роль играет суперсемейство трансформирующего фактора роста (TGF-β), особенно белки TGF-β2 и TGF-β3, участвующие в энхондральной оссификации [4].
Заключение
Репаративный остеогенез характеризуется формированием в участке перелома активных остеобластических процессов. Он поддерживается последующей пролиферацией специфических клеточных элементов, формированием волокнистых структур, выпадением аморфного вещества с последующей импрегнацией солями кальция [7]. Критическом пунктом в остеогенезе остается граница между имплантатом и окружающей тканью. Именно здесь происходит взаимодействие активных элементов покрытия с внутренней средой организма и возможных цитотоксических и регенераторных эффектов. Показано, что при подкожной имплантации in vivo происходит изменение структуры кальцийфосфатных покрытий, а их химическая биодеградация сопровождается молекулярно-клеточной реакцией со стороны ближайшего микроокружения [5]. Сума этих эффектов определяется комплексом специфических параметров имплантата: значениями концентраций кальция и фосфора, их соотношением и шероховатостью кальцийфосфатного покрытия на поверхности титановых имплантатов. Тем временем, значение физико-химических характеристик покрытий для ремоделирования кости остается не выясненным, поскольку имеющиеся данные в отношении морфофункционального поведения стромальных и остеогенных клеток остаются весьма противоречивыми. Так, согласно Хлусову и др. [3] значение шероховатости поверхности имплантат может заключаться в своеобразной акселерации остогенеза, а рельеф поверхности способствует прикреплению и удержанию остеобластов на имплантате в условиях постоянных биомеханических нагрузок. Фосфаты кальция как источник биологически активных ионов создают благоприятную химическую среду для остеогенных клеток и обеспечивают стабильную пролиферацию клеток новообразованной кости.
Работа выполнена при финансовой поддержке Российского научного фонда, научный проект № 14-33-00009.
Библиографическая ссылка
Матвеева Н.Ю., Костив Р.Е., Калиниченко С.Г., Пузь А.В., Плехова Н.Г. ДИНАМИКА РЕГЕНЕРАЦИИ ПЕРЕЛОМА БЕДРЕННОЙ КОСТИ КРЫС С ПРИМЕНЕНИЕМ ТИТАНОВОГО ИМПЛАНТАТА С ПОВЕРХНОСТНО АКТИВНЫМ ПОКРЫТИЕМ // Международный журнал прикладных и фундаментальных исследований. 2015. № 10-5. С. 849-853;URL: https://applied-research.ru/ru/article/view?id=7642 (дата обращения: 27.02.2026).

