В неорганической химии уже давно и хорошо известно, что для получения большинства оксидов p- и d-металлов в низких степенях окисления последних совершенно необходимо введение в реакционную систему определенных количеств тепловой энергии (подчас весьма значительной), причем независимо от того, какая химическая реакция или их совокупность положена в основу подобного синтеза. К числу ключевых химических реакций, которые могли бы быть положены в основу такого синтеза, относятся дегидратация гидроксосоединений p- и d-элементов. Классическими здесь являются реакции (1) и (2):
M(OH)2 → MO + H2O (1)
M(OH)3 → 1/2M2O3 + 3/2H2O (2)
До сих пор, однако, в литературе отсутствуют какие-либо указания на возможность реализации указанных реакций при достаточно низких температурах. В настоящем сообщении будет обсуждена такая возможность с термодинамической точки зрения.
В классической термодинамике возможность реализации того или иного изобарного химического процесса определяется простым условием ∆G0(T) < 0, где ∆G0(T) – изменение свободной энергии (энергии Гиббса) в результате химической реакции при абсолютной температуре T. Этот параметр в общем случае рассчитывается исходя из значений изменения энтальпии ΔH0 и изменения энтропии ΔS0 данного процесса по выражению (3)
∆G0(T) = ∆H0 – T∆S0 (3)
Величины ΔH0 и ΔS0, если быть предельно строгим, сами также зависят от T, однако, как для первой, так и для второй из них эти зависимости выражены относительно слабо и начинают сказываться лишь при температурах более 500 °С. В связи с этим обстоятельством ΔH0 и ΔS0 с хорошим приближением можно принять постоянными и равными изменениям стандартных энтальпии ΔH2980 и энтропии ΔS2980 соответствующей химической реакции [во всяком случае, в температурном интервале от 100 до 300 °С, в котором осуществляется большинство из упомянутых выше реакций (1) и (2)], в связи с чем уравнение (3) существенно упрощается и может быть представлено в виде (4)
ΔG0(T) = ΔH2980 – TΔS2980 (4)
В свою очередь, величины ΔH2980 и ΔS2980 для конкретной химической реакции являются аддитивными величинами и могут быть рассчитаны исходя из значений стандартных энтальпий и энтропий образования участвующих в ней химических соединений по общим выражениям (5) и (6) соответственно
ΔH2980 = 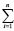 (∆Hf,2980)iki – –
(∆Hf,2980)iki – –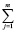 (∆Hf,2980)jkj (5)
(∆Hf,2980)jkj (5)
ΔS2980 = 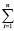 (Sf,2980)iki –
(Sf,2980)iki – 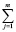 (Sf,2980)jkj (6)
(Sf,2980)jkj (6)
где (ΔHf,2980)i и (Sf,2980)j – стандартные энергии участвующих в реакции исходных веществ и конечных продуктов соответственно, ki и ki – стехиометрические коэффициенты для этих веществ в уравнениях этих реакций. Принимая во внимание все вышесказанное, а также то, что оксиды и гидроксиды при стандартных условиях и даже при весьма высоких температурах обладают твердым агрегатным состоянием, образующаяся же в ходе реакций дегидратации вода в принципе может находиться как в жидком, так и газообразном агрегатном состояниях, можно исходя из уравнений (5) и (6) легко показать, что температурная зависимость ∆G0(T) для реакции (1) описывается выражениями (7) и (8)
∆G0(T) = {∆Hf,2980(MO)(т) – T∆Sf,2980(MO)(т)} + {∆Hf,2980(H2O)(ж) – – T∆Sf,2980(H2O)(ж)} – {∆Hf,2980[M(OH)2(т)] – T∆Sf,2980[M(OH)2(т)]} (7)
∆G0(T) = {∆Hf,2980(MO)(т) – T∆Sf,2980(MO)(т)} + {∆Hf,2980(H2O)(г) – – T∆Sf,2980(H2O)(г)} – {∆Hf,2980[M(OH)2(т)] – T∆Sf,2980[M(OH)2(т)]} (8)
а для реакции (2) – выражениями (9) и (10)
∆G0(T) = 1/2{∆Hf,2980(M2O3)(т) – T∆Sf,2980(M2O3)(т)} + 3/2{∆Hf,2980(H2O)(ж) – – T∆Sf,2980(H2O)(ж)} – {∆Hf,2980[M(OH)3(т)] – T∆Sf,2980[M(OH)3(т)} (9)
∆G0(T) = 1/2{∆Hf,2980(M2O3)(т) – T∆Sf,2980(M2O3)(т)} + 3/2{∆Hf,2980(H2O)(г) – – T∆Sf,2980(H2O)(г)} – {∆Hf,2980[M(OH)3(т)] – T∆Sf,2980[M(OH)3(т)} (10)
Таблица 1
Зависимости ∆G0(T) для реакций (1) и минимальные температуры их реализации T0 для различных металлов M
|
M |
Зависимости ∆G0(T), рассчитанные по уравнению (7) |
T0, K (T0,C)* |
Зависимости ∆G0(T), рассчитанные по уравнению (8) |
T0, K (T0,C)* |
|
Mn |
∆G0(T) = 29,1 – 0,0367T |
792,9 (519,7) |
∆G0(T) = 73,1 – 0,1553T |
470,7 (197,5) |
|
Fe |
∆G0(T) = 11,1 – 0,0420T |
264,2 (– 9,0) |
∆G0(T) = 55,1 – 0,1606T |
343,1 (69,9) |
|
Co |
∆G0(T) = 18,9 – 0,0320T |
590,6 (317,4) |
∆G0(T) = 62,9 – 0,1506T |
417,7 (144,5) |
|
Ni |
∆G0(T) = 20,0 – 0,0281T |
711,7 (438,5) |
∆G0(T) = 64,0 – 0,1467T |
436,3 (163,1) |
|
Cu |
∆G0(T) = –3,5 – 0,0291T |
– |
∆G0(T) = 40,5 – 0,1477T |
274,2 (10,0) |
|
Zn |
∆G0(T) = 9,0 – 0,0281T |
320,3 (47,1) |
∆G0(T) = 53,0 – 0,1553T |
341,3 (68,1) |
|
Cd |
∆G0(T) = 15,7 – 0,0319T |
492,2 (219,0) |
∆G0(T) = 59,7 – 0,1495T |
399,3 (126,1) |
|
Sn |
∆G0(T) = –65,5 – 0,0389T |
– |
∆G0(T) = – 21,5 – 0,1575T |
– |
|
Pb |
∆G0(T) = 9,2 – 0,0288T |
319,4 (46,2) |
∆G0(T) = 53,2 – 0,1474T |
360,9 (87,7) |
Таблица 2
Зависимости ∆G0(T) для реакций (2) и минимальные температуры их реализации T0 для различных металлов M
|
M |
Зависимости ∆G0(T), рассчитанные по уравнению (9) |
T0, K (T0,C)* |
Зависимости ∆G0(T), рассчитанные по уравнению (10) |
T0, K (T0,C)* |
|
Al |
∆G0(T) = 48,3 – 0,0605T |
798,3 (525,1) |
∆G0(T) = 114,3 – 0,2384T |
479,4 (206,2) |
|
Cr |
∆G0(T) = 1,0 – 0,0654T |
15,3 (–257,9) |
∆G0(T) = 67,0 – 0,2433T |
275,4 (2,2) |
|
Fe |
∆G0(T) = –13,2 – 0,0438T |
– |
∆G0(T) = 52,8 – 0,2217T |
238,2 (– 35,0) |
|
Y |
∆G0(T) = 31,8 – 0,0584T |
544,5 (271,3) |
∆G0(T) = 97,8 – 0,2363T |
413,9 (140,7) |
|
In |
∆G0(T) = –121,3 – 0,0524T |
– |
∆G0(T) = –55,6 – 0,2303T |
– |
|
Au |
∆G0(T) = 42,3 – 0,0513T |
824,6 (551,4) |
∆G0(T) = 108,3 – 0,2292T |
472,5 (199,3) |
|
Tl |
∆G0(T) = –107,3 – 0,0771T |
– |
∆G0(T) = –41,3 – 0,2550T |
– |
|
Bi |
∆G0(T) = –5,8 – 0,0626T |
– |
∆G0(T) = 60,2 – 0,2415T |
249,3 (– 23,9) |
Значения ΔHf,2980 и Sf,2980 для основных известных ныне индивидуальных химических соединений, включая большинство оксидов и гидроксидов p-, d- и f-элементов, табулированы в ряде справочников, в частности в многотомном издании «Термические константы веществ» (см., например, [1]), и заимствованы нами для получения соответствующих аналитических выражений ∆G0(T) именно из этого издания. Рассчитанные с использованием этих данных аналитические выражения ∆G0(T) для различных оксидов и гидроксидов представлены в табл. 1 и 2. Как можно видеть из них, в большинстве случаев минимальные температуры, при которых становятся возможными соответственно реакции (1), весьма значительны и превосходят температуру кипения воды при стандартном давлении P = 101325 Па исключениями из этого правила являются лишь гидроксиды Fe(OH)2, Cu(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, дегидратация которых может реализовываться при температурах ниже 100 °С. При этом, что любопытно, для Cu(OH)2 процесс дегидратации с образованием H2O (ж) необратим (и, стало быть, реализуется при любой температуре); для Sn(OH)2 необратимы как дегидратация с образованием H2O (ж), так и с образованием H2O (г). В случае же реакций (2) имеет место скорее обратное положение дел по сравнению с реакциями (1) – в большинстве случаев они могут протекать уже при комнатных (15–25 °С) температурах, при этом для Fe(OH)3 процесс дегидратации с образованием H2O (ж) необратим, а для In(OH)3 и Tl(OH)3 необратимы и дегидратация с образованием H2O (ж), и дегидратация с образованием H2O (г). Исключениями на этом фоне оказываются лишь Al(OH)3, Y(OH)3 и, что весьма интересно, Au(OH)3. Эксперимент, однако, свидетельствует о том, что для ряда металлов M трансформация их гидроксидов M(OH)2 в соответствующие оксиды по брутто-реакции (1) может происходить и при более низких температурах по сравнению с теми, которые приведены в табл. 1. Наиболее ярким примером подобного рода является гидроксид свинца(II) Pb(OH)2, для которого в водно-щелочном растворе не только имеет место трансформация в оксид при стандартных условиях (т.е. при температуре 298 K и давлении 101325 Па), но и возникновение в зависимости от pH по меньшей мере трех различных оксидов свинца, имеющих желтую, желтовато-зеленую и красную окраску [2]; при этом первое из них выделяется при pH = 12,5–13,2, второе – при pH = 14,4–14,9, третье – при pH = 15,0–15,5. Аналогичное и весьма примечательное явление, судя по всему, наблюдается не только для гидроксида свинца(II), но и для гидроксидов других p- и d-элементов, о чем имеются упоминания в [3]. В [2] было дано вероятное объяснение этого явления применительно к Pb(OH)2, основанное на представлениях о формировании в водно-щелочных растворах полиядерных оксогидроксокомплексов Pb(II), при деструкции именно которых, а не собственно гидроксида свинца(II) и образуется PbO; нечто подобное, скорее всего, имеет место и для других гидроксидов M(OH)2, для которых вопреки термодинамическому запрету реакции (1) в водных растворах все же также отмечается трансформация гидроксида в соответствующий оксид. Для окончательного выяснения этого вопроса, однако, требуются еще дополнительные исследования.
Библиографическая ссылка
Михайлов О.В. О СПЕЦИФИКЕ ОБРАЗОВАНИЯ ОКСИДОВ p- И d-ЭЛЕМЕНТОВ ИЗ ИХ ГИДРОКСИДОВ // Международный журнал прикладных и фундаментальных исследований. 2015. № 11-1. С. 25-27;URL: https://applied-research.ru/ru/article/view?id=7665 (дата обращения: 07.03.2026).

