Микроскопические грибы – обширная группа организмов, насчитывающая около 100 тыс. видов. Узко специализированная группа микромицетов, приспособившаяся к паразитированию на коже, волосах и ногтях, вызывает заболевания, известные как поверхностные микозы. Считавшиеся ранее редкими возбудителями инфекционных заболеваний, грибы рода Aspergillus также являются причиной возникновения поверхностных микозов (аспергиллезов). При этом новые возбудители поверхностных микозов описываются практически ежегодно [11, 36]. Несмотря на имеющиеся достижения в области изучения и лечения поверхностных микозов кожи (ПМК), эти заболевания до сих пор не утратили своего значения. Рост заболеваемости микозами стоп (МС) и кистей регистрируется повсеместно, а за период с 2002 по 2006 г. в РФ увеличился на 3,9 % [17]. Данные зарубежных авторов также свидетельствуют о неблагополучной ситуации по частоте заболеваний МС. Так, в Европе МС регистрируется у каждого третьего пациента, обратившегося к дерматологу [48]. В связи со сложившейся ситуацией главной целью лечебно-профилактических мероприятий при поверхностном аспергиллезе кожи и ее придатков должно стать своевременное выявление инфекции на ранних стадиях и адекватное в полном объеме лечение выявленных больных. Эти мероприятия составляют необходимое условие для предотвращения роста массовой заболеваемости, причем для разработки стандартов диагностики и лечения поверхностных микозов необходимо тесное сотрудничество врачей – микологов и дерматологов с микробиологами.
1. Поверхностные микозы
Микроскопические грибы широко варьируют по морфологическим и физиологическим свойствам и используют для жизнедеятельности самые разные экологические ниши. Одни виды стали нормальными обитателями человека, другие являются возбудителями заболеваний, третьи способны сенсибилизировать макроорганизм и индуцировать аллергические состояния [11]. На сегодня описано около 400 видов болезнетворных грибов – возбудителей микозов. Среди ряда микологических проблем в России активно проводятся исследования поверхностных микозов человека и животных [13].
1.1. Этиология и заболеваемость первичными микозами
Поверхностные микозы являются грибковыми заболеваниями кожи, ногтей, волос, возникшими вследствие инфицирования относительно здоровых людей первичными патогенами. Длительность сохранения первичных патогенов во внешней среде, как правило, зависит от присутствия «хозяина» (человека или животного) и от возможности его инфицирования [29]. В основном – это дерматофиты (Trichophyton rubrum, Т. mentagrophytes и Epidermophyton floccosum), которые обычно переносятся от больных МС [27, 28]. Попадая на стопы здоровых людей, патоген может развиваться сразу, но, как правило, его споры вызывают инфекцию в благоприятных для них условиях (влажность, тепло), которые очень часто возникают между пальцами ног, где и развивается большинство первичных очагов эпидермофитий стопы. Сегодня примерно пятая часть населения планеты (20 %) страдает от МС [24, 29].
По данным российских дерматологов, МС регистрируется у 10 – 20 % взрослого населения, при этом мужчины болеют в 2 раза чаще женщин, пожилые люди – чащe, чем молодежь [33, 34, 15, 16]. Относительно этиологии МС известно, что на современном этапе возбудителями МС являются как дерматофиты, так и дрожжеподобные грибы рода Candida и плесневые грибы (рисунок). В конце ХХ в. одни исследователи указывали на характерное преобладание дерматофитов в структуре возбудителей МС и онихомикозов, в то время как другие отмечали снижение их доли на фоне роста возбудителей дрожжевой и плесневой флоры [35].
а б в
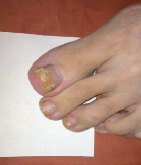
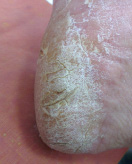
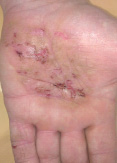
а – онихомикоз (возбудитель Trichophpyton rubrum); б – микоз кистей (возбудитель Trichophpyton spp); в – микоз стоп, микстинфекция (Возбудители Aspergillus niger, Candida albicans и Candida parapsilosis)
1.2. Зависимость первичных микозов от экологических и социальных условий
Рост заболеваемости МС связывают с ухудшением материальных и социальных условий жизни, несоблюдением санитарно-гигиенических условий в быту, увеличением вероятности тесных контактов между людьми, в результате чего достаточно часто наблюдается внутрисемейное заражение [16]. Инфицирование типично и для случаев пользования обезличенной обувью в общественных местах (боулинги, прокат коньков, лыж, тапочки, спальные мешки и др.) [10]. Важную роль в эпидемиологии МС играют климатические условия с высокой температурой окружающей среды и влажностью. Заболевание наиболее часто регистрируется в странах с субтропическим и тропическим климатом – там, где люди ходят босиком [37, 46].
При заболеваниях МС над моноинфекцией часто преобладают микст-инфекции, что следует учитывать при выборе тактики лечения. Так, T. rubrum в виде моноинфекции верифицировался только в 38,0±5,8 % случаев, а инфицирование T. rubrum в ассоциации с С. albicans – в 51,0±6,0 %, с Aspergillus – в 11,3±3,7 % [1]. Отмечено, что во многих случаях T. rubrum вызывает МС в ассоциации с Candida spp. и Penicillium spp. [6].
В последние два десятилетия появилось много данных о связи между микозами кожи и заболеваниями аллергического генеза. Доказана роль грибов в патогенезе атопического дерматита, бронхиальной астмы, крапивницы, аллергического ринита и конъюнктивита, микробной экземы [13, 25, 30, 31, 14]. Способность компонентов Trichophyton связываться с IgE-антителами выявлена несколькими методами: радиоаллергосорбентным, твердофазным иммуноферментным анализом, вестерн-блоттингом, методом радиоиммунопреципитации. При этом специфическая терапия в случае развития гиперэргической реакции замедленного типа к Trichophyton должна быть пролонгированной с использованием антимикотиков, не влияющих на активность стероидов (тербинафин и флуконазол) [50].
В настоящее время значительно увеличился контингент пациентов ПМК, получающих системные глюкокортикостероиды (СГКС), которые широко применяют при шоковых состояниях, лечении ревматических заболеваний, бронхиальной астмы, аллергодерматозов, заболеваний крови и при других патологиях. МС на фоне приема СГКС отличаются атипичными клиническими проявлениями и несвойственным спектром возбудителей, когда лидирует T. rubrum (92,1 %), изредка – Candida spp. (7,4 %), и T. interdigitale (2,1 %). В этом случае у 1/3 пациентов МС сочетается с кандидозом слизистых оболочек ЖКТ, причем возбудителем МС в 96,4 % является С. albicans и в 3,6 % – С. tropicalis [9]. Некоторые авторы относят применение системных СГКС к факторам риска развития ПМК [43].
1.3. Эффективность лечения поверхностных микозов
Успешность проводимой в настоящее время терапии МС не превышает 67 %. Этиологическое излечение отмечено у 46 %, полное – у 33 % пациентов. Эффективность лечения онихомикоза кистей достигает 83 %. Рецидив онихомикоза стоп в течение 12 месяцев возникает у 47 %, онихомикоза кистей – у 25 % больных. Таким образом, результативность терапиии поверхностных микозов является невысокой [18].
МС нередко осложняются вторичной пиодермией. Выявлена связь между дерматофитами и пиогенными бактериями. Синергизм пиококков и грибов способствует глубокому проникновению дерматофитов в кожу, а персистенция МС в свою очередь повышает возможность инфицирования кожи бактериями за счет нарушения трофики и целостности кожи, особенно при наличии трещин, эрозий. Клинические проявления интертригинозной формы МС являются результатом взаимодействия дерматофитов и бактериальной флоры, а соотношение дерматофиты/бактерии меняется в пользу последних, что усиливает воспалительную реакцию в очаге инфекции [23]. Присоединение вторичной пиодермии при дисгидротически-экссудативных формах МС наблюдается у 25–30 % больных [23]. В этих случаях микозы труднее поддаются терапии. Назначение антибиотиков, гормонов, цитостатиков и других препаратов при ряде заболеваний также способствует персистенции микотической флоры, обусловливая хронизацию МС и неудачи в лечении [32, 29].
Важную роль в инфицировании МС и возникновении рецидивов заболевания играет иммунная недостаточность. Недаром МС и онихомикозы являются дерматологическими маркерами ВИЧ/СПИДА [41] Организация помощи этому контингенту больных должна строиться с учетом всех перечисленных факторов.
2. Аспергиллез
Аспергиллез – заболевание, возникающее вследствие микробного обсеменения грибами рода Aspergillus и их инвазии [12]. Представители рода Aspergillus, считавшиеся ранее редкими возбудителями инфекционных заболеваний, являются причиной возникновения поверхностных аспергиллезов (ПА) и также причиной отягощения основного заболевания и смертности у больных с иммунодефицитами [47, 49]. Частой причиной смерти при пневмонии у пациентов, перенесших трансплантацию легких и других органов, является инвазивный аспергиллез [49, 40]. Грибы рода Aspergillus также могут вызывать широкий диапазон хронических, сапрофитных и аллергических состояний. Типичные обитатели почв – аспергиллы встречаются повсеместно в окружающей среде, и экспозиция к их спорам возникает довольно часто, в связи с чем ПА особенно широко распространен. Паразитируя на коже, волосах и ногтях, аспергиллы разрушают роговой слой кожи и ее придатков, переходят от одного человека к другому. Раз начавшись, инфекция не проходит, пока грибок не будет уничтожен. Первопричина ПА – прямая имплантация возбудителя после травмы. Реже кожа вовлекается в патологический процесс вследствие распространения инфекции из первичного очага в дыхательных путях. Поражения кожи с зарегистрированной аспергиллезной инфекцией показаны для 4 % пациентов с гематологическими злокачественными заболеваниями, у которых инфекция быстро развивалась от папулезных до язвенных состояний [39]. Отмечено, что язвы увеличивались в зависимости от степени иммуносупрессии [42].
В ряду известных возбудителей аспергиллеза около 90 % приходится на долю A. fumigatus. Грибы A. niger часто являются причиной отомикозов, A. flavus инфицирует придаточные пазухи носа и как вид (наряду с A. terreus) колонизирует открытые полости тела человека [19]. По данным зарубежных исследователей, у 72 реципиентов гематопоэтических стволовых клеток были выделены грибы рода Aspergillus, включающие в свой состав виды A. fumigatus (56 %), A. flavus (19 %), A. terreus (16 %), A. niger (8 %), и A. versicolor (1 %) [44]. Указанные виды аспергилл широко распространены в почвах России [20].
2.1. Идентификация грибов рода Aspergillus
Грибы рода Aspergillus относятся к классу сумчатых грибов (Ascomycetes), семейству Aspergillaceae, являются гиалогифомицетами или, точнее, лейкогифомицетами [22, 7]. Таксономия Aspergillus, как и у многих других грибов, определяется не по физиологическим, биохимическим особенностям и генетической характеристике, часто используемой для классификации бактерий, а прежде всего по морфологическим признакам. В частности, в основу дифференциации аспергиллов на виды положены форма и строение конидий, тип конидиогенеза, характер пигментации и цвет колоний. Учитывая, что у большинства видов аспергиллов пока не известен половой цикл развития, на практике изучают их вегетативное размножение за счёт участков мицелия и его ветвления и репродуктивное размножение за счёт специализированных клеток – конидий, возникающих на конидиеносцах или конидиофорах. Существенно, что патогенными являются аспергиллы в анаморфном состоянии; в большинстве случаев на применяемых в лабораторных условиях средах (агар Сабуро, сусло-агар и др.) аспергиллы вырастают в анаморфном состоянии [26]. В тканевых срезах аспергиллы обычно представлены в форме гиалиновых нитей с параллельными клеточными стенками и четкими регулярными септами; диаметр нитей мицелия составляет от 3 до 6 мкм. Нити ветвятся дихотомически под острым углом [12].
2.2. Факторы патогенности грибов рода Aspergillus
Взаимодействие патогенных аспергиллов с восприимчивым макроорганизмом, ведущее к развитию аспергиллеза, обусловлено наличием у грибов таких свойств, как адгезия к эпителиальным клеткам, способность к их колонизации, пенетрация через эпителий, инвазия в подлежащие ткани, а также способность противостоять факторам неспецифической и специфической защиты организма (агрессия). Патогенность Aspergillus spp. связана с их гетеротрофностью и синтезом разнообразных ферментов: амилолитических, протеолитических, липолитических, и ферментов, разрушающих роговое покрытие (хитин, кератин), что способствует заселению ими самых разнообразных органических субстратов и активной колонизации живых организмов [22]. Факторами патогенности аспергилл являются также эластазы, способные разрушать эластические волокна легких при глубоком аспергиллезе [26].
Колонизация эпителиальных тканей аспергиллами во многом зависит от присутствия в культуре бактерий, нередко проявляющих антагонистические свойства в отношении грибов. Интересными в этом плане явились результаты микологических исследований авторов данной статьи. У ряда обследованных пациентов с отомикозом, основным возбудителем которого является A. niger, в монокультуре A. niger был обнаружен в 23 случаях, в микст-культуре с эпидермальным стафилококком – в 25 случаях и в одном – в ассоциации с синегнойной палочкой Pseudomonas аureginosa, являющейся одним из наиболее частых возбудителей отитов, сходных по клиническим признакам с отомикозами. [3]. Совместное культивирование A. niger и P. aureginosa позволило выявить штаммы A. niger, с антагонистическими свойствами по отношению к Р. аeruginosa, что подтверждает особую роль взаимоотношений грибов с бактериобиотой в патогенезе аспергиллеза.
Согласно данным литературы [45], патогенез грибковых инфекций во многом обусловлен особенностями строения клеточной стенки микромицета, в состав которой входит хитин. Так, для изолята гриба A. fumigatus Af 5517 было показано, что усиление синтеза хитина, сопряженное с увеличением диаметра гиф, ведет к снижению темпов роста гриба (in vitro). Наряду с этим, увеличение толщины хитиновой прослойки коррелировало со снижением вирулентности этого изолята в экспериментах in vivo на мышах с нейтропенией, что указывает на важную регуляторную роль клеточной стенки в проявлении грибной инфекции.
Среди патогенных чаще отмечаются термофильные виды аспергилл [7, 22], способные расти и развиваться при 37°C и более высоких температурах. Одним из критериев оценки термотолерантности является эффективность прорастания спор и темп роста гиф как первый шаг в формировании новых колоний. Помимо ферментов, патологическое действие на организм человека и животных оказывают вторичные метаболиты аспергилл – антибиотики и токсины [22, 7]. Например, грибам А. flavus наряду с другими (А. parasiticus, A. glaucus, A. niger) присуща способность синтезировать афлатоксины, которые оказывают мутагенное, канцерогенное, гепатотоксическое и другие действия на макроорганизм, внося вклад в развитие аспергиллеза и аспергиллотоксикоза [20, 22].
Для раскрытия патогенности аспергилл важно учитывать микогенную аллергию. Грибные споры, а чаще всего конидии. при воздействии на кожу и слизистые оболочки людей вызывают симптомы типа сенной лихорадки, отчасти совпадающие с астматическими. В настоящее время у Aspergillus зарегистрированы аллергены, количество которых отличается в зависимости от вида. Так, у А. fumigatus известно 19 аллергенов, у А. niger – 4, у А. flavus – 1, и А. oryzae – 2 аллергена. Показатели частоты сенсибилизации к грибам варьируют в широких пределах (от 2 до 60 %) в зависимости от количества грибов (in vivo), их качественных характеристик (вегетативные клетки, споры), фазового состояния (дрожжевая или мицелиальная форма) и принадлежности пациента к группе риска развития микогенной аллергии [26].
Таким образом, патогенность грибов рода Aspergillus определяется как условиями, создающимися в организме человека, так и фундаментальными физиолого-биохимическими свойствами грибов.
2.3. Поверхностные аспергиллезы
2.3.1.Эпидемиология и клинические проявления поверхностных аспергиллезов
Активное изучение поверхностных аспергиллезов диктуется необходимостью остановки их распространения инфекций. Результаты исследований более 300000 пациентов с микозами показали, что наиболее массовыми в настоящее время являются поверхностные аспергиллезы [18]. Полученные за минувшие 8 лет (2005 – 2012 годы) представления о преимущественной локализации поверхностных аспергиллезов показали, что на первое место вышли поражения кожи стоп (39,5 на 1000), второе место заняли поражения ногтей (2,9 на 1000) и); на третьей позиции были случаи поражения волос (0,1 на 1000 пациентов). Аспергиллез стоп, легче поддающийся лечению, но часто игнорируемый пациентами и предшествующий онихомикозу, представляет собой наиболее часто и стабильно встречаемую форму микотической инфекции. В последние годы клинические особенности поверхностных аспергиллезов характеризуются возрастанием атипичных случаев плесневых поражений ногтей, развитием их на фоне различных сопутствующих заболеваний, в первую очередь иммунодефицитных состояний и эндокринных болезней. Большинство больных (77,5 %) страдает заболеванием ногтей. Поражения кожи с преимущественным вовлечением кожи стоп составили 18,7 %, поражения волосистой части головы – 0,21 % [38].
2.3.2. Лечебно-профилактические мероприятия при поверхностном аспергиллезе
Главной целью лечебно-профилактических мероприятий при аспергиллезе кожи и ее придатков должно стать своевременное выявление инфекции на ранних стадиях и полномасштабное лечение выявленных больных как единственного источника распространения главных форм дерматофитии. Эти мероприятия составляют необходимое условие для предотвращения роста массовой заболеваемости.
В лечении наиболее частой патологии – онихомикозов – используется весь спектр современных противогрибковых средств [2]. Одним из достижений современной клинической микологии является разработка индекса тяжести онихомикоза (КИОТОС), позволяющего оценить течение болезни, отразить это на шкале оценки тяжести и рекомендовать схему и длительность лечения, адекватную значению индекса. Индекс КИОТОС широко используется в мировой практике при проведении крупных исследований сравнительной эффективности лечения онихомикозов. Описание индекса и его расчетные устройства переведены на 9 иностранных языков и в настоящее время доступны on-line на сайте http://onychoindex.com . Основной проблемой, ставшей предпосылкой к созданию индекса, был неприемлемо высокий (от 15 %) уровень рецидивов онихомикоза после лечения, что может быть обусловлено выбором неверной схемы терапии. Новые концепции лечения онихомикозов с применением лекарственных форм направленного действия и оптимизации путей их доставки к очагам грибковой инфекции заметно повысили эффективность терапии, сократили сроки лечения и позволили за период с 2005 по 2012 годы снизить заболеваемость онихомикозами в 3 раза [18].
2.3.3. Антимикотическая терапия поверхностного аспергиллеза
Для эффективности действия антимикотических средств немаловажную роль играет среда, окружающая грибы. Внешняя среда представляет собой источник не только пищи, но и неблагоприятных воздействий, ингибирующих обмен веществ грибной клетки (несбалансированность количества кислорода, воды, питательных веществ, токсические для клетки продукты метаболизма, неблагоприятные значения pH, температуры). Для роста и развития плесневых грибов требуются также макро- и микроэлементы. К числу необходимых грибу микроэлементов относятся соли меди, являющиеся важной составной частью таких оксидаз, как лакказа (полифенолоксидаза), оксидаза аскорбиновой кислоты, оксидаза цитохрома a3, уратоксидаза, участвующих также в этапах восстановления нитратов [8]. Как известно, темноокрашенные грибы, к которым относятся аспергиллы, устойчивы к действию тяжелых металлов и способны к их накоплению, о чем свидетельствует активный рост Aspergillus в придорожных зонах и местах повышенного загрязнения ионами тяжелых металлов [21]. Накопление тяжелых металлов может приводить к угнетению и даже гибели чувствительных микроорганизмов, или, наоборот, стимулировать развитие устойчивых видов, оказывая влияние на численность микроорганизмов в почве [20].
Нами показано [4], что ионы меди, добавленные в среду культивирования клинических штаммов A. niger, выделенных от больных отомикозами в Казанском НИИ эпидемиологии и микробиологии, снижают скорость роста и спорообразование микромицета. В зависимости от концентрации СuSO4 в питательной среде изменялась чувствительность штаммов к антимикотическим препаратам (тербинафину и флуконазолу), а высокие концентрации ионов меди ингибировали липолитическую активность и незначительно влияли на амилолитическую активность аспергилл. Мы установили [5], что ионы цинка также ингибируют липолитическую активность штаммов A. niger. Полученные данные позволяют обосновать возможности применения солей меди и цинка для создания перспективных антимикотических препаратов.
Обширный ряд лекарственных средств природного и синтетического происхождения, отличающихся по составу и химическому строению, рекомендуется сегодня для лечения аспергиллезов. Наиболее важными из них являются полиеновые антибиотики, азолы (синтетические препараты с более высокой избирательностью действия и меньшей токсичностью), аллиламины (синтетические препараты – тербинафин и нафтифин), и прочие средства, классификация которых представлена в работе [2].
Терапия современными органическими фунгицидами благодаря специфичности действия рекомендует их обычно в низких дозах во избежание токсических эффектов. Однако, универсально применимого и полностью нетоксичного фунгицида в настоящее время не существует [22, 26, 2]. Поскольку грибы, как и млекопитающие, являются эукариотами, многие антимикотики проявляют токсичность для человека, поэтому по-прежнему остается актуальной проблема создания новых фунгицидов, мишенью действия которых могут служить структуры специфичные только для грибов (хитин, маннан-глюкановый комплекс и др.)
Заключение
Важной современной проблемой является борьба с поверхностными микозами – грибковыми заболеваниями кожи, ногтей, волос, возникающими при инфицировании относительно здоровых людей специализированной группой микромицетов, включающей в свой состав дерматофиты (Trichophyton rubrum, Т. mentagrophytes и Epidermophyton floccosum) [27, 28], дрожжеподобные грибы рода Candida и плесневые грибы.
Практически ежегодно описываются новые микромицеты, вызывающие поверхностные микозы, как, например, представители рода Aspergillus, ранее считавшиеся редкими возбудителями инфекционных заболеваний [11, 36]. Частая экспозиция к спорам типичных обитателей почв – аспергилл, повышает риск развития поверхностного аспергиллеза [12], при этом проявление патогенности гриба обусловлено не только его физиолого-биохимическими свойствами, но и условиями внешней среды и организма человека.
Поверхностные аспергиллезы на сегодня – наиболее массовое грибковое заболевание, а результаты проводимой в настоящее время терапии ПМК невысоки, не более 60 % [18]. Это свидетельствует о необходимости разработки новых принципов лечения ПМК и онихомикозов за счет избирательного применения новых, малотоксичных, возможно комплексных лекарственных форм, обладающих эффективностью доставки к очагам грибковой инфекции. Для предотвращения роста массовой заболеваемости поверхностными микозами необходимо проведение лечебно-профилактических мероприятий с целью своевременного выявления инфекции на ранних стадиях и адекватного, в полном объеме лечения выявленных больных как единственного источника распространения главных форм дерматофитии.
Таким образом, многочисленные отечественные и зарубежные публикации по эпидемиологии поверхностных микозов, и в частности аспергиллезов, свидетельствует об несомненной актуальности данной проблемы. Организация помощи соответствующему контингенту больных должна строиться с учетом всех перечисленных факторов, которых, в действительности, значительно больше.
Библиографическая ссылка
Баязитова А.А., Баязитова А.А., Куприянова-Ашина Ф.Г., Халдеева Е.В., Ильинская О.Н. ПЕРВИЧНЫЕ ПАТОГЕНЫ – ВОЗБУДИТЕЛИ ПОВЕРХНОСТНЫХ МИКОЗОВ // Международный журнал прикладных и фундаментальных исследований. 2015. № 11-2. С. 241-248;URL: https://applied-research.ru/ru/article/view?id=7716 (дата обращения: 22.12.2025).

