Химиотерапия является одним из основных способов коррекции роста злокачественных новообразований. Однако этот способ терапии связан с риском интоксикации организма цитостатическими препаратами и их метаболитами. Такой эффект обусловлен использованием высоких доз цитостатиков, которые в свою очередь, не обладая избирательностью эффекта в отношении раковых клеток, действуют на все органы и системы организма [2]. Поэтому одним из актуальных вопросов современной фармакологии остается разработка препаратов направленного противоопухолевого действия либо создание лекарственных форм избирательного действия уже известных цитостатиков с целью усиления эффективности химиотерапии и снижения общего токсического эффекта на организм пациента [3].
В качестве потенциальных переносчиков противоопухолевых препаратов могут выступать липопротеины высокой плотности (ЛПВП), а также их главный белковый компонент – аполипопротеин А-I (апоА-I). В литературе представлены работы, в которых показана возможность использования ЛПВП и апоА-I в качестве транспортных формы для различных биологически активных соединений, в том числе лекарственных препаратов [4,5].
Целью настоящей работы явилось изучение способности ЛПВП и апоА-I связывать и транспортировать актиномицин Д и винбластин в цитоплазму и ядра клеток асцитной карциномы Эрлиха.
Материалы и методы исслдования
Выделение липопротеинов из плазмы крови человека проводили методом изоплотностного ультрацентрифугирования в растворах KBr в присутствии 3 мМ ЭДТА-Na2 на центрифуге «Optima L-90K, Beckman-Coulter» (Австрия) с использованием ротора 70.1 Ti [6]. Получали три основные фракции липопротеинов: липопротеины очень низкой плотности (ЛПОНП, 0,94<d<1,006 г/мл), липопротеины низкой плотности (ЛПНП, 1,006<d<1,063 г/мл) и липопротеины высокой плотности (ЛПВП, 1,063<d<1,21 г/мл).
Поскольку апоА-I является основным белковым компонентом ЛПВП, то для его выделения мы брали именно эту фракцию. Делипидирование проводили охлажденной смесью хлороформ-метанол (1:1) из расчета 20 мл смеси на 1 мл ЛПВП с последующей многократной отмывкой эфиром. Для получения апоА-I (апоА-I) суммарные белки ЛПВП в растворе 3 % Ds-Na и 0,1 % меркаптоэтанола наносили на колонку (1,6 х 100 см) с Сефарозой 6В-CL («Pharmacia», Швеция) и элюировали 5мМ Трис-НСl буфером, рН 8,6, содержащим 6 М мочевину, 0,01 % азид натрия и 1 мМ фенилметансульфонилфторид. Скорость потока – 10 мл/ч, скорость самописца – 9 мм/ч. Профиль элюции регистрировали на УФ-детекторе 2151 «LKB» (Швеция) при длине волны 280 нм. Проверка чистоты апоА-I осуществлялась с помощью электрофореза в 10 % ПААГ с Ds-Na. Белковые полосы визуализировали 0,1 % Кумасси G-250 в смеси метанола и 10 % уксусной кислоты (1:1). В качестве маркеров использовали набор низкомолекулярных белков-стандартов (фосфорилаза – 94 кДа, альбумин – 67 кДа, овальбумин – 43 кДа, карбоангидраза – 30 кДа и лактальбумин – 14,4 кДа).
Обессоливание апоА-I проводили методом гель-фильтрации (колонка: 40 ´ 0,8 см, Сефадекс G-25 («Pharmacia», Швеция), элюент: 5мМ трис-НСl буфер, рН 7,4, содержащий 0,15 М NaCl, скорость элюции – 30 мл/ч, скорость самописца – 9 см/ч). Профиль элюции регистрировали на УФ-детекторе при длине волны 280 нм. Концентрация обессоленного белка составляла 0,2 мг/мл.
Изучение спектров поглощения противоопухолевых препаратов в оптической области электромагнитного излучения проводили на спектрофотометре Evolution 300 (Thermo Fisher Scientific, США).
Для подтверждения возможности попадания комплекса ЛПВП-цитостатик и апоА-I-цитостатик в опухолевые клекти использовали флуоресцентный маркер – флуоресцеинизотиоцианат (ФИТЦ). ЛПВП и апоА-I метили 1 % раствором ФИТЦ в 0,1 М Na2HP04. Процесс конъюгации проводили при 4ºС в течение 18 ч в 0,1 М бикарбонатном буфере (рН 9,0) и в молярном соотношении белок/краситель 10/1 [7]. От свободной метки освобождались методом гель-фильтрации.
В работе использовали 1 мМ маточные растворы актиномицина Д (AppliChem, Германия) и винбластина (ЛЭНС, ФАРМ, Россия).
Взаимодействие ЛПВП и апоА-I с противоопухолевыми препаратами изучали методом спектрофлуориметрии при длине волны возбуждения 285 нм и эмиссии в диапазоне от 300 до 450 нм (Шиматзу) [8]. Титрование проводили добавлением аликвот противоопухолевого препарата (по 20 мкл) к 2 мл ЛПВП или апоА-I. Расчет константы связывания осуществляли по методу Аттала и Лата [6]. Молекулярные массы ЛПВП и апоА-I принимались за 200 кДа и 28 кДа, соответственно.
Результаты исследования и их обсуждение
Метод тушения триптофановой флуоресценции используется с конца 70-х годов и зарекомендовал себя, как объективный, высокоинформативный метод анализа взаимодействий типа «белок-лиганд» [9]. Исследование максимумов флуоресценции ЛПВП и апоА-I показало, что они отличаются по значениям длин волн. Класс ЛПВП имел максимум испускания – 336 нм, тогда как апоА-I в физиологическом растворе – 348 нм, что по литературным данным соответствует собственной флуоресценции триптофана 330-350 нм. Отличие значений можно объяснить структурной организацией липопротеиновой частицы, в которую помимо белкового компонента входят триглицерды, эфиры холестерина, холестерин и фосфолипиды.
Анализ спектров ЛПВП с исследуемыми препаратами показал снижение триптофановой флуоресценции для винбластина – 80 %, для актиномицина Д – 84 %, а для апоА-I этот показатель составил 77 % и 84 %, соответственно. Снижение флуоресценции можно характеризовать как результат образования комплекса ЛПВП-противоопухолевый препарат и апоА-I-провоопухолевый препарат [6]. На рис.1 представлены кривые тушения для комплексов ЛПВП с винбластином (А) и апоА-I с винбластином (Б).
На рисунке видны кривые тушения собственно ЛПВП и апоА-I – кривая-1, а также снижение интенсивности флуоресценции при добавлении равных аликвот винбластина. Похожие графики были получены для актиномицина Д с ЛПВП и апоА-I. Изучение временной зависимости тушения флуоресценции при одномоментном добавлении насыщающих количеств препаратов показало, что полное насыщение связывающих областей ЛПВП-частиц и апоА-I наблюдалось уже через 20 мин от начала титрования.
На основании кривых тушения флуоресценции были рассчитаны константы ассоциации при взаимодействии противоопухолевых препаратов с ЛПВП и с апоА-I и количество молекул связанных лигандов на 1 молекулу комплексообразователя (табл. 1).
Полученные данные говорят о том, что связывание характеризуется не достаточно высоким сродством, поэтому его нельзя назвать высокоспецифическим. На сегодняшний момент есть данные о реализации своего биологически активного действия для комплексов апоА-I со стероидными гормонами с константами ассоциации аналогичного порядка – 105 М-1 [10]. Основываясь на этих данных, можно было бы предположить, что и в нашем случае комплекс попадет в цитоплазму и ядра клетки мишени, а невысокая специфичность связывания белок-лиганд будет способствовать освобождению препарата внутри клетки и эффективной реализации его цитостатического эффекта.
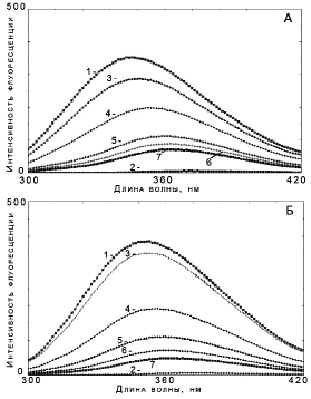
Рис. 1. Спектры триптофановой флуоресценции ЛПВП с винбластином (А) и апоА-I в комплексе с винбластином (Б): 1 – Аполипопротеин А-I; 2 – Винбластин; 3-7 – добавление аликвот винбластина к ЛПВП (А) и апоА-I (Б)
Таблица 1
Качественные и количественные характеристики взаимодействия ЛПВП и апоА-I с винбластином и актиномицином Д
|
Комплекс |
Константа связывания (Kf) |
Количество молекул связанных лигандов на 1 молекулу комплексообразователя |
|
ЛПВП-винбластин |
2,3 х 105 М-1 |
28 |
|
апоА-I-винбластин |
3,9 х 105 М-1 |
45 |
|
ЛПВП-актиномицин Д |
3,6 х 105 М-1 |
26 |
|
апоА-I-актиномицин Д |
1,4 х 105 М-1 |
12 |
Для подтверждения процесса комплексообразования, а также оценки устойчивости комплекса ЛПВП-цитостатик и апоА-I-цитостатик мы использовали метод гельфильтрации на сефадексе G-25. Предварительно мы просканировали исследуемые противоопухолевые препараты на спектрофотометре Evolution 300 для измерения спектров поглощения этих соединений в оптической области электромагнитного излучения. Концентрации препаратов были подобраны экспериментально, с учетом разрешающей способности прибора. Для актиномицина Д были определены два максимума поглощения на длинах волн 213нм и 440нм. Для винбластина так же были определены два максимума поглощения на длинах волн 220нм и 275нм. На рис. 2. Представлен профиль элюции комплекса апоА-I с актиномицином Д.
Актиномицин Д имеет максимум поглощения на длине волны 440 нм. На рис.2 видно, что актиномицин Д также поглощает в области 280 нм, кривая -1, второй пик – 13-15 мл, однако эта способность слабо выражена. При проведении элюирования на длине волны 440 нм, мы получили два пика: один совпал с пробой, в которой вышел апоА-I – это первый пик (5-9 мл) кривая под номером 2. Избыток несвязавшегося препарата вышел значительно позже – пик 2 (13-15мл). Для комплекса апоА-I с винбластином была получена аналогичная картина с визуализацией препарата на длине волны 220 нм.
Методом флуоресцентной микроскопии, используя маркер ФИТЦ, была показана возможность проникновения исследуемых комплексов в цитоплазму и ядра клеток асцитной карциномы Эрлиха. На рис. 3 можно увидеть культуру опухолевых клеток, которым в инкубационную среду был добавлен апоА-I без маркера (А). На рис. 3 (Б) комплекс апоА-I, меченного FITC c винбластином.
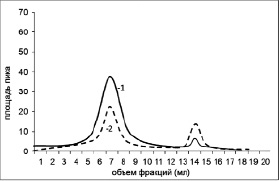
Рис. 2. Хроматографический профиль элюирования апоА-I с актиномицином Д: 1 – длина волны 280 нм; 2 – длина волны 440 нм
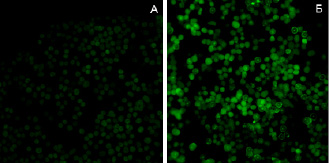
Рис. 3. Флуоресцентная микроскопия (ув. 200): А – клетки карциномы Эрлиха при добавлении апоА-I без маркера (FITC). Б – клетки карциномы Эрлиха при добавлении комплекса апоА-I, меченного FITC c винбластином
Яркое зеленое свечение в цитоплазме и ядрах клеток рисунок 3-Б подтверждает возможность проникновения комплекса апоА-I-цитостатик в опухолевые клетки. Аналогичные результаты были получены для комплексов ЛПВП и апоА-I c актиномицином Д.
Таким образом, методами тушения флуоресценции и гель-фильтрации показано, что липопротеины высокой плотности (ЛПВП) и аполипопротеин А-I (апоА-I) обладают способностью образовывать стабильные комплексы с противоопухолевыми препаратами: винбластин, актиномицин Д. Рассчитаны константы связывания и количество молекул связанных цитостатиков на 1 молекулу комплексообразователя. Показана принципиальная возможность проникновения исследуемых комплексов в цитоплазму и ядра клеток асцитной карциномы Эрлиха. Полученные результаты позволяют считать реальной возможность использования ЛПВП и апоА-I в качестве транспортных форм актиномицина Д и винбластина.
Библиографическая ссылка
Князев Р.А., Трифонова Н.В., Поляков Л.М. ИЗУЧЕНИЕ СПОСОБНОСТИ ЛИПОПРОТЕИНОВ ВЫСОКОЙ ПЛОТНОСТИ И АПОЛИПОПРОТЕИНА А-I СВЯЗЫВАТЬ И ТРАНСПОРТИРОВАТЬ ПРОТИВООПУХОЛЕВЫЕ ПРЕПАРАТЫ В КЛЕТКИ АСЦИТНОЙ КАРЦИНОМЫ ЭРЛИХА // Международный журнал прикладных и фундаментальных исследований. 2015. № 11-4. С. 538-542;URL: https://applied-research.ru/ru/article/view?id=7778 (дата обращения: 01.03.2026).

