В настоящее время нарушению функции эндотелия отводится ключевая роль в развитии атеросклероза, поскольку он принимает активное участие в многочисленных процессах, вовлеченных в его патогенез, включая поддержание тонуса сосуда и атромбогенности сосудистой стенки, систему гемостаза, воспаление, контроль пролиферации гладких миоцитов и образования сосудов в атеросклеротической бляшке, проницаемость сосудистой стенки. Ross и Glomset предположили, что в основе развития атеросклероза в рамках гипотезы «ответа на повреждение» лежит выраженное повреждение структуры эндотелия [18]. Однако в последующих исследованиях на экспериментальных моделях атеросклероза, а также в исследованиях атеросклеротических бляшек у людей не удалось документально доказать данное предположение. На текущий момент мнения ученых сходятся на том, что развитию и прогрессированию атеросклероза способствует не столько структурные изменения эндотелия, сколько нарушение его функции [9,13]. Наиболее распространенными методами количественного определения степени эндотелиальной дисфункции являются молекулярно-биологические и биохимические методы, использующиеся для измерения продукции молекул адгезии и провоспалительных медиаторов [24,27], а также нарушения регуляции системы синтазы оксида азота [17]. Однако указанные методы, как правило, требуют выделения и последующего разрушения эндотелиоцитов, в результате чего утрачиваются данные по морфологии и топографическому распределению изменений эндотелия. Результаты измерения маркеров эндотелиальной дисфункции в периферической крови предоставляют общую информацию о состоянии эндотелия в сосудистом русле в целом и требуют проведения сопоставления с морфологическими данными для наиболее точного установления их пороговых величин. В последние годы широкое распространение получило изучение уровня циркулирующих в крови эндотелиальных клеток и эндотелиальных микрочастиц в качестве биомаркеров эндотелиальной дисфункции и риска развития острых сердечно-сосудистых нарушений [20,22], однако механизмы их формирования и высвобождения изучены недостаточно. Несмотря на столь широкое освещение эндотелиальной дисфункции в клинической практике, на биохимическом и молекулярном уровнях, имеется весьма ограниченное количество данных по структурным изменениям эндотелия при атеросклерозе у людей, что определяет актуальность дальнейшего всестороннего исследования эндотелия, особенно его ультраструктурной патологии.
Материалы и методы исследования
Материалом исследования послужили 6 биоптатов – фрагментов стенки общей и внутренней сонных артерий с атеросклеротическими бляшками в них, удаленных при операции каротидной эндартерэктомии у 6 пациентов со стенозирующим атеросклерозом каротидного синуса. После иссечения все биоптаты немедленно помещали в фиксирующий раствор (18-20°C) – 2,5 % раствор глутарового альдегида на фосфатном буфере. Через 1 час фиксации каждый биоптат разрезали на поперечные блоки толщиной 3-5мм. Для световой микроскопии брали 1-2 блока из проксимальной, дистальной частей биоптата, из области максимального атеростеноза и пограничных с бляшкой участков сосуда. Данные блоки фиксировали в 10 % растворе формалина в течение 1 суток, обезвоживали, заливали в парафин и изготавливали гистологические срезы толщиной 4-5мкм, которые окрашивали гематоксилином и эозином, по методам ван Гизона и Вейгерта для определения гистологической структуры атеросклеротической бляшки. Для ультраструктурного анализа брали 1-2 поперечных среза биоптата, соседних с таковыми, взятыми для гистологического исследования. Из данных поперечных срезов вырезали 2-5 прямоугольных блока с размерами сторон 0,2-0,4 см, которые дополнительно фиксировали в 2,5 % растворе глутарового альдегида на фосфатном буфере в течение 2-3 часов, после чего промывали в фосфатном буфере 30 минут, обрабатывали 1 %-м раствором OsO4 на фосфатном буферном растворе (рН 7,35) 1-1,5 часа и подвергали обезвоживанию в спиртах возрастающей концентрации (30, 50, 70, 80, 96 % и абсолютный спирт) и пропиленоксиде. Заливку проводили в смесь эпоксидных смол (Epon 812, Epon DDSA и Epon MNA). Блоки выдерживали в течение 1-2 суток в термостате при температуре 37°С и 1 сутки – при температуре 60°С. Полутонкие и ультратонкие срезы изготавливали на ультрамикротоме LKB III-8800 (Швеция). Полутонкие срезы толщиной до 1мкм окрашивали метиленовым синим или толуидиновым синим, и они служили для оценки эндотелия и субэндотелиального слоя. С выбранного на полутонких срезах участка приготавливали ультратонкие срезы, которые окрашивали уранил-ацетатом и цитратом свинца и анализировали в электронном микроскопе JEM-1011 (JEOL, Япония).
Количественную оценку объемной доли компонентов атеросклеротической бляшки на гистологических срезах проводили точечным методом с наложением сетки [1]. Оценку ультраструктурных изменений эндотелиоцитов, степени отека и компонентов субэндотелиального слоя осуществляли полуколичественным методом с применением шкалы 0-5, где 0 – отсутствие компонента, 5 – компонент занимает более 80 % объема. Статистическую обработку данных с оценкой достоверности различий проводили с помощью непараметрического критерия Манна-Уитни, достоверность корреляционных связей проверяли с использованием коэффициента корреляции Спирмана в программе StatSoft Statistica версии 10.0 (США) при уровне значимости р<0,05.
Результаты исследования и их обсуждение
2 пациента из 6 ранее перенесли нарушение мозгового кровообращения в бассейне соответствующей внутренней сонной артерии, у 4 пациентов бляшки были «асимптомными». Преобладающим компонентом 1 бляшки являлся атероматоз с кристаллами холестерина, который занимал до половины ее объема. В 2х бляшках наряду с крупными очагами атероматоза (до 40 % объема) выявлялись многочисленные крупные, мелкие и пылевидные кальцификаты, распространявшиеся на некоторых участках практически на всю толщу бляшки и занимавшие в одной из них суммарно до трети объема. 2 бляшки являлись фиброзными и содержали большое количество сосудов, в 1 из них также обнаруживались небольшие очаги атероматоза и мелкие кальцификаты. 1 бляшка была фиброзно-кальцинозной (крупные, мелкие и пылевидные кальцификаты занимали до трети ее объема). Во всех бляшках выявлялся 1 или несколько признаков, свидетельствующих об их «нестабильности»: изъязвление покрышки в области атероматоза, резкое истончение покрышки до нескольких коллагеновых волокон в области расположения атероматоза и крупных кальцификатов, большое скопление тонкостенных сосудов в поверхностных отделах с плазматическим пропитыванием окружающей ткани и признаками старых кровоизлияний, массивная инфильтрация покрышки липофагами, лейкоцитами, резкий отек поверхностных отделов с разрыхлением и деструкцией соединительнотканных волокон, липидная инфильтрация покрышки. Атеростеноз составлял от 50 % до 90 %.
При электронно-микроскопическом исследовании обнаружено значительное разнообразие изменений эндотелия как в области различных частей самой бляшки, так и в пограничных с ней участках артерии. В 96 % полутонких срезов выявлялось от 1 до 4 дефектов эндотелиального пласта размером от нескольких клеток до 3,45мм, в области которых часто располагались фрагменты эндотелиоцитов, эритроциты или микротромбы (рис. 1). На минимально измененных участках артерии (проксимальные и дистальные отделы бляшки и пограничные с бляшкой участки стенки), где толщина интимы не превышала 0,5 мм, также обнаружены дефекты пласта, достигавшие 1,48 мм, местами с формированием «микроэрозий», когда наряду с эндотелием отсутствовал фрагмент субэндотелиального слоя с выпадением фибрина и скоплением эритроцитов в этой области (рис. 1б). При этом значимые различия в размере или количестве дефектов эндотелия между участками выраженных и минимальных изменений, а также в области симптомных и асимптомных бляшек отсутствовали (р > 0,44).
Эндотелиальный пласт был очень неоднородным – отмечено значительное разнообразие размера, формы, плотности цитоплазмы и ядер эндотелиоцитов, на основании чего было выделено 3 основных типа эндотелиоцитов. В первую группу вошли темные клетки уплощенной формы с ровной поверхностью, плотность цитоплазмы которых примерно совпадала с плотностью ядра, что затрудняло дифференцировку ядра и цитоплазмы на полутонком срезе (рис. 2а,б).
При ультраструктурном анализе в указанных клетках обнаруживалось небольшое количество органелл – преимущественно немногочисленные мелкие митохондрии, умеренно или слабо развитый гранулярный эндоплазматический ретикулум (гЭПР) с равномерным расположением прикрепленных рибосом, отдельными несколько расширенными цистернами. Цитоплазма имела среднюю электронную плотность, в ряде клеток вдоль люминальной поверхности плотность была увеличена – довольно часто в таких областях наблюдалось скопление микропиноцитозных везикул (рисунок 3а). Ядра имели среднюю плотность и несколько зазубренный контур, содержали большое количество конденсированного хроматина, который располагался в виде широкой полосы вдоль ядерной мембраны и в виде глыбок в кариоплазме. Межэндотелиальные контакты были преимущественно извитые с широкими зонами слипания. Корреляционный анализ продемонстрировал, что количество эндотелиоцитов данного типа увеличивалось с повышением количества эластических волокон и аморфного эластина в субэндотелиальном слое, а также уменьшалось с увеличением размера дефекта пласта (р<0,05). Кроме того, их количество в асимптомных бляшках было значимо выше, чем в симптомных (р = 0,031).
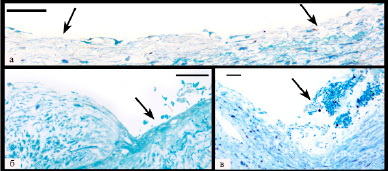
Рис. 1. Очаги нарушения целостности эндотелиального пласта. Окраска метиленовым синим, линия равна 50 мкм: а – множественные небольшие дефекты эндотелия (указаны стрелками); б – микроэрозия (отсутствует эндотелий и часть субэндотелиального слоя) с наложениями фибрина и скоплением эритроцитов (указана стрелкой); в – пристеночный тромб в области дефекта эндотелия (указан стрелкой)
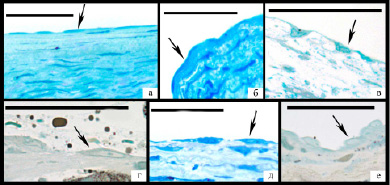
Рис. 2. Различные типы эндотелиальных клеток (указаны стрелками), линия равна 50 мкм: а,б – темные уплощенные клетки; в,г,д – увеличенные в размере эндотелиоциты неправильной формы с просветленным ядром, имеющим подчеркнутый контур и хорошо различимое ядрышко; е – резко набухшие эндотелиоциты с пузырьковидным ядром и высоким ядерно-цитоплазматическим соотношением.
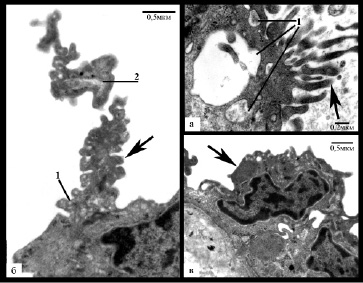
Рис. 3. Ультраструктурные изменения эндотелиоцитов: а – эндотелиоцит уплощенной формы с плотным расположением цитоплазматических филаментов и скоплением микропиноцитозных везикул по люминальной поверхности (указано стрелкой); б – мультивезикулярные комплексы (указаны стрелкой); в – расширенные цистерны аппарата Гольджи с деструкцией мембран (указано стрелкой); г – резко расширенная цистерна гЭПР с нарушением целостности мембраны и немногочисленными прикрепленными рибосомами; д – расширенные цистерны гЭПР (1) с неравномерно расположенными на мембране прикрепленными рибосомами, между которыми находятся многочисленные митохондрии (2) с вакуолями; е – резко разрыхленный хроматин в ядре, очень низкая плотность расположения цитоплазматических филаментов, расширенная цистерна гЭПР и небольшие дефекты плазматической мембраны (указан стрелкой)
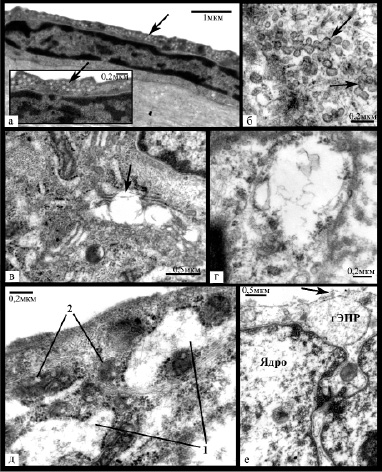
Рис. 4. Увеличение базальной поверхности (1) эндотелиоцита со снижением плотности расположения цитоплазматических филаментов в этой области (вкладка), небольшие формирующие вакуоли (2) выросты цитоплазмы в просвет артерии, гиперплазия аппарата Гольджи (3) и скопление телец Вейбеля Палладе (4) (вкладка)
Вторая группа была наиболее многочисленной и ее составили увеличенные в размере эндотелиоциты, как правило, неправильной, реже веретеновидной формы с увеличенным просветленным ядром и хорошо выраженным в большинстве клеток ядрышком, цитоплазма которых часто имела неоднородную плотность (рис. 2в,г,д). Поверхность эндотелиоцитов была в основном неровной за счет образования выростов цитоплазмы. По базальной поверхности выросты в подавляющем большинстве случаев имели широкое основание и разную длину, увеличивая поперечный размер эндотелиоцита до 2 и более раз (рис. 4). В этой области наблюдалось снижение плотности расположения цитоплазматических филаментов вплоть до полного отсутствия. При этом установлена прямая зависимость между размером базальной поверхности, выраженностью отека субэндотелиального слоя и объемом атероматоза в бляшке (р<0,05). По люминальной поверхности преимущественно обнаруживались тонкие пальцевидные выросты разной длины, которые часто формировали вакуоли (рис/ 5а). В ряде клеток наблюдались длинные разветвленные или массивные ядросодержащие выросты цитоплазмы в просвет артерии (рис. 5б,в).
Количество транспортных везикул варьировало, однако преимущественно они распределялись неравномерно и проявляли склонность к формированию скоплений. В ряде клеток их количество было резко снижено. Довольно часто обнаруживалось слияние везикул с образованием мультивезикулярных комплексов из 3-9 везикул разного размера (рис. 3б). Также выявлена различная степень гиперплазии гЭПР и аппарата Гольджи с частым расширением цистерн (рис. 3д) и участками деструкции мембран (рис. 3в,г), повышение количества и размера митохондрий и количества полисом. Как правило отмечалось неравномерное распределение прикрепленных рибосом на мембранах гЭПР с уменьшением их количества. Митохондрии имели средний или мелкий размер и располагались чаще всего вблизи цистерн гЭПР (см. рис. 3д). Преобладали митохондрии с различной степенью равномерного уплотнения матрикса, реже в них встречались участки просветления, вакуоли, гомогенизация внутреннего содержимого с его неравномерным уплотнением. Ядра в большинстве случаев имели ровный или незначительно извитой контур, эухроматин был разрыхлен, гетерохроматин был представлен узкой полоской вдоль ядерной мембраны. В основном встречались слабо извитые или щелевидные межэндотелиальные контакты с небольшими зонами или точками слипания, нередко обнаруживались зоны расхождения контактных поверхностей с формированием вакуолей и щелей. Помимо этого выявлялись и немногочисленные сильно извитые соединения, а также участки формирования дополнительных контактных областей за счет пальцевидных выростов цитоплазмы с люминальной или базальной сторон.
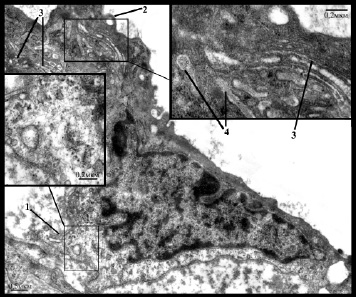
Рис. 5. Увеличение люминальной поверхности эндотелиоцитов (указаны стрелками): а – многочисленные пальцевидные выросты, формирующие вакуоли (1); б – вырост цитоплазмы в просвет артерии, содержащий везикулы (1) и цистерны гЭПР (2); в – ядросодержащие выросты
Третью группу составили очень светлые увеличенные эндотелиоциты с пузырьковидным ядром и, как правило, высоким ядерно-цитоплазматическим соотношением (рисунок 2е). Они обнаруживались преимущественно вблизи или в пределах дефектов эндотелиального пласта, при этом наблюдалась прямая зависимость между их количеством и размером дефекта пласта (R=0,523, p<0,05). Цитоплазма клеток имела очень низкую электронную плотность, нередко определялись крупные участки цитоплазмы, лишенные органелл и цитоплазматических филаментов, часто обнаруживались дефекты плазматической мембраны, хроматин был резко разрыхлен (рисунок 3е), в основном представлен разреженным хлопьевидным материалом. Органеллы были немногочисленны – в основном расширенные цистерны гЭПР с очагами деструкции мембран, набухшие митохондрии с лизированными кристами или митохондрии с различной степенью конденсации матрикса.
Обсуждение. В проведенном исследовании продемонстрировано значительное повреждение эндотелия в области нестабильных атеросклеротических бляшек каротидного синуса c частым выявлением дефектов эндотелиального пласта, что подтверждает результаты исследования с использованием сканирующей электронной микроскопии [5]. Обратило на себя внимание нередкое нарушение целостности пласта в области минимальных атеросклеротических изменений и пограничных с бляшкой визуально не измененных участках сосуда, а также отсутствие различий в размере деэндотелизированных очагов между участками выраженных и минимальных изменений. Выявленные изменения могут быть связаны с нарушением ламинарного потока крови, появлением зон турбулентности, обратного тока и изменением напряжения сдвига в краевых отделах бляшки [15,28]. Доказано, что гемодинамические характеристики определяют местоположение повреждений и вносят значительный вклад в патогенез атеросклероза [14,26]. Нарушение потока крови изменяет профиль секретируемых эндотелием веществ и экспрессируемых молекул в провоспалительном, прокоагулянтом направлении, активирует апоптоз эндотелиоцитов, увеличивает скорость их обновления [6,10,11]. Признаков апоптоза эндотелиоцитов вблизи или в области дефектов в настоящем исследовании обнаружено не было. Напротив, в этих участках выявлялись преимущественно отечные клетки с резко выраженными дистрофическими изменениями, признаками нарушения биоэнергетической функции и повышения проницаемости плазматической мембраны или подвергающиеся деструкции по типу колликвационного некроза.
Сохранный эндотелиальный пласт был весьма неоднородным. Преобладали гипертрофированные клетки неправильной формы с признаками стимуляции биосинтеза белка и повышенного энергопотребления, о чем свидетельствовала гиперплазия гЭПР, пластинчатого комплекса, повышение количества полисом, количества и размера митохондрий. Сходные изменения эндотелиоцитов наблюдались на экспериментальных моделях атеросклероза [23], а также при атеросклерозе у людей [4,19]. Согласно данным литературы, такого типа клетки, часто имеющие кубическую форму, могут представлять популяцию «активированных» эндотелиоцитов, демонстрирующих не только протромботический фенотип, на что указывало повышенное содержание фактора фон Виллебранда [4], но также провоспалительный фенотип, о чем свидетельствовал повышенный уровень активированного нуклеарного фактора каппа-В и повышенная экспрессия молекул адгезии [3]. Дополнительный довод в подтверждение того, что кубическая форма эндотелиоцитов отражает провоспалительный и протромботический фенотип, был получен на общепринятой гиперхолестеринемической модели атеросклероза на кроликах [12]. Авторы обнаружили, что по мере нарастания эндотелиальной дисфункции увеличивалось количество кубических клеток, которые через 1 месяц после отмены холестерина снова меняли форму с кубической на уплощенную. В связи с последним можно предположить, что гипертрофические изменения эндотелиальных клеток могут представлять и адаптивный клеточный ответ, вызванный их повреждением.
Кубическая форма эндотелиальных клеток в проведенном исследовании являлась не самой распространенной – преобладали клетки неправильной, амебовидной формы, хотя четких различий в их ультраструктурной организации не наблюдалось. Все клетки отличались повышенной метаболической активностью, различалась лишь ее степень и выраженность дистрофических изменений. Форма клеток как таковая в основном определялась характером базальной поверхности эндотелиоцитов – в большинстве клеток она была сильно увеличена за счет многочисленных выростов цитоплазмы на широком основании, причем степень увеличения площади поверхности коррелировала с выраженностью отека субэндотелиального слоя и объемом атероматоза в бляшке. Сходные результаты были получены на экспериментальной модели атеросклероза – отмечено увеличение базальной поверхности по мере накопления липидов и пенистых клеток в интиме, отека и разрыхления субэндотелиального слоя [23]. Авторы предполагали, что данный феномен направлен на укрепление связи эндотелиоцитов с межклеточным матриксом и внутренней эластической мембраной, учитывая повышенную плотность цитоплазматических филаментов в области выростов. В настоящем исследовании, напротив, плотность расположения филаментов в этой области была снижена, причем ее снижение было пропорционально степени выраженности отека и распада волокон в субэндотелиальном пространстве. Данный феномен может обусловливать утрату контактов эндотелиоцитов с подлежащим веществом, способствуя их слущиванию, и, как следствие, повысить уровень циркулирующих эндотелиальных клеток в крови, который, согласно литературным данным, коррелирует с величиной комплекса интима-медиа в сонной артерии, может непосредственно отражать степень повреждения сосуда и являться независимым прогностическим показателем риска развития инфаркта головного мозга [7]. Косвенным доказательством данного предположения могут служить периодами обнаруживаемые частично слущенные с поверхности и находящиеся в просвете артерии эндотелиоциты.
Люминальная поверхность многих клеток также претерпевала значительные изменения вследствие образования пальцевидных выростов, что согласовалось с данными сканирующей электронной микроскопии [25]. Наличие выростов на поверхности эндотелиоцитов может служить мембранным резервом для предотвращения любого повышения давления на мембрану при изменении гидродинамических параметров [21]. Это также может отражать повышенную проницаемость эндотелия вследствие активации неспецифического эндо-/ экзоцитоза, в пользу чего свидетельствовали различные этапы формирования вакуолей пальцевидными выростами, а также повышение в цитоплазме количества крупных вакуолей, содержимое которых было сходным по составу с фибриллярным или хлопьевидным материалом, находящимся в субэндотелиальном слое или в просвете артерии. В дополнение, на повышение проницаемости эндотелия также указывает часто выявлявшееся слияние микропиноцитозных везикул в гроздья или розетки, что может считаться признаком усиления транспорта макромолекул через стенку сосуда [2]. Так, выросты цитоплазмы эндотелиоцитов в просвет артерии также обнаруживались в областях повышенной проницаемости аорты, выявляемых с использованием красителя синего Эванса [8]. Эндотелиоциты в данных участках были увеличены в размере, имели хорошо развитый гЭПР, межэндотелиальные контакты упрощались и укорачивались, часто встречались контакты «конец в конец», их расширение с образованием вакуолей, что также было характерно для эндотелиоцитов с повышенной метаболической активностью в настоящем исследовании. Кроме того, выросты цитоплазмы по люминальной поверхности эндотелиоцитов по типу микроворсинок или более крупных выростов могут служить источником циркулирующих эндотелиальных микрочастиц, уровень которых, по данным литературы, повышается у пациентов с симптомными атеросклеротическими бляшками в сонной артерии [20] и инсультом [22]. Данные частицы несут на своей поверхности антигены и рецепторы исходной клетки и таким образом способны активировать клетки-мишени, изменять их фенотип и функцию [16].
Реже всего встречались уплощенные клетки с низким уровнем обменных процессов, а именно со слабым развитием гЭПР, аппарата Гольджи, немногочисленными органеллами, в том числе малым количеством небольших митохондрий, большим количеством гетерохроматина. Данные «неактивные» клетки или клетки со слабой метаболической активностью преимущественно располагались в областях с большим количеством эластических волокон и аморфного эластина в субэндотелиальном пространстве, и их количество резко снижалось с усилением дестабилизирующих структуру бляшки деструктивных процессов параллельно с увеличением доли «активированных» клеток. На основании этого можно предположить, что данный тип клеток может быть показателем стабильности структуры бляшки, в пользу чего также свидетельствует значимо меньшее их количество в симптомных атеросклеротических бляшках с изъязвлением поверхности в области атероматоза.
Границы между тремя основными выделенными типами эндотелиоцитов были несколько стертыми – так, в ряде темных клеток отмечалось повышение объемной доли гЭПР, количества и размера митохондрий, просветление цитоплазмы, ядра, упрощение межэндотелиальных контактов. В активированных клетках нередко наблюдались признаки нарушения внутриклеточных обменных процессов в виде участков деструкции мембран и расширения цистерн аппарата Гольджи, гЭПР со снижением количества и неравномерным расположением прикрепленных рибосом, набухание митохондрий с лизисом крист, вакуолизация и конденсация межмембранного пространства митохондрий. Ядра ряда клеток были набухшими, цитоплазма сильно просветлена. Крайняя степень изменений обнаруживалась в отечных клетках третьего типа. На основании этого можно предположить, что указанные типы клеток представляют лишь последовательные стадии одного процесса – под действием различных стимулов происходит повышение метаболической активности эндотелиоцита с его гипертрофией в качестве приспособительной реакции. В случае исчезновения или снижения интенсивности стимулов клетка возвращается в исходное «неактивное» состояние. Если же стимулы не исчезают, по мере истощения адаптивных возможностей в эндотелиоците появляются дистрофические изменения, которые в определенный момент становятся необратимыми, и клетка подвергается некрозу.
Заключение
Таким образом, проведенное исследование свидетельствует о значительных ультраструктурных изменениях эндотелия сонных артерий при атеросклерозе, что может отражаться в его дисфункции, выявляемой в клинических условиях. Обнаруженные многочисленные и разнообразные изменения не ограничивались только областью атеросклеротической бляшки, распространяясь и на пограничные с ней участки артерии, и в наибольшей степени проявлялись в симптомных бляшках. Ряд изменений может лежать в основе повышения уровня циркулирующих эндотелиоцитов и эндотелиальных микрочастиц в крови по мере прогрессирования атеросклероза и усиления дестабилизирующих структуру бляшки процессов. Для установления патогенеза этих изменений необходимы дальнейшие морфологические исследования с использованием как электронной микроскопии, так и иммуногистохимии, а также клинико-биохимических и морфологических сопоставлений.
Библиографическая ссылка
Евдокименко А.Н. УЛЬТРАСТРУКТУРНЫЕ ИЗМЕНЕНИЯ ЭНДОТЕЛИЯ В ОБЛАСТИ НЕСТАБИЛЬНЫХ АТЕРОСКЛЕРОТИЧЕСКИХ БЛЯШЕК КАРОТИДНОГО СИНУСА // Международный журнал прикладных и фундаментальных исследований. 2015. № 11-5. С. 639-647;URL: https://applied-research.ru/ru/article/view?id=7853 (дата обращения: 24.02.2026).

