Инсульт является исходом разнообразных по своей природе заболеваний сосудов головного мозга, сердца и крови. Но наиболее тесно, патогенез ОНМК связан с патологией сердца. В настоящее время описано около 20 кардиальных нарушений, сопряженных с церебральной эмболией. Многообразие кардиальных нарушений, обнаруживаемых у 70 % пациентов с ишемическим инсультом требует анализа клинико-инструментальных данных, разработки дифференцированного подхода в восстановительном лечении. Кардионеврология – новая интегративное направление медицины на стыке нескольких клинических дисциплин (неврология, кардиология, кардиохирургия, нейрохирургия), целью которой является исследование сердца при различных формах сосудистых поражений головного мозга, совершенствование методов диагностики, профилактики и терапии кардиальных осложнений при ОНМК [1].
Одним из направлений кардионеврологии является изучение кардиальных нарушений в острой фазе инсульта и раннем периоде постинсультного восстановления. Прежде всего, это затрагивает реактивные изменения сердечно-сосудистой системы в остром периоде инсульта, которые определяют высокую вероятность возникновения патологических изменений в сердце и обозначаются в литературе термином «цереброкардиальный синдром» Цереброкардиальные эффекты острого периода ишемического инсульта различны. Во-первых, происходит усиление аритмической активности, определяемое величиной очагового поражения головного мозга и ухудшение со стороны сопутствующей хронической кардиальной патологии [1]. Во-вторых, нарушается автономная регуляция сердечного ритма, что выражается в нивелировании циркадных различий частоты сердечных сокращений и взаимосвязано с локализацией церебрального поражения. В ряде случаев выявляемые сдвиги носят стойкий характер и потенциально могут влиять на течение раннего реабилитационного периода. У больных в острой стадии ишемического инсульта выявлена отрицательная связь между степенью неврологического восстановления и наличием пароксизмов фибрилляции предсердий (ФП), числом брадиаритмических эпизодов и безболевой ишемии миокарда. По данным литературы, применение реабилитационных программ привело к достоверному снижению смертности от всех причин на 20 %, в том числе, от сердечно-сосудистых – на 26 % [3]. Физические упражнения являются основой реабилитационных программ в кардионеврологии. Расширение режима двигательной активности пациента с ОНМК без предварительной подготовки, является стрессовым фактором, и может способствовать декомпенсации сердечно-сосудистой деятельности. Одним из основных принципов кардиореабилитации является строгая дозированность и этапность физической нагрузки в зависимости от степени компенсации сердечной деятельности. ФР у пациентов неврологического и нейрохирургического профиля в остром периоде принципиально отличается от реабилитации больных кардиологического и соматического профиля, и обусловлена нарушением витальных функций (дыхание, глотание), когнитивным и речевым дефицитом, недостаточностью супраспинального двигательного контроля [2]. Полиэтиологичность и многофакторность церебрального инсульта исключает жесткое постулирование программы реабилитации. В остром периоде инсульта лейтмотивом при составлении реабилитационной программы должно служить обеспечение безопасности проводимого лечения. Осложнения в остром периоде ОНМК включают: ортоклиностатические и вегетативно-сосудистые реакции, нарушения сердечного ритма и проводимости, ишемия миокарда, развитие тромбоэмболии, гиповентиляции. Поэтапная стабилизация и увеличение объема функциональных возможностей систем жизнеобеспечения является базой для расширения режима двигательной активности.
В настоящее время необходимо совершенствование методов ФР, разработка критериев оценки реабилитационного потенциала у пациентов с ОНМК в остром периоде в сочетании с кардиальной патологией.
Цель. Изучить эффективность спиральной модели ФР при ранней функциональной активации пациентов в остром периоде ОНМК в сочетании с кардиальной патологией.
Материал и методы. Проведено лечение 32 пациентов в возрасте от 41 до 83 лет, средний возраст – 62 ± 2 г (15 мужчин и 17 женщин) в 2010–2014 гг., в остром периоде ишемического инсульта (ИИ) в различных стационарах С.-Петербурга с первых дней поступления (табл. 1, 2).
Таблица 1
Нозологическая структура кардиальной патологии
|
Коморбидная патология сердца в анамнезе |
Количество пациентов N = 32 |
|
Постоянная форма фибрилляции предсердий при неклапанной патологии сердца (ГБ) |
11 |
|
ИБС, стенокардия напряжения I-III ФК |
6 |
|
Пациенты после реконструктивных операций на коронарных артериях |
5 |
|
Состояние после протезирования клапанов сердца |
3 |
|
Дилатационная кардиомиопатия |
3 |
|
Открытое овальное окно |
1 |
|
Комбинированная патология сердца |
4 |
Таблица 2
Распределение пациентов в зависимости от пораженного бассейна
|
Сосудистый бассейн ОНМК |
Количество пациентов N = 32 |
|
ЛСМА |
13 |
|
ПСМА |
8 |
|
ВББ |
6 |
|
Зона смежного кровообращения |
5 |
Тяжесть неврологического дефицита определялась в динамике по шкале NIHSS на 1-ые и 21-ые сутки заболевания. Эффективность ранней реабилитации оценивалась на 21-ые сутки по результатам модифицированного теста 6-минутной ходьбы с определением индекса двойного произведения (ДП) – систолического АД на ЧСС до тренировки в покое и на высоте физической нагрузки. ЧСС – самый простой показатель контроля уровня тренирующей нагрузки в кардиореабилитации. ДП косвенно характеризует функциональные возможности миокарда. Доказано, что величина двойного произведения коррелирует с величиной максимального потребления кислорода миокардом. У здоровых мужчин этот индекс равен 290–310 единиц, у больных ИБС снижается до 150–278 единиц ниже [3]. Мы использовали этот показатель как маркер физиологического течения процесса восстановления церебральных и кардиальных нарушений острого периода ОНМК, конечной задачей которого была «экономизация» работы сердца в сочетании с поддержанием адекватной мозговой перфузии. Динамика неврологического дефицита и степени бытовой адаптации оценивался по стандартным шкалам – индексу мобильности Ривермид, индексу Бартел на 1, 11, 21-ые сутки [4].
Результаты. Выбор двигательного режима определялся индивидуально с учетом выраженности неврологического дефицита, значения фракции выброса (ФВ) по данным ЭКГ, эхокардиографии в состоянии покоя. Физические упражнения сопровождались текущим контролем клинического состояния больных, включавшим опрос, осмотр, измерение АД и пульса.
Спиральная модель ФР на первом этапе (1–4 сутки) включала базовый комплекс упражнений и воздействий, направленных на рефлекторную коррекцию нейрогуморальной регуляции кардиореспираторной системы. Активизация произвольного дыхания у пациентов с ОНМК является единственным физиологическим механизмом, способствующим формированию коллатерального кровообращения и восстановлению ауторегуляции мозгового кровообращения. В структуру базового комплекса входила постуральная рефлекторно-мимическая, артикуляторная гимнастика в положении лежа на спине без осевой нагрузки, формирование физиологического дыхательного паттерна в сочетании с движениями малой амплитуды в аксиальных и дистальных мышцах с использованием специальных психолого-педагогических приемов, необходимых для обязательного достижения активного, сознательного «включения» больного в тренинг.
Рефлекторный принцип воздействия заключался в одномоментном раздражении нескольких сенсорных систем: зрительного, слухового, вестибулярного, кинестетического анализаторов. С целью воздействия на мышечный тонус и усиления эффекта от лечебного воздействия использовались различные виды бимануальной коррекции: касание, поглаживание, постукивание, тракция, вибрация, сопротивление, прессорное воздействие на различные мышечно-сухожильные группы в кранио-каудальном или проксимально-дистальном направлении.
На основе базового комплекса на втором этапе (5–11- ые сутки) совершенствование физических способностей позволило продолжить расширение двигательного режима и осуществить перевод в вертикальное положение без ортостатических реакций и тромбоэмболических осложнений с последующим самостоятельным выполнением базового комплекса упражнений и тренировочной ходьбой в пределах палаты и отделения на третьем этапе (11–21-ые сутки). АД и ЧСС измерялись в начале тренировки и на высоте нагрузки. Используемый «спиральный» тип модели ФР заключался в формировании двигательных навыков на каждом последующем новом уровне в сочетании с повторением упражнений, освоенных на предыдущем этапе. Обязательным компонентом ФР было использование средств внешней фиксации крупных суставов для придания среднефизиологического положения конечности, в виде полужестких корригирующих ортезов, кинезиотейпирования паретичных мышечных групп.
Результат ранней физической реабилитации оценивался как хороший при достижении на 21-сутки индекса Ривермид 5б и более баллов, при увеличении значения ДП после тренировки не более чем на 20 ед., удовлетворительный – при значении индекса Ривермид, равному от 3б до 5б и нарастании значения ДП более 20 ед., относительно удовлетворительный – при значении индекса Ривермид меньше или равно 3б независимо от значения ДП.
Все пациенты при поступлении имели выраженный и умеренно выраженный сенсо-моторный дефицит. Средний балл по шкале NIHSS на 1-ые сутки составил 8,4б. Все пациенты активизированы, переведены в вертикальную позицию (в исходное положение стоя) без ортостатических, гипостатических, тромбоэмболических осложнений, приступов стенокардии, значимых отклонений со стороны психоэмоциональной сферы. В динамике на 21-ые сутки лечения отмечалось уменьшение неврологического дефицита по шкале NIHSS с 8,4 до 4,5б. Прирост среднего значения индекса Ривермид на 21-ые сутки ИИ составил 5б. (рис. 1).
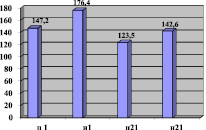
Рис. 1. Исходы острого периода ИИ по среднему значению ДП в покое (п) и при нагрузке(н) на 1-ые и 21-сутки ОНМК
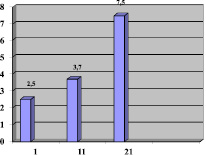
Рис. 2. Исходы острого периода по среднему значению индекса мобильности Ривермид в баллах
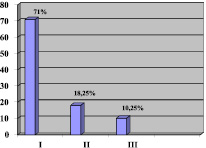
Рис. 3 Оценка восстановления функциональной активности пациентов с ИИ на 21-ые сутки: I – хороший, II – удовлетворительный, III – относительно удовлетворительный
По данным динамики ДП на 21-ые сутки хорошие результаты получены у 27 пациентов (84,3 %), удовлетворительные у 3 (11 %) и относительно удовлетворительные у 2 (4,7 %) (рис. 2).
Хороший результат восстановления получен у 23 пациентов (71 %), удовлетворительный – 6 (18,75 %), относительно удовлетворительный – 3 (10,25 %) (рис. 3).
При оценке степени нарушения бытовой адаптации отмечалось увеличение значения индекса Бартел с 42,3 на 1-ые сутки до 64,2 на 21-ые сутки (рис. 4).
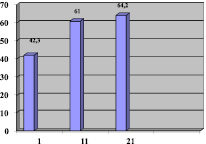
Рис. 4. Динамика среднего значения индекса Бартел на 1, 11, 21-ые сутки раннего восстановительного периода
Заключение
На основании полученных данных можно предполагать необходимость включения в программу ранней ФР пациентов с ИИ в сочетании с патологией сердца методики адаптивной кардиреспираторной рефлекторной подготовки в рамках «спиральной» модели ФР с последующим расширением двигательного режима. Использование данной методики способствует повышению реабилитационного потенциала в отношении двигательного дефицита, уменьшению потребности миокарда в кислороде, профилактике ранних тромбоэмболических, ортостатических осложнений, повышению мотивации к дальнейшему восстановительному лечению, стабилизации психоэмоционального состояния. Необходимость оценки реабилитационного потенциала с учетом патологии сердца у данной категории пациентов требует разработки новых методик и шкал в будущем.
Библиографическая ссылка
Соколова Ф.М., Иванова Н.Е., Прокудина М.Н. ДИФФЕРЕНЦИРОВАННЫЙ ПОДХОД К ФИЗИЧЕСКОЙ РЕАБИЛИТАЦИИ У БОЛЬНЫХ С ИШЕМИЧЕСКИМ ИНСУЛЬТОМ В СОЧЕТАНИИ С КАРДИАЛЬНОЙ ПАТОЛОГИЕЙ // Международный журнал прикладных и фундаментальных исследований. 2015. № 12-3. С. 463-466;URL: https://applied-research.ru/ru/article/view?id=7956 (дата обращения: 28.12.2025).

