Выявление структурных эквивалентов диспластических поражений крупных суставов остается одной из фундаментальных проблем клинической морфологии и реконструктивно-восстановительной хирургии. Существенный вклад в раскрытие механизмов патогенеза остеоартроза вносят исследования суставов животных, подвергшихся различным воздействиям, в результате которых в тканевых компонентах суставов возникают изменения, аналогичные таковым при данной патологии. Несомненный интерес представляют также сведения, касающиеся структурно-функционального состояния костно-хрящевых компонентов тазобедренного сустава в условиях использовании различных методов лечебной коррекции данной артропатии. Это связано с полиморфизмом постоперационных преобразований, характеризующимися не только местными, но и общими реакциями организма, комплекс которых определяет характер репаративной регенерации в зоне повреждения и сроки восстановления функциональной пригодности органа. Для восполнения дефицитов знаний в этом вопросе особое значение приобретают экспериментальные исследования, направленные на изучение как общей биологической реакции организма, так и локальных изменений.
В связи с этим целью нашего исследования было установить комплекс структурно-функциональных преобразований тазобедренного сустава при экспериментальном моделировании диспластического поражения и дальнейшем его хирургическом лечении с использованием аутотрансплантата в условиях применения аппарата внешней фиксации.
Материалы и методы исследования
Эксперимент выполнен на 26-ти беспородных собаках обоего пола в возрасте 4–8 месяцев (количество суставов – 26). Содержание животных, оперативные вмешательства и эвтаназию осуществляли согласно требованиям «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» [2]. Предварительно осуществляли моделирование ацетабулярной дисплазии сустава. Для этого выполняли остеоэктомию дорсального края вертлужной впадины без повреждения связки головки бедренной кости [3]. Критерием отбора животных для дальнейшего оперативного лечения было наличие сформировавшейся картины диспластического поражения сустава с подвывихом и соответствующими рентгенологическими признаками (латерализация головки бедренной кости, уплощение вертлужной впадины, степень костного покрытия головки менее 1/2). В основе оперативного лечения – принцип формирования свода вертлужной впадины методом внесуставной полукружной ацетабулопластики с применением аутотрансплантата и аппарата внешней фиксации [3, 4]. Условия внешнего чрескостного остеосинтеза позволили стабильно зафиксировать аутотрансплантат с одновременным обеспечением разгрузки суставных поверхностей. Аппарат демонтировали на 21 сутки эксперимента.
Для стандартизации эксперимента и правильного анализа результатов животных выводили из опыта в строго определенные сроки: через 14, 30, 60, 120 и 180 суток после моделирования патологии, а также в процессе лечения на 14-е, 21-е сутки фиксации аппаратом, и через 30 и 90 суток после его демонтажа.
В работе использовали клинико-экспериментальный, рентгенографический и гистологический методы исследования. Рентгенографию костей таза и бедра осуществляли с использованием рентгеновского аппарата «Premium VET» (Sedecal, Испания) до и после хирургического вмешательства, а также в указанные выше сроки эксперимента.
Для гистологического исследования материал проводили по стандартной методике, парафиновые срезы окрашивали гематоксилином и эозином. Объекты анализа – суставной хрящ с подлежащей субхондральной костью головки бедренной кости и вертлужной впадины. Исследование препаратов проводили методом световой микроскопии с использованием микроскопа «Никмед-5» (Россия). Изображения препаратов оцифровывали на аппаратно-программном комплексе «ДиаМорф» (Россия) и анализировали в программе «ВидеоТест 4,0 Мастер» (Россия).
Результаты исследования и их обсуждение
Через две недели после оперативного моделирования патологии, выявили изменения, локализовавшиеся, по большей части, в поверхностной зоне нагружаемых участков суставного хряща: очаги разволокнения, формирование множественных узур, а также эозинофилию межклеточного вещества,. В промежуточной и глубокой зонах повышена клеточная плотность, определяются очаговые пролифераты. Отмечены нарушение базофильной линии и сосудистая инвазия хряща.
Через 30 суток эксперимента деструктивные изменения прогрессировали. По краю головки бедренной кости хрящ покрыт синовиальным паннусом клеточного типа, архитектоника хряща нарушена. В промежуточной зоне повышена клеточная плотность, большое количество изогенных групп. Субхондральная кость была подвержена выраженным реактивным преобразованиям: активная сосудистая инвазия, изменение тинкториальных свойств костных трабекул и их локальное склерозирование (рис. 1, а). В суставном хряще свода впадины отмечено формирование глубоких узур, очаговые пролифераты, нарушение целостности базофильной линии, проникновение сосудов в хрящ. Дно впадины образовано васкуляризованной грануляционной тканью с преобладанием толстых пучков коллагеновых волокон, расположенных вдоль линии нагрузки (рис. 1, б).
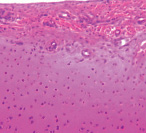
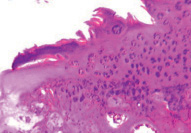
а б
Рис. 1. Модель диспластического поражения, срок эксперимента 30 суток. Парафиновый срез, окраска гематоксилином и эозином: а – суставной хрящ головки бедренной кости, покрыт синовиальным паннусом. Об. 6,3; ок.12,5х; б – разволокнение суставного хряща свода вертлужной впадины. Ок.12,5; об. 2,5х
Через 60 суток эксперимента в одном наблюдении в нагружаемой части головки бедренной кости суставной хрящ отсутствовал. Центральная зона была представлена субхондральной костью, покрытой костномозговым паннусом. В субхондральном отделе выявлено разрежение костных трабекул, уменьшение их толщины и увеличение межтрабекулярных промежутков. В других наблюдениях хрящ покрыт синовиальным паннусом клеточного типа (рис. 2, а). Со стороны дна впадины отмечено разрастание грануляционной ткани в суставную полость и на поверхность хряща (рис. 2, б).
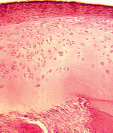
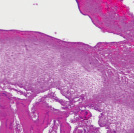
а б
Рис. 2. Модель диспластического поражения, срок эксперимента 60 суток. Парафиновый срез, окраска гематоксилином и эозином. Об. 2,5; ок.12,5х: а – суставной хрящ головки бедренной кости покрыт синовиальным паннусом; б – распространение грануляционной ткани на поверхность хряща свода вертлужной впадины
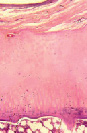
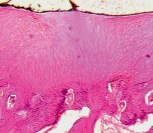
а б
Рис. 3. Модель диспластического поражения, срок эксперимента 180 суток. Парафиновый срез, окраска гематоксилином и эозином. Об. 2,5; ок.12,5х: а – суставной хрящ головки бедренной кости разволокнен, покрыт синовиальным паннусом; б – суставная выстилка свода вертлужной впадины: нарушение зональности строения, замещение соединительной тканью, отсутствие базофильного раздела
Через 120 суток суставной хрящ нагружаемых участков головки бедренной кости покрыт синовиальным паннусом клеточного типа, за счет чего высота суставной выстилки резко увеличена. Под паннусом большая часть хондроцитов в состоянии гибели и деструкции, со стороны субхондральной кости отмечено формирование глубоких трещин. Суставная выстилка вертлужной впадины была покрыта паннусом, замещающим гиалиновый хрящ. На границе с паннусом хондроциты образовывали многочленные изогенные группы. В субхондральных отделах отмечено усиление процессов костеобразования.
Через 180 суток эксперимента отмечали деформацию головки бедренной кости. Наблюдалось обильное разрастание синовиальной оболочки по суставной поверхности в полость сустава. Под паннусом хрящ подвержен глубоким деструктивным изменениям: матрикс разволокнен, снижена интенсивность его окраски, хондроциты в состоянии гибели (рис. 3, а). Суставная выстилка свода впадины по периферии покрыта синовиальным паннусом. Нарушена архитектоника хряща, наблюдалась демаскировка коллагеновых волокон, часть клеток в состоянии деструкции, гиалиновый хрящ замещался растущей со стороны субхондральной кости соединительной тканью. Дно впадины образовано васкуляризованной соединительной тканью с прослойками жировой клетчатки (рис. 3, б).
Через 14 суток после проведения ацетабулопластики на макропрепаратах головка бедренной кости была центрирована в вертлужной впадине. Смещения аутотрансплантата не наблюдали, четкая граница между ним и костным ложем отсутствовала. Резорбция костной ткани трансплантата происходила, главным образом, по сосудистым каналам, о чем свидетельствовала их неровная поверхность и отложение нового костного вещества по стенкам расширенных сосудистых каналов. Хрящевое покрытие свода вертлужной впадины было представлено гиалиновым хрящом, покрытым паннусом клеточного типа. Цитоархитектоника и целостность базофильной линии нарушены не были. Ближе к области дна впадины в суставном хряще были обнаружены деструктивные изменения. В прилежащих неповрежденных участках наблюдали активную пролиферацию хондроцитов. Суставная поверхность в ранее не нагружаемой области головки бедренной кости была не разволокнена, зональное строение – не нарушено. В ранее нагружаемой области со стороны связки отмечены горизонтальные и вертикальные трещины, узуры, а также гибель части клеток поверхностной зоны. Реакция хряща на данном этапе хондрорепаративного процесса выражалась в возбуждении пролиферативных возможностей хондроцитов – выявлены многочленные изогенные группы.
В конце периода фиксации аппаратом (21-е сутки) на анатомических препаратах существенных изменений не зарегистрировано, миграции аутотрансплантата не наблюдали. На гистотопограммах отмечено частичное (только по периферии) замещение аутотрансплантата новообразованной костной тканью. Хрящевая выстилка свода вертлужной впадины была представлена гиалиновым хрящом без признаков фибрилляции поверхности; нарушение целостности базофильной линии наблюдали лишь ближе к дну впадины. В ранее не нагружаемой области головки бедренной кости суставной хрящ сохранял зональную дифференцировку. В поверхностной зоне хондроциты не встречались, либо обнаруживали лишь контуры клеточных лакун. В промежуточной зоне отмечена активная пролиферация – образование гигантских многоклеточных изогенных групп. В ранее нагружаемой области головки бедренной кости, ближе к центральной части, имели место структурные изменения: истончение, разволокнение суставной поверхности. В центральной части головки поверхностная зона отсутствовала, и зафиксировано очаговое скопление гигантских изогенных групп. На всем протяжении суставного покрытия головки бедренной кости синовиальный паннус выявлен не был.
Через 30 суток после демонтажа аппарата на анатомических препаратах сохранялся сформированный свод вертлужной впадины. Головка бедренной кости имела округлую форму в результате сглаживания неровностей за счет покрытия ее тонким слоем хряща. На гистотопограммах к этому сроку граница между аутотрансплантатом и костным ложем отсутствовала. Резорбция костного вещества аутотрансплантата происходила по сосудистым каналам, на костной поверхности которых располагались активные остеобласты. Суставная выстилка свода вертлужной впадины была представлена гиалиновым хрящом, который сохранял органоспецифическое строение. Ближе к области дна поверхность хряща была покрыта паннусом клеточного типа. Имело место нарушение целостности базофильной линии, а в хряще встречались зоны резорбции. В отдельных участках со стороны костной ткани отмечены весьма массивные очаги пролиферирующего и разностепенно созревающего гиалинового хряща с очагами энхондрального остеогенеза (рис. 4, а). В краевых (периферических) отделах головки бедренной кости обнаружили участки новообразованного хряща, близкого по своим морфологическим характеристикам к гиалиновому, отличающегося от зрелой хрящевой ткани отсутствием кальцифицированного хряща и базофильного раздела, высокой клеточной плотностью и малоразвитым матриксом (рис. 4, б). Под хрящевым покрытием была сформирована субхондральная кость в виде замкнутой пластинки, при этом сохранялись участки контакта костного мозга с новообразованным хрящом. До места фиксации связки головки бедренной кости суставная поверхность была представлена зрелым гиалиновым хрящом, также покрытым паннусом. Ближе к связке выявлено нарушение целостности базофильного раздела и проникновение костно˗мозгового паннуса. В нагружаемой области головки бедренной кости в зоне центральной части паннус отсутствовал, а хрящ истончался. Отмечено разволокнение суставной поверхности вплоть до глубокой зоны, при этом хондроциты образовывали многоклеточные изогенные группы. От периферии головки обнаружены участки новообразованного хряща, близкого по своим морфологическим характеристикам к гиалиновому, но отличающегося от зрелого хряща высокой клеточной плотностью и тинкториальными свойствами (менее интенсивной окраской межклеточного вещества). Также имело место формирование базофильного раздела.
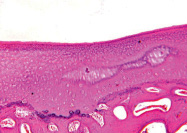
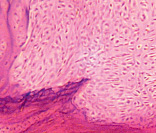
а б
Рис. 4. 30 суток после демонтажа аппарата: а – суставная выстилка свода вертлужной впадины: гиалиновый хрящ, имеющий обычное строение; в области дна поверхность хряща покрыта паннусом клеточного типа, имеются зоны резорбции, ок. 12,5, об. 2,5; б – суставной хрящ головки бедренной кости: участки новообразованного хряща, ок. 12,5, об. 6,3. Парафиновые срезы. Окраска гематоксилином и эозином. Общий срок эксперимента 116 суток
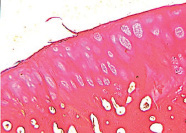
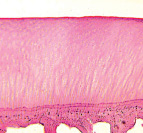
а б
Рис. 5. 90 суток после демонтажа аппарата: а – пролиферация хондроцитов суставной выстилки вертлужной впадины; б – суставной хрящ головки бедренной кости: формирование базофильной линии, зональное строение. Ок. 12,5, об. 2,5.. Парафиновые срезы. Окраска гематоксилином и эозином. Общий срок эксперимента 182 суток
Через 90 суток после демонтажа аппарата граница между аутотрансплантатом и костным ложем отсутствовала. Трансплантат почти полностью был замещен новообразованной костной тканью, представленной хаотично расположенными остеонами. Отмечали разволокнение хрящевой выстилки свода вертлужной впадины, а хондроциты активно пролиферировали, образуя гигантские изогенные группы. Ближе к области дна впадины архитектоника хряща была нарушена, происходило формирование узур (рис. 5, а). На большем протяжении гиалиновый хрящ головки бедренной кости сохранял зональную дифференцировку. Он не был разволокнен, целостность базофильной линии не нарушена, при этом наблюдали снижение интенсивности окраски межклеточного вещества. В центральной области толщина хряща была увеличена (рис. 5, б).
Состояние суставного хряща является важным не только для диагностики остеоартроза, но и для оценки прогрессирования заболевания [5, 6]. Анализ результатов данного эксперимента показал, что при моделировании диспластического коксартроза в суставном хряще выявлены необратимые деструктивные изменения, выражающиеся разволокнением коллагеновых волокон, формированием узур, гибелью хондроцитов, Отмечали нарушение целостности tidemark и прорыв фронта минерализации, сопровождающийся нарушением взаимоотношений суставного хряща и субхондральной кости, а также изменениями цитоархитектоники. Известно, что при расстройстве функции хондроцитов или их гибели происходит, пролиферация неполноценных хондроцитов. Они вырабатывают уменьшенное количество протеогликанов, состав которых также изменен. Неполноценные и нестабильные протеогликаны менее агрегированы, что позволяет им легко покидать матрикс [6]. В данном исследовании на начальных этапах процесс деструкции сопровождался активной пролиферацией хондроцитов. С увеличением сроков эксперимента прогрессировали деструктивные изменения, хрящ истончался, вплоть до полного обнажения субхондральной кости. Способность к регенерации не компенсировала усиленного износа перегруженных суставных поверхностей. В большей части наблюдений деструктивные изменения в суставе сопровождались признаками воспаления – отмечено обильное разрастание синовиального паннуса, что являлось отражением реактивной реакции синовиальной оболочки на травматизацию при функционировании сустава. В субхондральной кости головки бедренной кости на начальных этапах эксперимента выявлен очаговый остеосклероз, к концу эксперимента (180 суток), напротив, наблюдали развитие остеопороза.
Методы хирургического лечения данной патологии достаточно разнообразны. Ацетабулопластика с использованием аутотрансплантата наиболее оправдана с точки зрения репаративного остеогенеза в связи с высокими остеоиндуктивными свойствами аутокости и отсутствием ее антигенных различий с материнской костью [1, 8, 10]. Наряду с тем, уже имеющиеся в диспластичном суставе анатомо-структурные изменения компонентов могут способствовать увеличению травматичности и сложности оперативного вмешательства и тем самым значительно ухудшить результат лечения [7–9].
Нами установлено, что в процессе лечения сохранялось достаточно полноценное хрящевое покрытие вертлужной впадины. Оно было представлено гиалиновым хрящом, в котором выявлены структурно-функциональные изменения реактивного и/или деструктивно-репаративного характера. Однако в суставном хряще головки бедренной кости деструктивные изменения были выражены интенсивнее, чем в вертлужной впадине. Вероятно, это связано с большей подвижностью бедренного компонента сустава. Компенсаторные процессы выражались в повышении пролиферативной активности хондроцитов и формировании их многочисленных изогенных групп. Необходимо отметить, что резорбция трансплантатов у всех животных происходила ангиогенно. Через 90 суток после демонтажа аппарата происходило практически полное замещение трансплантата новообразованной костной тканью. При этом отмечено восстановление анатомической формы свода вертлужной впадины с образованием костной структуры, включающей фрагменты нелизированного трансплантата.
Фиксация сустава аппаратом, с одной стороны, способствовала предохранению неполноценной (деструктивно измененной) суставной поверхности от биомеханической нагрузки, с другой – ухудшению условий питания компонентов сустава. Тем не менее, после снятия аппарата в периферических отделах головки бедренной кости обнаружены участки новообразованного хряща, близкого по своим морфологическим характеристикам к гиалиновому. В субхондральной кости имеют место признаки усиления процесса костеобразования. Выявленные структурные преобразования носят компенсаторный характер в условиях измененной биомеханической нагрузки, испытываемой суставными поверхностями.
В целом, сравнительный анализ результатов гистологического исследования у животных обеих опытных групп показал отсутствие прогрессирования деструктивных изменений структур тазобедренного сустава при оперативном лечении и сохранение полученных результатов с течением времени.
Заключение
Тазобедренный сустав обладает высоким адаптивным потенциалом, что подтверждено быстрым развитием деструктивных изменений его тканей в условиях индуцированного диспластического артроза и формированием репаративных процессов при его лечении. Выявленные изменения при моделировании данной патологии являются следствием нарушения биомеханики тазобедренного сустава, приводящим к нарушению обменных процессов суставного хряща и субхондральной кости. Предложенный метод лечения диспластического поражения тазобедренного сустава с применением аутотрансплантата и наружной аппаратной фиксации обеспечивает получение положительных результатов, сохраняющихся с течением времени. Имеется выраженная тенденция к анатомо-функциональному восстановлению сустава в статико-динамических условиях, создаваемых аппаратом внешней фиксации. Тем не менее, учитывая подавление собственных регенераторных возможностей суставного хряща при диспластическом процессе, его максимально возможное восстановление при лечении невозможно без участия внешних стимуляторов хондрогенеза.
Библиографическая ссылка
Кирсанова А.Ю. МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ СОСТОЯНИЯ СТРУКТУР ТАЗОБЕДРЕННОГО СУСТАВА ПРИ МОДЕЛИРОВАНИИ И ЛЕЧЕНИИ ЕГО ДИСПЛАСТИЧЕСКОГО ПОРАЖЕНИЯ В ЭКСПЕРИМЕНТЕ // Международный журнал прикладных и фундаментальных исследований. 2015. № 12-4. С. 638-644;URL: https://applied-research.ru/ru/article/view?id=7994 (дата обращения: 03.03.2026).

