За прошедшие 10‒15 лет применение высоких технологий позволило получить новые результаты, которые определили особое место иерсиниозов в современном мире. На настоящий момент в исследования по проблеме иерсиниозов вовлечен весь мир – это страны Северной (США, Канада) и Южной (Колумбия, Бразилия) Америки, Великобритания и Ирландия, страны Центральной Европы (Франция, Германия, Бельгия, Испания, Польша, Болгария), Скандинавии (Финляндия, Норвегия, Швеция) и Африки (Мадагаскар), а также Россия, Китай, Южная Корея, Япония, Израиль.
Псевдотуберкулез у человека до середины 1950-х годов встречался как редкое спорадическое заболевание, протекающее в виде острого аппендицита и мезентериального лимфаденита, и был известен лишь в Европейских странах, Северной и Южной Америке, Японии, Индии [21, 26].
Не будет преувеличением сказать, что именно Россия обратила внимание всего мира на проблему эпидемического псевдотуберкулеза, и в целом иерсиниозов, с тех пор как с 1959 года впервые стало известно о вспышках во Владивостоке своеобразной инфекционной болезни, с охватом до нескольких сотен человек, первоначально получившее название дальневосточная скарлатиноподобная лихорадка (ДСЛ) [5]. В период 1960-1990-х годов под руководством академика РАМН Георгия Павловича Сомова в НИИЭМ СО РАМН, при сотрудничестве с военными и практическими врачами, ВГМИ (ныне – ТГМУ), было проведено комплексное изучение этиологии, эпидемиологии, патоморфологии, клиники и иммунологии, лечения и профилактики этой новой болезни. В 1989 году, за проведение этих крупномасштабных исследований, группа специалистов во главе с Г.П. Сомовым была удостоена Государственной премии СССР. А спустя 20 лет было доказано, что клинико-эпидемическое проявление псевдотуберкулеза (ДСЛ) связано с конкретной клональной линией Y. рseudotuberculosis, распространенной в РФ и характеризующейся определенным плазмидным профилем (pVM82, pYV 48 MDa), сиквенстипом (2ST) и аллелем гена yadA (1й аллель) [7].
Повсеместный интерес к проблеме иерсиниозов имеет отражение в регулярно проводимых с 1967 года Международных симпозиумах – International Symposium on Yersinia (Франция, Швеция, Канада, Австралия, Япония, Италия, Нидерланды, Финляндия, США, Бразилия, Китай). Последний 11-й Международный симпозиум в Китае в 2013 году показал, что высокий интерес к иерсиниозам обусловлен тем, что до сих пор в значительной мере не раскрыты побудительные мотивы к эволюции возбудителей внутри рода Yersinia, транс- и межконтинентальной трансмиссии иерсиний, в первую очередь Yersinia pestis, с возникновением эпидемий и пандемий, а также механизмы возможной реверсии и поддержания высокой патогенности нечумных иерсиний.
Прежде всего, важность и значимость углубленного изучения иерсиниозов обусловлены их принадлежностью к эмерджентным инфекциям, одновременно с особо опасной чумной инфекцией. Непредсказуемость и опасность их возникновения требуют перманентного контроля и глубокого всестороннего изучения. Недавно показано [11], что возбудитель чумы, Y. pestis, эволюционировал из возбудителя псевдотуберкулеза, Y. pseudotuberculosis, и оба патогена генетически почти идентичны. Причем, переход Y. pseudotuberculosis в Y. pestis сопровождался утратой многих и приобретением нескольких генов, ассоциированных с патогенностью возбудителей. В этой связи не следует забывать о том, что у Y. pseudotuberculosis сохранилась способность изредка вызывать у человека геморрагическую пневмонию, напоминающую легочную чуму.
Об опасности эмерджентных инфекций свидетельствует история Черной Смерти, вызванной Y. pestis. В средние века чума путешествовала по суше из Азии и прибыла через морскую торговую сеть в Европу (1347 год), уничтожив 30-50 % ее населения. Позднее вспышки чумы продолжали появляться в Европе в течение четырех веков, с последующей реинтродукцией заболевания из Азии в Европу, происходившей без существования локального природного резервуара [37]. Имеются сведения о том, что первые пандемические волны чумы начались в Китае и Центральной Азии еще более 2 600 лет тому назад и с помощью караванов, шедших по Великому шелковому пути, болезнь проникла в Европу, а затем и в Африку. Причем выявлены специфические мутации Y. pestis в зависимости от географического региона.
В начале XXI века вновь началась регистрироваться эмерджентная заболеваемость Yersinia-caused инфекциями. Так, на Мадагаскаре зимой 2011 года описано две вспышки чумной пневмонии с летальностью, достигшей 75 % [33]. Эти вспышки подтвердили высокую контагиозность легочной чумы и необходимость быстрой идентификации первых случаев заболеваний для немедленного применения мер защиты и предупреждения быстрого распространения заболевания.
До 2003 года ареал штаммов Y. enterocolitica высокопатогенного биосеротипа 1В/О:8 ограничивался США и Японией, а начиная с 2004 года, эти штаммы были впервые обнаружены в Польше [34]. В течение 2005–2007 годов были изолированы 15 «американских штаммов», и драматическое увеличение случаев выделения штаммов этого патогена произошло в последующие 5 лет, когда общее число изолятов достигло 191, а до 2012 года число серологически подтвержденных в ELISA случаев иерсиниоза достигло 19.000 пациентов.
Вторым уязвимым место в проблеме иерсиниозов является то, что их возбудители признаны потенциальными агентами биотерроризма. Пристальное внимание исследователей к проблеме иерсиниозов с начала XXI века в большой мере связано с возросшей угрозой биотерроризма во всем мире, а также с потенциальной способностью гетерогенных популяций патогенных иерсиний к реверсии вирулентных свойств, ассоциированной с изменениями на геномном уровне в определенных условиях внешней среды. Эти изменения могут быть причиной полиморфизма клинико-морфологических проявлений иерсиниозов, что требует целенаправленного исследования на основе современных методических подходов. В конечном итоге, углубленное понимание биологии и патологии инфекционных процессов в контексте их связи с молекулярно-генетической характеристикой патогенов создаст новые возможности для борьбе с иерсиниозами в целом.
Биохимические маркеры Yersinia pseudotuberculosis complex (YPC)
|
Виды иерсиний YPC |
Pyrazinamidase1 |
D-melibiose1,4 |
β-galactosidase1,4 |
D-raffinose2 |
D-tagatosa2 |
Уреаза1,2 |
Рамноза1,2 |
Сахароза1,2 |
Эскулин1,2 |
Ксилоза1,2 |
Мальтоза1,2 |
Сорбоза1,2 |
Фукоза3 |
Сорбит3 |
Подвижность3 |
|
Y. pseudotuberculosis |
– |
– |
+ |
– |
– |
+ |
+ |
– |
+ |
+ |
+ |
– |
– |
– |
+ |
|
Y. similis |
+ |
– |
– |
– |
– |
+ |
+ |
– |
+ |
+ |
+ |
– |
– |
– |
+ |
|
Korean group |
– |
+ |
+ |
+ |
+ |
+ |
+ |
– |
+ |
+ |
+ |
– |
– |
– |
– |
Примечаниея. 1) – Sprague et al., 2008; 2) – Laukkanen-Ninios et al., 2011; 3) – Savinа et al., 2014; 4) – Fukushima et al., 2001.
Используя секвенирование целого генома всех видов Yersinia, S. Reuter et al. [35] очертили комплект гена (или дополнение гена) рода в целом и определили закономерности эволюции вирулентности иерсиний. Несколько различных экологических специализаций, вероятно, дают расщепление остро патогенных штаммов Yersinia от непатогенных линий из окружающей среды. Вопреки гипотезе, что все патогенные виды Yersinia имеют общего патогенного предка, показано, что они развивались независимо друг от друга, но с последующими параллельными путями эволюции в приобретении одних и тех же детерминант вирулентности. Эти геномные вариации привели к параллельному появлению родственных возбудителей, где отображается их все более специфический образ жизни, со спектром потенциала вирулентности.
Как известно, род Yersinia содержит три патогенных для человека вида: Y. pestis, возбудитель чумы, Y. pseudotuberculosis, возбудитель псевдотуберкулеза, и Y. enterocolitica, возбудитель кишечного иерсиниоза. Вместе с тем, в 2010-х годах за рубежом сложилось понятие о «Yersinia pseudotuberculosis complex» (YPC).
На основании мультилокусного секвенирования (MLST) в этот комплекс включены три вида [36, 42]: 1) Y. pestis/Y. pseudotuberculosis, 2) Y. similis, который ранее считался непатогенной подгруппой Y. pseudotuberculosis и иначе назывался «Кластер B» [12, 17, 39], и 3) корейская группа, потому что большинство штаммов были изолированы в Корее [25]. Эти три популяции показали высокий уровень фенотипической и генетической однородности штаммов Yersinia pseudotuberculosis комплекса, образующих новые виды Yersinia, которые предлагают обозначить Yersinia wautersii sp. nov. [36]. Изоляция штаммов от людей, обнаружение в них генов вирулентности (плазмиды PYV и pVM82, суперантиген ypmA) и отсутствие активности пиразинамидазы (отличительный признак патогенности рода Yersinia) свидетельствуют о патогенном потенциале Y. wautersii.
Ферментативная активность микроорганизмов является достаточно стабильной, поэтому исследование биохимических свойств Yersinia может служить надежным инструментом для таксономической характеристики новых видов. По ферментативной активности, все виды, входящие в Yersinia pseudotuberculosis complex, проявили высокую биохимическую однородность [36, 39]. Однако были выявлены биохимические маркеры, по которым можно провести дифференциальную диагностику между Y. pseudotuberculosis, Y. similis и Korean group по активности ферментов пиразинамидаза, D-мелибиоза, β-галактозидаза, D-раффиноза, D-таггатоза (таблица). При этом активность указанных видов Yersinia по основным ферментам, входящим в дифференциально-диагностический спектр оказалась полностью идентичной. Таким образом, все исследованные виды иерсиний, входящих в Yersinia pseudotuberculosis complex, по биохимическим маркерам представляются в качестве трех отдельных видов.
Нестабильность фенотипических свойств затрудняет интерпретацию получаемых результатов по дифференциации микроорганизмов. Это вызывает необходимость разработки приемов молекулярной диагностики, основанной на анализе структуры генома, отличающегося большей консервативностью по сравнению с фенотипическими свойствами. С. Savina et al. [36}, на основании секвенирования и анализа единичных вариабельных нуклеотидов 417 изолятов из 29 стран, показали генетическое сходство и разнообразие видов, входящих в Yersinia pseudotuberculosis complex (рисунок). Установлено, что все секвенированные штаммы Y. pseudotuberculosis, Y. similis и Korean group представляют собой три однородных кластера с минимальной вариабельностью нуклеотидов (0,04–1,4 %), что подтверждает обособленность этих видов иерсиний. В то же время эти виды оказались генетически близкими друг другу: количество вариабельных нуклеотидов варьировало от 0,8–1,8 % (пара Y. pseudotuberculosis и Korean group) до 4,2–4,5 % (пара similis и Korean group).
Весьма важный аспект проблемы иерсиниозов касается нового фактора патогенности, идентифицированного у штаммов Y. pseudotuberculosis I серотипа, ответственного за уникальный клинический синдром, описанный на Дальнем Востоке как скарлатиноподобная лихорадка (Far East scarlet-like fever, FESLF) [27]. Это ранее неизвестный белок вирулентности Y. pseudotuberculosis (TcpYI), который имеет значительную гомологию последовательности с членами семейства Toll / IL-1 рецептора (TIR). Бактериальный TIR домен содержит белки (Tcps), действующие на иммунную систему по TIR-TIR взаимодействиям, и подрывает защитные реакции организма с помощью многогранных механизмов. Белок TcpYI увеличивает внутриклеточное выживание штаммов in vitro и в селезенки мышей на модели перитонита, участвует в торможении фагоцитоза, даже штаммов Y. pseudotuberculosis группы FESLF, где плазмида вирулентности pYV отсутствует. Таким образом, подтверждена гипотеза, что белок TcpYI самостоятельно способствует патогенности Yersinia и играет решающую роль в качестве потенциального фактора вирулентности Y. pseudotuberculosis, который особенно связан с штаммами дальневосточной скарлатиноподобной лихорадки I серотипа, имеющими измененный ген кластера вирулентности [16, 32].
В настоящее время возбудитель псевдотуберкулеза привлекает внимание исследователей всего мира в качестве модели для раскрытия молекулярных механизмов взаимодействия патогенных Yersiniae в системе микроорганизм-хозяин, где первостепенное значение придается клеткам врожденного иммунитета. Патогенные для человека виды Yersinia преимущественно инактивируют клетки врожденного иммунитета, что является важным шагом, с помощью которого эти бактерии избегают элиминации и вызывают заболевание [41]. Установлено, что в ответ на заражение иерсиниями, фундаментальную роль в первичной иммунной защите играют нейтрофилы, которые используют несколько механизмов для ликвидации бактерий, таких как фагоцитоз, оксидативный стресс и дегрануляция, а также образование нейтрофильных внеклеточных ловушек (NET) – особого типа повреждения клеток, наряду в некрозом и апоптозом, а также пироптозом.
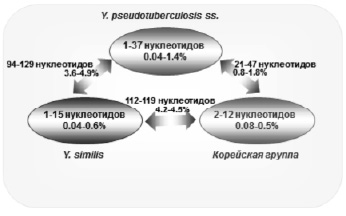
Кластеры генетического разнообразия Yersinia pseudotuberculosis complex (пояснение в тексте)
Эффероцитоз – это новый молекулярно-клеточный механизм взаимодействия Yersinia с клетками иммунной системы хозяина. Несмотря на то, что геном Y. pestis кодирует набор антифагоцитарных факторов вирулентности, был отмечен фагоцитоз Y. pestis с помощью полиморфноядерных лейкоцитов (ПМЯЛ) и макрофагов. Макрофаги являются известным пермиссивным резервуаром хозяина для репликации Y. pestis, но судьба Y. pestis, фагоцитированных ПМЯЛ, недостаточно известна. J.L. Spinner et al. [38] рассматривают гипотезу о том, что Y. pestis, выращенные при 22 °С, могут реплицироваться внутри нейтрофилов и утилизироваться ими в качестве пути, через который далее происходит заражение макрофагов. Инфицированные Y. pestis нейтрофилы представляют на их поверхности фосфатидил1 серин (PS), который распознается макрофагами и другими компетентными клетками, что приводит к поглощению и клиренсу PS+ нейтрофилов, именуемому как efferocytosis. Инфекция макрофагов путем эффероцитоза считается немым маршрутом для патогенов, чтобы войти в эти клетки-хозяина и, таким образом, была названа моделью «Троянского коня». Поглощение PS+ нейтрофилов подавляет активацию антимикробных эффекторных функций макрофагов. Аутологичные человеческие макрофаги распознают и утилизируют нейтрофилы, содержащие Y. pestis. Поэтому сделано заключение, что нейтрофилы могут играть особую роль в патогенности Y. pestis.
Многочисленные исследования, проведенные в конце ХХ в., коренным образом изменили представление о факторах патогенности бактерий рода Yersinia. Иерсинии имеют способность преодолевать механизмы врожденного иммунитета, обладая большим набором факторов патогенности, часть из которых кодируется хромосомными генами, а часть – генами плазмид (внехромосомных генетических элементов) [5, 9, 18, 31].
Детально охарактеризованы факторы патогенности, детерминированные хромосомными генами [8]. Это: 1) инвазин, м.м. 103 кДа (обеспечивает температура-зависимое проникновение в клетки хозяина); 2) белок Ail 17 кДа (действует как вторичный фактор адгезии и инвазии уже после адаптации клеток бактерий к температуре тела хозяина); 3) антиген рН6 (экспрессируется максимально при температуре 37 °С и низком значении рН; белок 21 кДа – экспрессирует образование фимбрий).
Доказано, что вирулентность бактерий рода Yersinia ассоциируется с наличием плазмиды pYV молекулярной массой 42–48 МDa. Плазмида pYV кодирует комплекс белков, объединенных в единую систему и предназначенных для нейтрализации иммунокомпетентных клеток хозяина [10, 28]. Она состоит из эффекторых белков (Yops) и системы секреции III типа (T3SS), позволяющей бактериям вводить синтезируемые ими эффекторные белки в цитоплазму клетки-мишени без проникновения в нее. T3SS является общей для всех патогенных Yersiniae и играет существенную роль в возникновении инфекции [13, 20].
На настоящий момент особый интерес представляет плазмида Y. pseudotuberculosis с мол. массой 82 MDa (рVM82), которая обнаруживается только у штаммов Y. pseudotuberculosis I серовара – наиболее частого этиологического агента ДСЛ [19]. Способность Y. pseudotuberculosis вызывать эпидемические вспышки инфекции у людей связывают с одновременным наличием у микроба плазмид pYV и pVM82 [5]. Сообщается о способности штаммов Y. pseudotuberculosis, несущих плазмиду pVM 82, оказывать иммуносупрессивное действие и индуцировать апоптоз [2, 3, 4, 27]. Однако до сих пор остается недостаточно выяснен спектр эффектов плазмиды pVM 82 в проявлениях вирулентности Y. pseudotuberculosis и особенностях инфекционного процесса. В этой связи, в модельных экспериментах первостепенное значение имеет использование штаммов Y. pseudotuberculosis, выделенных от больных ДСЛ, уникальность которых признается исследователями всего мира.
Нами [2, 6, 30] установлены различия реакции клеток врожденного иммунитета при инфицировании разными плазмидными вариантами Y. pseudotuberculosis. Так, более выраженное апоптоз-индуцирующее действие вызывает слабовирулентный pVM82 вариант, по сравнению с высоковирулентным pYV48:pVM82 вариантом, который преимущественно вызывает некроз фагоцитов.
Актуальной проблемой микробиологии является поиск новых, более быстрых и точных методов идентификации штаммов возбудителей инфекций. Большой прорыв в идентификации микроорганизмов позволил осуществить принципиально новый метод – матрично-ассоциированная лазерная десорбция/ионизация (МАЛДИ) в комплексе с времяпролетной масс-спектрометрией (МALDI-ToF) [15, 23]. Этот метод дает возможность проводить анализ сложных биоорганических молекул, получать молекулярные профили нуклеиновых кислот и белков. В дальнейшем, полученные белковые профили анализируются, определяются родо- и видоспецифические протеиновые биомаркеры, которые используются для таксономической характеристики возбудителей и диагностики инфекций. Недавно проведенный углубленный протеомный анализ бактерий рода Yersinia [22] продемонстрировал наличие родоспецифических и видоспецифических биомаркеров. В 2014 году опубликованы результаты успешной апробации метода в Иркутском НИПЧИ с целью кластеризации возбудителей иерсиниозов [1].
Важное значение имеет профилактика иерсиниозов, в первую очередь, особо опасной чумной инфекции. Привлекают внимание исследования последних лет, касающиеся разработки современных эффективных вакцин против чумы на основе модифицированных штаммом Y. pseudotuberculosis. Живая чумная вакцина (live pestis vaccine, LPV) Y. pestis EV NIEG широко используется для профилактики у человека более 70 лет. Однако антительный ответ к этой вакцине был изучен главным образом к капсулярному антигену F1 и LPS.
Французскими учеными [14] выбрана вакцинная стратегия, основанная на живом, аттенуированном штамме Y. pseudotuberculosis, генетически почти идентичном виде Y. pestis, но менее патогенном и генетически более стабильном. Сконструирован штамм, названный V674TnF1, который является сильно аттенуированным ((LD50 ≥ 1010 CFU, оральный путь) и обеспечивает 100 % защиту против бубонной чумы после однократного подкожного введения 107 CFU V674pF1, даже когда была использована высокая доза заражения Y. pestis (105 CFU = 104 x LD50).
W. Sun et al. [40] получили аттенуированный штамм Y. pseudotuberculosis, синтезирующий гибридные белки, состоящие из YopE, сшитых с LcrV (V-антиген, супрессирующий воспалительный ответ в ранней стадии инфекции) или LcrV221 и доставляемые через систему секреции III типа (T3SS). Эти белки могут быть транслоцированы в цитоплазму культуральных клеток HeLa. Мыши, орально иммунизированные аттенуированным штаммом Y. pseudotuberculosis, синтезирующим YopE – LcrV, продуцировали высокий уровень секреторного IgA и также были значительно защищены к интраназальному заражению примерно 104 CFU вирулентной Y. pestis (примерно 100 LD50).
Резюмируя вышесказанное, можно заключить, что на настоящий момент по проблеме иерсиниозов перспективными для российских ученых следует считать:
1. Поиск и изучение новых факторов патогенности, детерминируемых плазмидой pVM82 у дальневосточных штаммов Yersinia pseudotuberculosis I серотипа, что будет способствовать углубленному пониманию сложности и многообразия взаимодействия этого патогена и макроорганизма, а также идентификации ранее неизвестных механизмов развития эпидемического псевдотуберкулеза.
2. Cравнительная характеристика инфекционных процессов, вызываемых разными плазмидными вариантами Yersinia pseudotuberculosis, в контексте раскрытия закономерностей защитных механизмов системы врожденного иммунитета и иммунопатологии эпидемического псевдотуберкулеза.
Библиографическая ссылка
Сомова Л.М., Андрюков Б.Г., Плехова Н.Г., Плехова Н.Г. ПРОБЛЕМА ИЕРСИНИОЗОВ В СОВРЕМЕННОМ МИРЕ // Международный журнал прикладных и фундаментальных исследований. 2015. № 12-4. С. 661-667;URL: https://applied-research.ru/ru/article/view?id=7999 (дата обращения: 16.02.2026).

