В генной инженерии широко используется прием слияния различных белков в виде химерных полипептидов с последующим их расщеплением. Для расщепления химеров используются специфичные и недорогие ферменты. Одним из таких ферментов является каталитический домен белка ядерного включения (nuclear inclusion protein) вируса табачной мозаики. Фермент имеет молекулярную массу около 29 кДа и может быть получен в клетках E. coli [2, 3]. Однако белок при сверхэкспрессии, как и многие гетерологичные белки для E. coli, имеет тенденцию накапливаться в виде телец включения, что затрудняет его последующее извлечение из клеток в нативных условиях с сохранением каталитической активности [4]. В связи с этим, в литературе появились работы, использующие различные приемы для увеличения растворимости фермента в цитоплазме, в частности, имеется публикация, в которой авторы попытались внести мутации в структуру фермента с целью увеличения его накопления в цитоплазме [7]. Авторы смогли увеличить выход фермента в 5 раз, по сравнению с аналогичной системой, где использовался дикий тип гена. Так же известны работы, в которых фермент получали в виде слитого полипептида с мальтозо-связывающим белком (MBP) [3, 6]. Полипептид в клетке накапливался в цитоплазме и был способен к саморасщеплению и высвобождению TEV-протеазы. Следует так же отметить, что в этих работах использовался ген протеазы «дикого» типа. Мы предположили, что объединив эти две стратегии и оптимизировав структуру гена для экспрессии в клетках E. coli можно добиться существенного повышения уровня синтеза фермента в клетках. Таким образом, целью нашего исследования являлось конструирование продуцента на основе клеток E. coli с высоким выходом TEV-протеазы в растворимой форме.
Материалы и методы исследования
Получение рекомбинантной ДНК, кодирующей химерный полипептид MBP-TEV-протеаза. При конструировании модели рекомбинантной ДНК за основу была взята известная структура гена (giM15239.1(TEVGEN:6256-6981) в базе данных National Centerfor Biotechnology Information, http://www.ncbi.nlm.nih.gov/nuccore/335201). Анализ частоты встречаемости редких кодонов в геноме E. coli проводили с помощью программы интернет-ресурса «Классической и молекулярной биологии» (http://molbiol.ru/scripts/01_11.html). Рекомбинантная ДНК размером 792 п.н. была синтезирована из нуклеотидов по принципу «de novo» фирмой «DNA 2.0» (США) и была встроена в состав экспрессирующего вектора pD441-mbp. В результате в плазмиде под контролем промотора T5 в одной рамке считывания находилась рекомбинантная ДНК, размером 1890 п.н., кодирующая химерный полипептид MBP-TEV-протеаза (625 а.о., примерная молекулярная масса – 70 кДа).
Трансформация клеток E. coli. Трансформацию клеток полученной плазмидой проводили с помощью электропорации согласно методике фирмы – производителя прибора («PeqLab, BiotechnologieGmbH», Германия). Клоны E. coli, содержащие плазмиду, отбирали на селективной агаризованной среде LB (lysogeny broth), содержащей канамицин 30 мкг/мл.
Экспрессия химерного полипептида MBP-TEV-протеазы, наработка биомассы клеток продуцентов. Для экспрессии полипептида использовали клетки E. coli шт. BL21(DE3). Из отобранного клона E. coli выращивали ночную культуру в среде LB объемом 5 мл при 37 °С. На следующий день ночную культуру переносили в двухлитровую колбу с 500 мл свежей среды LB, содержащей канамицин 30 мкг/мл. Клетки выращивали при активном перемешивании и 37 °С до оптической плотности D600 = 0,8-1,2 о.е. Для анализа отбирали пробу (контроль) и добавляли индуктор – изопропил-β-D-1-тиогалактопиранозид (ИПТГ) до конечной концентрации в среде 0,5 мМ. Далее клетки инкубировали 4 ч при аналогичных условиях, либо при 300С. По окончании инкубации отбирали пробу для анализа (опытный образец). Клетки осаждали центрифугированием при 3000 об/мин в течение 20 мин, осадок использовали для выделения фермента. Клеточные лизаты и белки анализировали в 12 % полиакриламидном геле (ПААГ) по Лэммли, белки окрашивали красителем «Кумасси бриллиантовый синий R-250».
Выделение TEV-протеазы. Клетки E. coli в фосфатно-солевом буфере разрушали обработкой ультразвуком (УЗГ 13-0,1/22, ФГУП «ВНИИТВЧ», Россия). Клеточный лизат отделяли от дебриса центрифугированием 20 мин при 15000 об/мин. Дебрис экстрагировали 20 мин 8М мочевиной, осаждали 10 мин 10000 об/мин, супернатант использовали для анализа в ПААГ. Выделение и очистку фермента из лизата клеток осуществляли с помощью аффинной хроматографии на колонке с Ni-NTA-сефарозой CL-6B в нативных условиях, согласно протоколу фирмы-производителя аффинного сорбента «Quiagen» («Quiagen», Германия). Целевой белок элюировали фосфатно-солевым буфером, содержащим 250 мМ имидазола, 2 мМ этилендиаминтетрауксусной кислоты ЭДТА) и 2 мМ дитиотреитола (ДТТ), рН 7,5. От имидазола фермент очищали с помощью диализа в фосфатно-солевом буфере, содержащем 2 мМ ЭДТА и 2 мМ ДТТ. Концентрацию белка измеряли спектрофотометрически при λ = 280 нм. К ферменту добавляли равный объем 100 % глицерина, раствор перемешивали и хранили при – 20 °С.
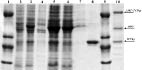
Рис. 1. Фрагмент электрофореграммы белковых образцов на различных стадиях получения TEV-протеазы
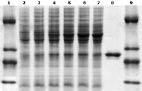
Рис. 2. Фрагмент электрофореграммы лизатов клеток-продуцентов TEV-протеазы, инкубированных с индуктором различное время
Результаты исследования и их обсуждение
С целью оптимизации кодонов для экспрессии в клетках E. coli в структуру гена TEV-протеазы был внесен ряд замен – 34 синонимические замены кодонов, были заменены все кодоны с частотой встречаемости менее 10 кодонов на 1000. Кроме того, были сделаны четыре замены аминокислот согласно работам [2] и [7], а именно: S219V, T17S, N68D и I77V. Замена S219V уменьшает неспецифическую автокаталическую активность примерно в 100 раз по сравнению с диким типом фермента, тем самым фермент остается более стабильным [2]. Замены T17S, N68D и I77V приводят к большей цитоплазматической растворимости фермента, при сохранении его каталитической активности [7]. Для саморасщепления полипептида MBP-TEV-протеаза и последующей очистки фермента с помощью аффинной хроматографии с 5’-конца гена TEV-протеазы был добавлен фрагмент ДНК, кодирующий сайт эндонуклеазы рестрикции KpnI, глицин, сайт TEV-протеазы (ENLYFQ/G), 6 а.о. гистидина и глицин:
5’-GGTACCGGCGAAAACCTGTATTTTCAGGGCCACCATCATCATCATCATGGC-3’.
С 3’-конца гена был добавлен фрагмент ДНК, кодирующий стоп-кодон и сайт эндонуклеазы рестрикции XhoI:
5’-TAACTAAGCTAACTCGAG-3’.
В результате экспрессии гена химерного полипептида в составе экспрессирующего вектора в клетках E. coli шт. BL21(DE3) был получен рекомбинантный белок с молекулярной массой ~ 29 кДа (рис. 1, дор. 3). Выход TEV-протеазы из биомассы, полученной индукцией клеток в течение 4 ч при 300С и концентрации индуктора 0,5 мМ, составлял ~ 50 мг с литра культуры клеток (рис. 1, дор. 8). Следует отметить, что анализ экстракта осадка (дебриса) 8М мочевиной, после стадии разрушения клеток ультразвуком, не обнаружил фермента (рис. 1, дор. 4), фермент практически весь оставался в клеточном лизате (рис. 1, дор. 5). Это свидетельствует о том, что фермент являлся растворимым в цитоплазме и/или периплазме и не накапливался в тельцах включения.
Дорожки: 1, 9 – маркерные белки (бычий сывороточный альбумин 66 кДа, рекомбинантный апоА-I 33,5 кДа [1], нативный апоА-I 27 кДа [1], лизоцим 14,5 кДа); 2 – лизат клеток инкубированных без добавления индуктора (контроль); 3 – лизат клеток инкубированных с индуктором 0,5 мМ (биомасса для выделения белка); 4 – фракция клеточного дебриса после разрушения ультразвуком; 5 – фракция супернатанта после разрушения ультразвуком; 6 – фракция после прохождения колонки со смолой; 7 – промывочная фракция; 8 – очищенный ферментTEV-протеаза (~ 29 кДа), фракция, элюированная 250 мМ имидазолом; 10 – фракция, элюированная 250 мМ имидазолом, при выделении фермента из клеток, инкубированных при 20 °С.
Изучение зависимости уровня синтеза фермента от времени инкубации клеток (температура 30 °С) показало, что максимальный уровень экспрессии наблюдается уже через 4 ч (рис. 2, дор. 6), дальнейшая инкубация не приводила к увеличению количества продукта.
Полученные результаты (50 мг/л) в целом совпадают с данными работы [7] для мутанта А26 (54 мг/л), содержащего три аминокислотные замены: T17S, N68D и I77V. Мы предполагали, что наши результаты будут более высокими в сравнении с данными [7], вероятно, отличия объясняются различными экспрессирующими системами, поэтому сравнение результатов является не совсем корректным. Так в работе [7] использовался вектор с промотором Т7, в нашем случае – Т5, а в качестве хозяйского штамма авторы использовали клетки Rosseta(DE3)pLysS, которые синтезируют редкие для E. coli транспортные РНК. Кроме того, авторы в своей работе [7] инкубировали клетки в течение ночи при 20 °С, в нашем же случае инкубация выполнялась 4 часа при 30 °С. Таким образом, достоинством нашей системы можно считать, что аналогичный выход продукта достигался за сравнительно меньший промежуток времени.
Дорожки: 1, 9 – маркерные белки (бычий сывороточный альбумин 66 кДа, рекомбинантный апоА-I 33,5 кДа [1], нативный апоА-I 27 кДа [1], лизоцим 14,5 кДа); 2-7 – лизаты клеток инкубированных с добавлением индуктора в течение 15, 30, 60 мин, 2, 4 и 6 ч соответственно; 8 – очищенный фермент TEV-протеаза.
Мы попытались воспроизвести условия инкубации клеток аналогично работе [7] – снизили температуру инкубации до 20 °С, инкубацию проводили в течение ночи (~ 20 часов). Однако в результате такого эксперимента, после выделения фермента, в препарате присутствовал полноразмерный полипептид MBP-TEV-протеаза (рис. 1, дор. 10), судя по электрофореграме, примерно половина полипептида оставалось нерасщепленным. Вероятно, это связано с тем, что оптимальная температура для проявления ферментативной активности TEV-протеазы составляет 34 °С [5] и при понижении до 20 °С активность фермента существенно падает, настолько, что в этих условиях полипептид не успевает полностью проводить реакцию саморасщепления. Таким образом, оптимальными условиями для получения фермента в полученных клетках-продуцентах при концентрации индуктора 0,5 мМ являлись: температура инкубации – 30 °С, время инкубации – 4 ч.
Заключение
В результате выполненной работы на основе клеток E. coli шт. BL21(DE3) был получен продуцент рекомбинантного фермента – протеазы вируса табачной мозаики, с выходом белка ~ 50 мг/л. Данный результат был достигнут за счет оптимизации кодонов гена TEV-протеазы для экспрессии в клетках E. coli, слиянием фермента с мальтозо-связывающим белком, и заменой четырех аминокислот (S219V, T17S, N68D и I77V). Оптимальными условиями культивирования клеток-продуцентов были найдены следующие: выращивание клеток до логарифмической фазы роста, добавление индуктора до 0,5 мМ и последующая инкубация клеток 4 ч при 30 °С.
Библиографическая ссылка
Рябченко А.В., Котова М.В., Поляков Л.М. ПОЛУЧЕНИЕ ПРОДУЦЕНТА ПРОТЕАЗЫ ВИРУСА ТАБАЧНОЙ МОЗАИКИ // Международный журнал прикладных и фундаментальных исследований. 2015. № 12-5. С. 859-862;URL: https://applied-research.ru/ru/article/view?id=8040 (дата обращения: 07.03.2026).

