Наиболее важным моментом при постановке ПЦР, от которого во многом зависит качество анализа, является первый этап, который включает в себя процесс выделения ДНК из образцов крови животных и определение чистоты выделенной ДНК. Для выделения ДНК используют различные методики в зависимости от поставленных задач. Их суть заключается в экстракции (извлечении) ДНК из биопрепарата и удалении или нейтрализации посторонних примесей для получения препарата чистотой, пригодной для постановки ПЦР ДНК.
Изучение генетической устойчивости крупного рогатого скота к вирусу лейкоза КРС (ВЛКРС) основано на определении генетического полиморфизма гена BoLA-DRB3 и выявлении аллелей, ассоциированных с устойчивостью или чувствительностью к ВЛКРС и ответственных за формирование иммунной реакции к вирусу, при помощи ПЦР-ПДРФ анализа [1, 2, 3]. Наиболее важным моментом при постановке ПЦР, от которого во многом зависит качество анализа, является первый этап, который включает в себя процесс выделения ДНК из образцов крови животных и определение чистоты выделенной ДНК.
Целью исследования является отработка оптимального способа выделения ДНК из крови животных.
Материалы и методы исследования
В работе были исследованы 10 образцов крови коров черно-пестрой и 10 образцов алатауской породы. Выделение ДНК проводили согласно инструкции прилагаемой к наборам реагентов. Электрофорез выделенной ДНК проводили при силе тока 50-100 мА, напряжении электрического поля 140 В, длительность разделения фрагментов ДНК – 30 минут. Для визуализации фрагментов ДНК в агарозный гель добавляют бромистый этидий.
Результаты исследования и их обсуждение
Одни из способов выделения ДНК основаны на лизисе (разрушении) клеток путём добавления лизирующего раствора, сорбции ДНК на носителе (диатомовая земля, сорбенты на основе кремния, магнитный сорбент), многократной отмывке и ресорбции ДНК в элюирующий раствор. Эти методы удобны, однако, вследствие необратимой сорбции на носителе и многократных отмывок возможны потери ДНК. Это имеет большое значение при незначительном количестве ДНК в исследуемой пробе. Кроме того, даже следовые количества компонентов лизирующего раствора могут ингибировать ПЦР. Другие методы выделения ДНК основаны на использовании ионообменников, которые сорбируют не ДНК, а примеси, ингибирующие реакцию. Эти методы включают две стадии: кипячение исследуемой пробы и сорбцию примесей на ионообменнике. При массовом обследовании для получения статистических данных используют простые методы выделения с использованием детергентов или обработки исследуемого материала щелочами с последующей их нейтрализацией. Однако эти методы из-за использования в реакционной смеси некачественного препарата ДНК могут приводить к ложноотрицательным результатам.
Таким образом, к выбору метода пробоподготовки следует относиться с пониманием целей проведения предполагаемых анализов. Поэтому перед нами стояла задача выбора оптимального способа экстракции ДНК из образцов крови по чистоте и концентрации.
Для выделения ДНК отобраны образцы крови коров черно-пестрой породы (10 голов) и алатауской породы (10 голов). При выделении реагентом Prepman Ultra, полученные образцы были недостаточно чистыми. При выделении с использованием набора реагентов ДНК-сорб концентрация ДНК была низкой, что недостаточно для проведения амплификации со специфическими праймерами. При использовании метода, основанного на сорбции ДНК на тонкодисперсной двуокиси кремния (SiO2), образцы оказались достаточно чистыми для проведения дальнейших исследований методом ПЦР.
При выделении ДНК из крови животных с помощью метода, основанного на сорбции ДНК на тонкодисперсной двуокиси кремния, в пробирки Эппeндорфа на 1,5мл вносят 150 мкл крови. Затем добавляют 600 мкл лизирующего буфера (5 М гуанидинтиоционат, 20 мМ ЭДТА, 100 мМ ТРИС, рН 6,4, 1 % тритон Х -100), вносят 50 мкл суспензии «Cилика» фирмы Хеликон и интенсивно перемешивают содержимое пробирок на Vortex. Далее пробирки инкубируют в течение 5 мин при 65оС, периодически перемешивая содержимое пробирок на Vortex. Полученную смесь центрифугируют 30 секунд при 5000 об/мин. Супернатант удаляют, не задевая осадок. К осадку добавляют 500 мкл лизирующего буфера, содержимое перемешивают на Vortex, центрифугируют 30 секунд при 5000 об/мин, удаляют супернатант, к осадку добавляют 700 мкл солевого буфера [10 мл 10х солевого буфера (1 М NaCl, 1 М KCl) + 90 мл дистиллированной воды + 300 мл этанола]. Содержимое пробирок перемешивают на Vortex, центрифугируют смесь 30 секунд при 5000 об/мин. Затем повторяют добавление солевого буфера, перемешивание и центрифугирование при 10000 об/мин в течение 30 сек. Супернатант удаляют и высушивают осадок при 65оС – 5-7 мин. Добавляют 100 мкл деионизованной Н2О и инкубируют 5-7 мин при 65оС. Перемешивают пробирки каждые 1-2 минуты во время инкубации. Затем пробирки центрифугируют при максимальных оборотах (14000 об/мин) 10 минут и супернатант, содержащий ДНК, переносят в пробирки Эппендорфа.
Таким образом, используя 3 разных метода, была получена ДНК из образцов крови животных. Из приведенных выше способов выделения ДНК (способа экстракции ДНК из образцов крови животных: с применением набора реагентов «ДНК сорб», экстракции ДНК с реагентом Prepman Ultra и выделение ДНК с помощью метода, основанного на сорбции ДНК на тонкодисперсной двуокиси кремния). Наиболее оптимальным методом для выделения ДНК из крови оказался третий метод основанный на сорбции ДНК на тонкодисперсной двуокиси кремния.
Далее качество выделенных препаратов ДНК проверяли с помощью электрофореза в агарозном геле. Электрофорез ДНК проводится на этапах выделения ДНК, амплификации и рестрикции ДНК. Для приготовления 1 % агарозного геля необходимы следующие компоненты: агароза и 5хТВЕ буфер. Состав 5хТВЕ буфера: 54 г Трис-ОН, 27,5 г борной кислоты, 20 мл 0,5 М ЭДТА, рН 8,0.
Для приготовления агарозного геля 1 г порошка агарозы вносят в стакан со 100 мл Трис-боратного буфера (1 х ТВЕ) (для этого к 20 мл 5хТВЕ буфера добавляем 80 мл Н2О). Полученную взвесь нагревают в микроволновой печи до полного расплавления агарозы. Затем раствор остужают до 50 оС и добавляют 5 мкл бромистого этидия (из водного раствора, содержащего 10 мг/мл и хранящегося при 40 оС в светонепроницаемом сосуде) до конечной концентрации 0,5 мкг/мл. Бромистый этидий используется для обнаружения ДНК. Агарозу заливают в подложку камеры для горизонтального электрофореза и устанавливают гребёнку для образования ячеек. Необходимо, чтобы между дном ячейки и основанием геля оставался слой агарозы толщиной 0,5–1,0 мм, т.е., чтобы дном ячейки служил агарозный гель. После того как гель полностью затвердеет (через 30–45 минут при комнатной температуре), осторожно удаляют гребёнку. Помещают подложку в камеру, добавляют буфер для электрофореза, гель должен быть закрыт слоем буфера толщиной 2-3 мм. Для внесения образцов ДНК в ячейки геля используют буфер нанесения, содержащий 0,01 % бромфеноловый синий, 0,25 М ЭДТА, 50 % глицерина. Буфер нанесения смешивают с пробой в соотношении 1:1, а затем вносят в ячейку с помощью пипетки-дозатора. Электрофорез проводят при напряжении 140 В, 30 минут. После электрофореза помещают гель в камеру прибора для фиксации анализа изображений «Биорад» и обрабатывают электрофореграмму. Для электрофоретического анализа используется 2 мкл ДНК (рисунок).
Как видно на рисунке, качество полученных препаратов выделенной ДНК удовлетворительное. Далее выделенная и очищенная ДНК используется для проведения ПЦР-ПДРФ анализа аллельного полиморфизма гена BoLA-DRB3.
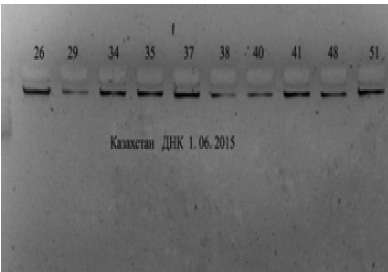
Электрофореграмма выделенной и очищенной ДНК из 10 образцов крови коров черно-пестрой породы (образцы 26-51)
Заключение
Таким образом, количество и качество полученной ДНК характеризует метод выделения ДНК, основанный на применении двуокиси кремния SiO2, как наиболее приемлемый. ДНК не деградирована и её количество достаточно для проведения дальнейших молекулярно-генетических исследований.
Библиографическая ссылка
Латыпова З.А., Сарбаканова Ш.Т., Аубекерова Л.С., Касымова К.Т. ОТРАБОТКА ОПТИМАЛЬНОГО СПОСОБА ВЫДЕЛЕНИЯ ДНК ИЗ КРОВИ ЖИВОТНЫХ ДЛЯ ПРОВЕДЕНИЯ ПЦР-ПДРФ АНАЛИЗА АЛЛЕЛЬНОГО ПОЛИМОРФИЗМА ГЕНА BOLA-DRB3 // Международный журнал прикладных и фундаментальных исследований. 2016. № 1-4. С. 555-557;URL: https://applied-research.ru/ru/article/view?id=8602 (дата обращения: 09.02.2026).

