Ферменты, органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и называются катализаторами. Ферменты (от лат. fermentum – брожение, закваска) иногда называют энзимами (от греч. en – внутри, zyme – закваска). Все живые клетки содержат очень большой набор ферментов, от каталитической активности которых зависит функционирование клеток. Практически каждая из множества разнообразных реакций, протекающих в клетке, требует участия специфического фермента. Изучением химических свойств ферментов и катализируемых ими реакций занимается особая, очень важная область биохимии – энзимология. Многие ферменты находятся в клетке в свободном состоянии, будучи просто растворены в цитоплазме; другие связаны со сложными высокоорганизованными структурами. Есть и ферменты, в норме находящиеся вне клетки; так, ферменты, катализирующие расщепление крахмала и белков, секретируются поджелудочной железой в кишечник. Секретируют ферменты и многие микроорганизмы. Первые данные о ферментах были получены при изучении процессов брожения и пищеварения. Большой вклад в исследование брожения внес Л.Пастер, однако он полагал, что соответствующие реакции могут осуществлять только живые клетки. В начале 20 в. Э. Бухнер показал, что сбраживание сахарозы с образованием диоксида углерода и этилового спирта может катализироваться бесклеточным дрожжевым экстрактом. Это важное открытие послужило стимулом к выделению и изучению клеточных ферментов. В 1926 Дж. Самнер из Корнеллского университета (США) выделил уреазу; это был первый фермент, полученный в практически чистом виде. С тех пор обнаружено и выделено более 700 ферментов, но в живых организмах их существует гораздо больше. Идентификация, выделение и изучение свойств отдельных ферментов занимают центральное место в современной энзимологии. Ферменты, участвующие в фундаментальных процессах превращения энергии, таких, как расщепление сахаров, образование и гидролиз высокоэнергетического соединения аденозинтрифосфата (АТФ), присутствуют в клетках всех типов – животных, растительных, бактериальных. Однако есть ферменты, которые образуются только в тканях определенных организмов. Так, ферменты, участвующие в синтезе целлюлозы, обнаруживаются в растительных, но не в животных клетках. Таким образом, важно различать «универсальные» ферменты и ферменты, специфичные для тех или иных типов клеток. Вообще говоря, чем более клетка специализирована, тем больше вероятность, что она будет синтезировать набор ферментов, необходимый для выполнения конкретной клеточной функции. Все ферменты являются белками, простыми или сложными (т.е. содержащими наряду с белковым компонентом небелковую часть). Ферменты – крупные молекулы, их молекулярные массы лежат в диапазоне от 10 000 до более 1 000 000 дальтон (Да). Для сравнения укажем мол. массы известных веществ: глюкоза – 180, диоксид углерода – 44, аминокислоты – от 75 до 204 Да. Ферменты, катализирующие одинаковые химические реакции, но выделенные из клеток разных типов, различаются по свойствам и составу, однако обычно обладают определенным сходством структуры. Структурные особенности ферментов, необходимые для их функционирования, легко утрачиваются. Так, при нагревании происходит перестройка белковой цепи, сопровождающаяся потерей каталитической активности. Важны также щелочные или кислотные свойства раствора. Большинство ферментов лучше всего «работают» в растворах, pH которых близок к 7, когда концентрация ионов H+ и OH- примерно одинакова. Связано это с тем, что структура белковых молекул, а следовательно, и активность ферментов сильно зависят от концентрации ионов водорода в среде.
Не все белки, присутствующие в живых организмах, являются ферментами. Так, иную функцию выполняют структурные белки, многие специфические белки крови, белковые гормоны и т.д. Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами). Роль коферментов играют большинство витаминов и многие минеральные вещества; именно поэтому они должны поступать в организм с пищей. Витамины РР (никотиновая кислота, или ниацин) и рибофлавин, например, входят в состав коферментов, необходимых для функционирования дегидрогеназ. Цинк – кофермент карбоангидразы, фермента, катализирующего высвобождение из крови диоксида углерода, который удаляется из организма вместе с выдыхаемым воздухом. Железо и медь служат компонентами дыхательного фермента цитохромоксидазы. Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента. Этот процесс представляют следующим образом:
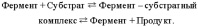
Продукт тоже можно считать субстратом, поскольку все ферментативные реакции в той или иной степени обратимы. Правда, обычно равновесие сдвинуто в сторону образования продукта, и обратную реакцию бывает трудно зафиксировать.
Ферменты – необходимые участники процесса пищеварения. Только низкомолекулярные соединения могут проходить через стенку кишечника и попадать в кровоток, поэтому компоненты пищи должны быть предварительно расщеплены до небольших молекул. Это происходит в ходе ферментативного гидролиза (расщепления) белков до аминокислот, крахмала до сахаров, жиров до жирных кислот и глицерина. Гидролиз белков катализирует фермент пепсин, содержащийся в желудке. Ряд высокоэффективных пищеварительных ферментов секретирует в кишечник поджелудочная железа. Это трипсин и химотрипсин, гидролизующие белки; липаза, расщепляющая жиры; амилаза, катализирующая расщепление крахмала. Пепсин, трипсин и химотрипсин секретируются в неактивной форме, в виде т.н. зимогенов (проферментов), и переходят в активное состояние только в желудке и кишечнике. Это объясняет, почему указанные ферменты не разрушают клетки поджелудочной железы и желудка. Стенки желудка и кишечника защищает от пищеварительных ферментов и слой слизи. Некоторые важные пищеварительные ферменты секретируются клетками тонкого кишечника. Большая часть энергии, запасенной в растительной пище, такой, как трава или сено, сосредоточена в целлюлозе, которую расщепляет фермент целлюлаза. В организме травоядных животных этот фермент не синтезируется, и жвачные, например крупный рогатый скот и овцы, могут питаться содержащей целлюлозу пищей только потому, что целлюлазу вырабатывают микроорганизмы, заселяющие первый отдел желудка – рубец. С помощью микроорганизмов происходит переваривание пищи и у термитов. Ферменты находят применение в пищевой, фармацевтической, химической и текстильной промышленности. В качестве примера можно привести растительный фермент, получаемый из папайи и используемый для размягчения мяса. Ферменты добавляют также в стиральные порошки.
|
НЕКОТОРЫЕ ФЕРМЕНТЫ И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ |
|||
|
Тип химической реакции |
Фермент |
Источник |
Катализируемая реакция1) |
|
Гидролиз |
Трипсин |
Тонкий кишечник |
Белки + H2O → Разные полипептиды |
|
Гидролиз |
β-Амилаза |
Пшеница, ячмень, батат и т.д. |
Крахмал + H2O → Гидролизат крахмала + Мальтоза |
|
Гидролиз |
Тромбин |
Кровь |
Фибриноген + H2O → Фибрин + 2 Полипептида |
|
Гидролиз |
Липазы |
Кишечник, семена с большим содержанием жиров, микроорганизмы |
Жиры + H2O → Жирные кислоты + Глицерин |
|
Гидролиз |
Щелочная фосфатаза |
Почти все клетки |
Органические фосфаты + H2O → Дефосфорилированный продукт + Неорганический фосфат |
|
Гидролиз |
Уреаза |
Некоторые растительные клетки и микроорганизмы |
Мочевина + H2O → Аммиак + Диоксид углерода |
|
Фосфоролиз |
Фосфорилаза |
Ткани животных и растений, содержащие полисахариды |
Полисахарид (крахмал или гликоген из n молекул глюкозы) + Неорганический фосфат |
|
Декарбоксилирование |
Декарбоксилаза |
Дрожжи, некоторые растения и микроорганизмы |
Пировиноградная кислота → Ацетальдегид + Диоксид углерода |
|
Конденсация |
Альдолаза |
Все животные клетки; многие растения и микроорганизмы |
2 Триозофосфата |
|
Конденсация |
Оксалоацетат-трансаце- тилаза |
То же |
Щавелевоуксусная кислота + Ацетил- кофермент А |
|
Изомеризация |
Фосфогексозоизомераза |
То же |
Глюкозо-6-фосфат |
|
Гидратация |
Фумараза |
То же |
Фумаровая кислота + H2O |
|
Гидратация |
Карбоангидраза |
Разные ткани животных; зеленые листья |
Диоксид углерода + H2O |
|
Фосфорилирование |
Пируваткиназа |
Почти все (или все) клетки |
АТФ + Пировиноградная кислота |
|
Перенос фосфатной группы |
Фосфоглюкомутаза |
Все животные клетки; многие растения и микроорганизмы |
Глюкозо-1-фосфат |
|
Переаминирование |
Трансаминаза |
Большинство клеток |
Аспарагиновая кислота + Пировиноградная кислота |
|
Синтез, сопряженный с гидролизом АТФ |
Глутаминсинтетаза |
То же |
Глутаминовая кислота + Аммиак + АТФ |
|
Окисление-восстановление |
Цитохромоксидаза |
Все животные клетки, многие растения и микроорганизмы |
O2 + Восстановленный цитохром c → Окисленный цитохром c + H2O |
|
Окисление-восстановление |
Оксидаза аскорбиновой кислоты |
Многие растительные клетки |
Аскорбиновая кислота + O2 → Дегидроаскорбиновая кислота + Пероксид водорода |
|
Окисление-восстановление |
Цитохром c редуктаза |
Все животные клетки; многие растения и микроорганизмы |
НАД·Н (восстановленный кофермент) + Окисленный цитохром c → Восстановленный цитохром c + НАД (окисленный кофермент) |
|
Окисление-восстановление |
Лактатдегидрогеназа |
Большинство животных кле- ток; некоторые растения и микроорганизмы |
Молочная кислота + НАД (окисленный кофермент) |
Примечание. 1) Одинарная стрелка означает, что реакция идет фактически в одну сторону, а двойные стрелки – что реакция обратима.
Осознание ключевой роли ферментов во всех клеточных процессах привело к широкому их применению в медицине и сельском хозяйстве. Нормальное функционирование любого растительного и животного организма зависит от эффективной работы ферментов. В основе действия многих токсичных веществ (ядов) лежит их способность ингибировать ферменты; таким же эффектом обладает и ряд лекарственных препаратов. Нередко действие лекарственного препарата или токсичного вещества можно проследить по его избирательному влиянию на работу определенного фермента в организме в целом или в той или иной ткани. Например, мощные фосфорорганические инсектициды и нервно-паралитические газы, разработанные в военных целях, оказывают свой губительный эффект, блокируя работу ферментов – в первую очередь холинэстеразы, играющей важную роль в передаче нервного импульса. Чтобы лучше понять механизм действия лекарственных препаратов на ферментные системы, полезно рассмотреть, как работают некоторые ингибиторы ферментов. Многие ингибиторы связываются с активным центром фермента – тем самым, с которым взаимодействует субстрат. У таких ингибиторов наиболее важные структурные особенности близки к структурным особенностям субстрата, и если в реакционной среде присутствуют и субстрат и ингибитор, между ними наблюдается конкуренция за связывание с ферментом; при этом чем больше концентрация субстрата, тем успешнее он конкурирует с ингибитором. Ингибиторы другого типа индуцируют в молекуле фермента конформационные изменения, в которые вовлекаются важные в функциональном отношении химические группы. Изучение механизма действия ингибиторов помогает химикам создавать новые лекарственные препараты.
Библиографическая ссылка
Ермаханов М.Н., Сабденова У.О., Асылбекова Г.Т., Парманова Ж.Т., Куандыкова Э.Т., Еримбетова А.А. ФЕРМЕНТЫ // Международный журнал прикладных и фундаментальных исследований. 2016. № 3-1. С. 103-106;URL: https://applied-research.ru/ru/article/view?id=8681 (дата обращения: 31.01.2026).


 Глюкозо-1-фосфат + Полисахарид (n – 1 глюкозных единиц)
Глюкозо-1-фосфат + Полисахарид (n – 1 глюкозных единиц) Гексозодифосфат
Гексозодифосфат Лимонная кислота + Кофермент А
Лимонная кислота + Кофермент А Фруктозо-6-фосфат
Фруктозо-6-фосфат Яблочная кислота
Яблочная кислота Угольная кислота
Угольная кислота Фосфоенолпировиноградная кислота + АДФ
Фосфоенолпировиноградная кислота + АДФ Глюкозо-6-фосфат
Глюкозо-6-фосфат Щавелевоуксусная кислота + Аланин
Щавелевоуксусная кислота + Аланин Глутамин + АДФ + Неорганический фосфат
Глутамин + АДФ + Неорганический фосфат Пировиноградная кислота + НАД·Н (восстановленный кофермент)
Пировиноградная кислота + НАД·Н (восстановленный кофермент)