Число случаев сепсиса неуклонно растет, в том числе и в странах с высокоразвитой медициной [6]. Из-за гипотетического толкования множества вопросов по проблеме сепсиса дальнейшее его изучение в клинике и эксперименте и по сегодняшний день не теряет своей актуальности: не существует общепринятого понятия сепсиса, единой классификации и т.д. За последние годы была разработана и представлена новая классификация и диагностические критерии сепсиса [10]. Данная классификация определяет следующие клинические категории: cиндром системной воспалительной реакции, сепсис, тяжелый сепсис, сепсис с полиорганной недостаточностью, септический шок; подчеркивается, что степень тяжести дисфункции орган является важным определяющим фактором прогноза сепсиса. Отмечается, что характер, патогенность и продолжительность воздействия микробного фактора во многом определяет выраженность полиорганной дисфункции [3]. В развитии септической реакции и полиорганной недостаточности принципиальная роль отводиться недостаточности печени [7], общеизвестно об активном участии звездчатых макрофагов печени (звездчатые макрофаги печени – так называемые клетки Купфера – кК) в защите организма от токсических веществ и инфекции [8]. На сегодняшний день в большинстве случаев сепсис вызван грамположительной микрофлорой; однако, патогенез сепсиса, вызванного грампозитивной флорой, до настоящего времени изучен значительно меньше. В общей сумме возбудителей сепсиса возрастает доля коагулазонегативных («эпидермальных») стафилококов, метициллинорезистентных штаммов золотистого стафилококка и энтерококков, возрастает также удельный вес сепсиса смешанной этиологии. Несмотря на огромное количество литературных данных, до настоящего времени морфологический субстрат полиорганной недостаточности – одной из ведущей причины высокой летальности, – в динамике сепсиса различной этиологии изучен недостаточно. В настоящей работе мы представляем некоторые результаты нашего опыта работы в этой области.
Цель исследования
Целью настоящей работы явилось гистологические и количественное исследование патоморфологических изменений печени в динамике экспериментального стафилококкового сепсиса с учетом его этиологической структуры.
Материалы и методы исследования
Эксперименты были проведены на 20 половозрелых кроликах обоего пола породы «Шиншилла». Им предварительно внутривенно вводили стафилококковый токсин 0,06 мл (Lh – 0,08) и через 48 часов кроликам из первой серии экспериментов внутрибрюшинно – 30-миллиардную взвесь 24-часовой культуры золотистого стафилококка штамма № 4293 из крови септического больного, а кроликам из второй серии экспериментов помимо вышеотмеченного штамма в том же количестве также внутрибрюшинно вводили и 80 миллиардную взвесь культуры эпидермального стафилококка штамма № 3347 [2, 4]. Контролем служили интактные животные (3 кролика). Здесь мы представляем данные исследования печени тех кроликов, которые перенесли бактериальную интоксикацию и были выведены из эксперимента на 9-е, 10-е и 14-е сутки после введения микробной культуры. Были использованы гистологические и морфометрические методы исследования. Для морфометрической оценки печени был использован метод «Визуальной классификации под статистическим контролем» [1]. На препаратах, окрашенных гематоксилин-эозином, мы оценивали классы гепатоцитов (при увеличении 90X10), а также классы клеток Купфера (при увеличении 40x10). Было выделено 5 классов гепатоцитов, различаемых визуально (гепатоцит с нормальным строением, гепатоциты в стадии зернистой, вакуольной дистрофии и некроза, а также – двуядерный, гипертрофированный гепатоцит) и 3 классов клеток Купфера (кК с нормальным строением, гипертрофированные и дистрофически-некротически измененные звездчатые макрофаги). Вычислялись средние доли каждого класса и их доверительные интервалы в процентах. На срезах печени, окрашенных гематоксилин-эозином (при увеличении 20X10), методом точечного счета измерялись средние доли гепатоцитов и синусоидов и их доверительные интервалы в процентах. Применялась окулярная вставка «ВК-4». При статистическом анализе использовали компьютерный пакет программ «Биостатистика». Исследование проводилось согласно локальным правилам по содержанию и использованию лабораторных животных.
Результаты исследования и их обсуждение
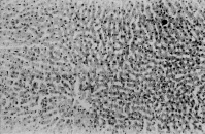
В наших экспериментах в печени был отмечен тромбогеморрагический синдром: центральные вены и синусоиды печени расширены, кровенаполнены, наблюдается агрегация эритроцитов в их просветах, вокруг портального поля – отек и разрыхление соединительной ткани; синусоиды расширены настолько, что наблюдается атрофия печеночных балок (рис. 1, А, Б).
А Б
Рис. 1. Гистоструктура печени кроликов из I серии экспериментов. (А – 9-е сутки после введения микробной культуры) расширение и кровенаполнение центральных вен и синусоидов печени, агрегация эритроцитов в их просветах, атрофия печеночных балок. (Б – 10-е сутки после введения микробной культуры ) Отек и разрыхление соединительной ткани вокруг портального поля, агрегация эритроцитов в просвете междолькового сосуда печени. Парафиновые срезы, окраска гематоксилин-эозином, увеличение: А, Б – x200
С удлинением срока сепсиса статистически достоверно уменьшается средняя доля гепатоцитов, а средняя доля синусоидов возрастает (рис. 2).
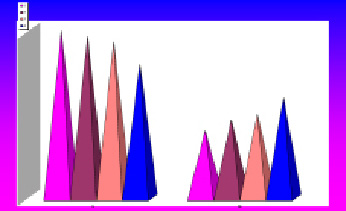
Рис. 2. Средние доли гепатоцитов (А) (%) и синусоидов (Б) (%) в контроле (1), на 9-е (2), 10-е (3) и 14-е (4) сутки после введения микробной культуры (первая серия экспериментов)
Примечательно, что в основе современных методов комплексного лечения сепсиса лежит новое понимание сложного патогенеза данной болезни, в соответствии с которым гомеостаз организма нарушается неконтролируемым каскадом воспаления, коагуляции и фибринолиза, что приводит к тромбозам микрососудов, недостаточности органов и смерти больного; тромботическая микроангиопатия считается важным патофизиологическим звеном данного заболевания [9]. В наших предыдущих работах [5 и др.] при использовании дополнительно одного из таких методов – плазмафереза, – было зафиксировано статистически достоверное уменьшение показателя недостаточности органов и систем на 18,6%. Согласно результатам настоящей работы, тромбогеморрагический синдром охватывал не только кровь, но и ткани сосудистых стенок и паренхимы печени; тромбогеморрагические изменения имели тенденцию к нарастанию с удлинением продолжительности сепсиса.
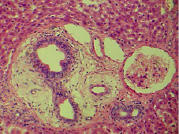
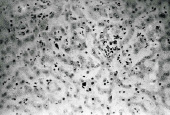
Микроциркуляторные нарушения приводят к развитию нарастающих дистрофически-некротических изменении гепатоцитов и синусоидальных клеток печени; клетки Купфера набухшие, местами наблюдается их гиперплазия, а также других синусоидальных клеток, инфильтрация кК, местами они десквамированы (рис. 3, А). Выявляются участки обширных некрозов гепатоцитов; в таких местах структура печени фактически стерта, отмечались обширные кровоизлияния (рис. 3, Б). С удлинением продолжительности сепсиса статистически достоверно возрастает средняя доля дистрофически-некротически измененных гепатоцитов и уменьшается средняя доля гепатоцитов с нормальным строением (рис. 4). Мы разделяем мнение о значении продолжительности воздействия микробного фактора в развитии полиорганной дисфункции [3].
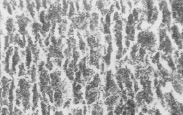
А Б
Рис. 3. Гистоструктура печени кроликов из II серии экспериментов. (А – 10- е сутки после введения микробной культуры) Набухшие кК, гиперплазия кК и других синусоидальных клеток; инфильтрация кК, местами они десквамированы. (Б – 14-е сутки после введения микробной культуры) обширные некрозы гепатоцитов; обширные кровоизлияния , структура печени фактически стерта. Парафиновые срезы, окраска гематоксилин-эозином, увеличение: А, Б – x400
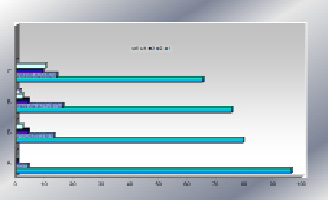
Рис. 4. Средние доли морфологических классов гепатоцитов (%) в контроле (А), на 9-е (Б), 10-е (В) и 14-е (Г) сутки после введения микробной культуры; гепатоцит с нормальным строением (1), гепатоциты в стадии зернистой (2), вакуольной (3) дистрофии и некроза (4), гипертрофированные гепатоциты (5) (первая серия экспериментов)
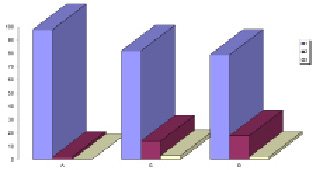
Рис. 5. Средние доли морфологических классов кК (%) в контроле (А), в первой (Б) и во второй (В) сериях экспериментов; 1 – кК с нормальным строением, 2 – гипертрофированные кК, 3 – дистрофически-некротически измененные кК (10-е сутки после введения микробной культуры)
Ряд авторов указывают на значение реактивности макрорганизма при сепсисе [2]; в действительности, на нашем материале, при гистологическом исследовании отмечались незначительные индивидуальные колебания, которые не выходили за пределами морфологической картины соответствующего срока выведения животных из эксперимента после введения микробной культуры. Однако, количественные параметры печени при сепсисе, вызванного только золотистым стафилококком и при сепсисе, вызванного совместным заражением кроликов золотистым и эпидермальным стафилококками, не отличались друг от друга статистически достоверно ни на 9-е, ни на 10-е и ни на 14-е сутки после введения микробной культуры (рис. 5).
Заключение
Количественные параметры печени при сепсисе, вызванного только золотистым стафилококком и при сепсисе, вызванного совместным заражением кроликов золотистым и эпидермальным стафилококками, не отличались друг от друга статистически достоверно ни на 9-е, ни на 10-е и ни на 14-е сутки после введения микробной культуры; при гистологическом исследовании отмечались незначительные индивидуальные колебания, которые не выходили за пределами морфологической картины соответствующего срока выведения животных из эксперимента после введения микробной культуры.
При экспериментальном стафилококковом сепсисе различной этиологии в печени были выявлены однотипные изменения; в первую очередь, нарастающие с удлинением продолжительности сепсиса микроциркуляторные нарушения, которые приводят к развитию также нарастающих дистрофически-некротических изменении гепатоцитов и синусоидальных клеток печени.
Библиографическая ссылка
Дгебуадзе М. А., Ратиани Л. Р. ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ПЕЧЕНИ В ДИНАМИКЕ ЭКСПЕРИМЕНТАЛЬНОГО СТАФИЛОКОККОВОГО СЕПСИСА // Международный журнал прикладных и фундаментальных исследований. 2016. № 3-4. С. 565-569;URL: https://applied-research.ru/ru/article/view?id=8934 (дата обращения: 11.02.2026).

