Предприятия цветной металлургии, имеющие гидрометаллургические и электрохимические производства, являются источниками жидких стоков, содержащих значительное количество тяжелых цветных металлов. Вредные химические элементы, попадая в водоемы, ухудшают их санитарное состояние и вызывают необходимость специальной очистки воды перед ее дальнейшим использованием. Традиционные методы очистки воды, такие как осаждение, отстаивание, коагуляция не позволяют снизить концентрации ионов тяжелых металлов до ПДК, что требует введения в комплексную технологическую схему водоподготовки стадии сорбционной доочистки. Как правило, эта стадия является заключительным этапом в технологическом процессе очистки сточных вод, позволяя добиться нормативных показателей без внесения дополнительного количества реагентов. Исследования, проведенные в последние годы, показали, что более 70 природных и синтетических сорбентов можно использовать для удаления металлов из водных сред [3]. При использовании природных сорбентов не всегда удается получить воспроизводимые результаты, что обусловлено нестабильным химическим и гранулометрическим составом таких материалов. Использование синтетических сорбентов дает более надежные результаты по очистке стоков, и позволяет увеличить срок эксплуатации за счёт возможности их регенерации и утилизации. Наиболее перспективными ионитами для удаления ионов тяжелых металлов являются материалы, содержащие комплексообразующие функциональные группы, способные не только ионизировать, но и проявлять электродонорные свойства. При контакте таких ионитов с ионами переходных металлов, имеющих вакантные орбитали, сорбция происходит за счет донорно-акцепторного (координационного) взаимодействия. Среди неорганических ионитов, обладающих комплексообразующим действием наиболее известны фосфаты металлов (IV), в частности фосфат титана и фосфат циркония [8].
Все публикуемые материалы, касающиеся сорбции на фосфатах металлов (IV) относятся к кристаллическим или аморфным материалам состава Mе(HPO4)2. В данной работе изучено сорбционное поведение и показан механизм сорбции для освоенных к промышленному выпуску аморфных гидроксофосфатов титана состава Ti(OH)2х(HPO4)2-х? nH2O.
Материалы и методы исследования
Объектом исследований был выбран аморфный гидрофосфат титана состава Ti(OH)1.36(HPO4)1.32?2.3H2O (TiP), синтезированный в соответствии с методикой, подробно описанной ранее [7]. Конечный продукт относится к мезопористым материалам, имеет удельную поверхность 94.4 м2/г, общий объем пор 0.53 см3/г и средний диаметр пор 20.8 нм. В качестве источников цветных металлов использовали растворы хлоридов Cu, Co, Ni заданной концентрации.
Потенциометрическое титрование фосфата титана в 0.1 М растворе КCl при различных температурах проводили при термостатировании в ячейке закрытого типа, через которую для удаления растворенного СО2 продували азот в течение 2 ч. Азот предварительно пропускали через водные растворы 10 % NaOH, 10 % H2SO4, а затем дистиллированную воду и 0.1 М водный раствор КCl. Титрование проводили с использованием автоматического потенциометрического титратора АТП-02, Аквилон, снабженного микробюреткой и электродом ЭСК 10601/7. В каждом эксперименте 25 мл электролита и 0.1 г TiP помещали в ячейку и при постоянном перемешивании проводили титрование 0.01N КОН в присутствии или отсутствии (холостой опыт) ионов цветных металлов. После каждого добавления щелочи суспензию выдерживали до состояния равновесия, при котором регистрируемое изменение рН составляло менее 0.01ед./мин.
При изучении сорбции ионов Cu2+, Co2+, Ni2+ в статических условиях 0.2 г образца ионита заливали растворами хлоридов металлов заданной концентрации при соотношении твердой и жидкой фаз 1:200 и выдерживали при температуре 22 °С и периодическом перемешивании до состояния равновесия, при этом регистрировали равновесное значение рН. Исходное значение рН растворов устанавливали добавлением КОН/HCl. После отделения ионита равновесная жидкая фаза анализировалась на содержание сорбата с использованием спектрофотометра Perkin-Elmer FT-IR 200 spectrometer. На основании полученных результатов рассчитывали емкость сорбента по определяемому иону (мг-экв?г-1)
Результаты исследования и их обсуждение
На рис. 1 приведены кривые титрования TiP в 0.1 N KCl. Очевидно, что c увеличением количества вводимой щелочи рН суспензии плавно растет. Кривые титрования не имеют четко выраженных ступеней, что свидетельствует о непрерывной диссоциации функциональных групп, что характерно для слабокислотных ионитов.
В присутствии металлов наблюдается смещение кривых титрования в область более низких значений рН по сравнению с холостым опытом. При этом наибольшее отклонение кривой наблюдается при титровании в присутствии ионов Cu2+, наименьшее – в присутствии ионов Co2+. Согласно полученным данным, ряд сорбционной активности TiP по отношению к выбранным ионам можно представить в следующем виде: Cu2+> Ni2+> Co2+. Сорбционная способность ионов металлов связана с их первой константой гидролиза (рКгидр). Константы гидролиза изучаемых металлов: рКгидрCu = 8.01 рКгидрCo = = 8.9 рКгидрNi = 9.9 [6]. Чем ниже константа гидролиза, тем больше сорбционная способность металла, что согласуется с полученными нами результатами.
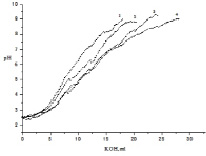
Рис. 1. Потенциометрическое титрование TiP в растворе 0.1 моль/л KCl в отсутствии (1) и присутствии катионов Co2+ (2), Ni2+(3) и Cu2+(4); концентрация металлов в растворах 2·10-4моль/л
По данным потенциометрического титрования холостого опыта определили концентрацию функциональных групп в ионите. Полученное значение 5.31 мг-экв·г-1 близко к теоретической обменной емкости, рассчитанной на основе химической формулы исследуемого фосфата титана (5.52 мг-экв·г-1). Это вполне объясняется строением аморфных материалов, у которых часть фосфатных групп занята в построении титано-фосфатных цепочек и не является ионообменными. При титровании до рН = 6 обменная емкость составляет немногим меньше половины полной обменной емкости (2.3 мг-экв·г-1), что подтверждает слабокислую природу функциональных групп.
Смещение кривых в область низких значений рН с увеличением концентрации металла свидетельствует о том, что сорбент обладает достаточно высоким сродством к выбранным ионам, поскольку значительное количество ионов водорода выделяется в систему в результате ионного обмена согласно реакции
nRH+M(aq)x+→RnMx-n+nH(aq)+.
Для исследования закономерностей сорбционного извлечения катионов цветных металлов на TiP и установления возможного механизма процесса сорбции было рассмотрено влияние исходной концентрации, температуры и рН растворов на его сорбционную способность.
Известно, что наряду с концентрацией функциональных групп значительное влияние на сорбционные свойства материала оказывает степень их протонирования. Для катионитов функциональные группы являются активными, если они находятся в депротонированном состоянии. Поскольку TiP относится к слабокислотным ионообменникам, то его сорбционная активность существенно зависит от рН исходного раствора. Выбранная область значений рН, соответствующая ионным состояниям металла в рабочих растворах, составляла для Cu2+ 3-5, для Co2+ 3-7.5, для Ni2+ 3-8. Согласно диаграммам состояния, приведенным в работе [2] данные значениях рН ниже начала образования гидроксидов металлов. Установлено, что по мере увеличения рН количество поглощаемых катионов возрастает и достигает максимальных значений 79.3, 68.8 и 64.5 мг·г-1 для Cu2+, Ni2+ и Co2+, соответственно (рис. 2).
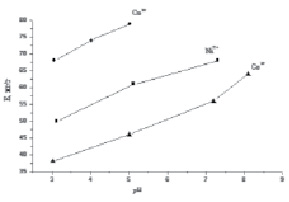
Рис. 2. Зависимость сорбции от рН раствора. Исходная концентрация Ме2+ растворе 6.4·10-3 моль/л
Согласно полученным изотермам сорбция металлов увеличивается с повышением температуры и концентрации металлов в растворе (рис. 3, 4).
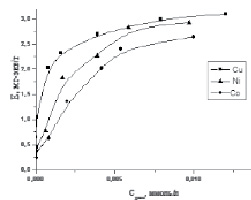
Рис. 3. Изотермы сорбции катионов цветных металлов TiP при 20 °С
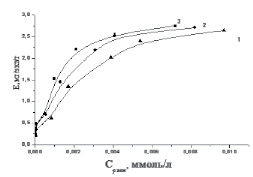
Рис. 4. Изотермы сорбции ионов Со2+ при различной температуре, °С: 1– 20; 2 – 40; 3 – 60
Увеличение сорбции с повышением температуры коррелирует с увеличением степени диссоциации функциональных групп.
Как видно из представленных результатов, исследуемый ионит обладает хорошей сорбционной способностью по отношению к ионам цветных металлов. Количество поглощенного катиона металла увеличивается по мере возрастания его содержания в исходном растворе до 350–400 мг/л, а затем остается практически неизменным. Степень сорбции (рис. 5), составляет практически 100 % при исходной концентрации металлов в растворе до 150 мг/л.
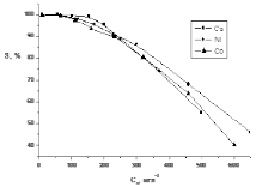
Рис. 5. Зависимость степени сорбции (S) от концентрации Ме (С0) в исходном растворе
Наиболее высокой сорбционной способностью исследуемый материал обладает по отношению к иону Cu2+, наименьшей к иону Со2+.
Полученные данные были использованы для определения константы равновесия в соответствии с уравнением Лэнгмюра:
Сравн/Х = (1/KХm) + Cравн /Xm,
где Сравн – равновесная концентрация адсорбата в растворе, моль/л, Х –количество адсорбата на единицу массы адсорбента, моль/г, Xm – количество адсорбата в форме монослоя, моль/г, K – константа равновесия. Анализ прямых, построенных в координатах Сравн/Х-Сравн позволил определить численные значения Xm и b (табл. 1).
Таблица 1
Значения Xm (ммоль/г) и константы равновесия (K) при сорбции на TiP
|
T, °C |
Ni2+ |
Co2+ |
Cu2+ |
|||
|
Xm |
K |
Xm |
K |
Xm |
K |
|
|
20 |
2.54 |
1791 |
2.30 |
1441 |
2.90 |
2628 |
|
40 |
2.61 |
1846 |
2.48 |
1485 |
3.19 |
2711 |
|
60 |
2.85 |
1983 |
2.66 |
1572 |
3.49 |
2836 |
Таблица 2
Селективность TiP в зависимости от концентрации металлов и температуры в присутствии 1М раствора NaCl
|
Ме |
Сисх, 10-4моль/л |
log Kd |
||
|
20 °С |
40 °С |
60 °С |
||
|
Cu2+ |
2 |
5.56 |
5.61 |
5.69 |
|
4 |
4.91 |
5.12 |
5.24 |
|
|
8 |
4.14 |
4.21 |
4.28 |
|
|
Co2+ |
2 |
3.49 |
3.57 |
3.65 |
|
4 |
3.35 |
3.49 |
3.61 |
|
|
8 |
3.02 |
3.18 |
3.27 |
|
|
Ni2+ |
2 |
3.26 |
3.35 |
3.42 |
|
4 |
3.16 |
3.28 |
3.36 |
|
|
8 |
2.86 |
2.94 |
3.03 |
|
Очевидно, что значения обоих параметров увеличиваются с повышением температуры, что свидетельствует об увеличении сорбции и указывает на эндотермическую природу процесса.
Для получения информации о селективности ионита был определен коэффициент распределения, Kd (мл/г) для выбранных ионов при различных концентрациях ионов металла и температуре. Рассчитанные значения Kd сведены в табл. 2.
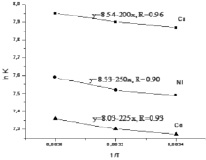
Рис. 6. Зависимость ln K от T-1
Из зависимости коэффициента распределения Кd обменивающихся ионов от содержания их в жидкой фазе видно, что снижение исходной концентрации металла в растворе способствует увеличению сорбции многозарядных ионов. Значения Кd уменьшаются при увеличении степени обмена ионов. Рассчитанные значения Кd показывают, что медь сорбируется лучше, чем кобальт и никель. Коэффициент разделения β = Kd(Ме1)/Kd(Ме2) для выбранных систем составляет: Kd(Cu)/Kd(Co) = 1.4-1.6, Kd(Cu)/Kd(Ni) = 1.3-1.7.
Изменение энтальпии ΔН определили из анализа графика ln K – T-1 (рис. 6), значения энтропии ΔS рассчитали в соответствии с уравнением:
ln K = ΔS/R – ΔН/RT
Полученные значения ΔS и ΔН использовали для расчета энергии Гиббса:
ΔG = ΔН – T·ΔS.
Анализ полученных данных (табл. 3, 4) свидетельствует, что во всех случаях процесс сорбции является эндотермическим. Эндотермичность системы обуславливается значительными энергетическими затратами, связанными с дегидратацией функциональных групп и ионов металлов в результате сорбции. Следует отметить, что полученные значения ΔS и ΔН близки по своим величинам к полученным калориметрическим методам для аморфного фосфата титана [9].
Таблица 3
Изменение энтропии и энтальпии при обмене на аморфном фосфате титана
|
Ион металла |
ΔS, Дж/К·моль |
ΔH, кДж/моль |
|
Cu2+ |
70.1 |
1.67 |
|
Ni2+ |
69.2 |
2.07 |
|
Co2+ |
66.7 |
1.87 |
Таблица 4
Изменение свободной энергии Гиббса (ΔG, кДж/моль) при обмене на аморфном фосфате титана
|
Температура, К |
Cu2+ |
Ni2+ |
Co2+ |
|
293 |
– 18.87 |
– 18.23 |
– 17.67 |
|
313 |
– 20.27 |
– 19.59 |
– 18.99 |
|
333 |
– 21.67 |
– 21.0 |
– 20.34 |
Исходя из значений ΔH можно предположить, что энтальпия увеличивается при переходе от катионов меди к никелю вследствие снижения гидратации ионов и в изучаемых условиях перегидратация ионов вносит определенный вклад в энтальпию процесса сорбции. Значения энтропии ионного обмена понижаются в выбранном ряду. Вследствие дегидратации ионов при взаимодействии с фосфатными группами в системе появляется больше молекул свободной воды, что обуславливает неупорядоченность системы. Этот эффект усиливается при переходе к более гидратированным ионам меди.
Для определения порядка реакции использовали кинетические модели псевдо-первого, псевдо-второго порядкa и модель Еловича, позволяющие выявить вклад химической стадии в общую скорость процесса сорбции. Кинетическое уравнение псевдо-первого порядка можно представить в виде:
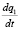 = k1(qe – qt)
= k1(qe – qt)
или в линейной форме [1]:
log(qe – qt) = log qe – 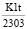 ,
,
где qe и qt – количество металла, сорбированное при равновесии и за определенный промежуток времени t (мг/г), К1 – константа скорости, мин-1. Линеаризация уравнения в координатах log(qe – qt) – t позволяет определить константу адсорбции и количество металла, сорбируемое при равновесии.
Кинетическое уравнение псевдо-второго порядка в линейной форме имеет вид [4]:
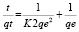 ,
,
где К2 – константа скорости, г·мг-1·мин-1. Решение уравнения в координатах tqt-1 – t позволяет найти значения к2 и qe.
Линейная форма уравнения Еловича может быть записана как [5]:
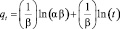 ,
,
где α – исходная скорость сорбции, мг/г·мин, β – константа скорости сорбции, г/мг. Линеаризация уравнения в координатах qt – ln(t) позволяет определить константу Еловича β и исходную скорость сорбции α. Полученные результаты представлены в табл. 5.
Таблица 5
Кинетические параметры сорбции Co2+ Cu2+ на TiP
|
Модель |
Параметры |
Co2+ |
Cu2+ |
|
Псевдо-первого порядка |
К1, мин-1 |
0,041 |
0,037 |
|
qe, мг/г |
59,5 |
64,8 |
|
|
R |
0,967 |
0,925 |
|
|
Псевдо-второго порядка |
К2·10-3, г·мг-1·мин-1 |
0,136 |
0,174 |
|
qe, мг/г |
97,9 |
116,4 |
|
|
R |
0,994 |
0,991 |
|
|
Еловича |
α, мг/г·мин |
8,5 |
6,3 |
|
β·10-2, г/мг |
11,2 |
9,74 |
|
|
R |
0,986 |
0,961 |
Полученные значения коэффициентов корреляции незначительно отличаются друг от друга (R = 0.92 – 0.99), но кинетика сорбции выбранных катионов лучше всего описывается моделью псевдо-второго порядка и стадия взаимодействия ионов металлов с функциональными группами может вносить вклад в процесс сорбции.
Заключение
Методом потенциометрического титрования изучено сорбционное поведение аморфного фосфата титана по отношению к катионам цветных металлов. Показано, что температура и рН водной среды оказывает влияние на его сорбционную активность. Максимальные значения сорбционной емкости для исследуемых катионов составляют 79.3; 68.8 и 64.5 мг/г для Сu2+, Ni2+, Co2+ соответственно. Обработка экспериментальных данных в соответствии с уравнением Лэнгмюра позволила рассчитать численные значения константы равновесия и представить ряд селективности: Cu2+> Ni2+> Co2+. Установлено, что процессы сорбции для катионов цветных металлов являются эндотермическими, что обусловлено значительными энергетическими затратами на дегидратацию функциональных групп и ионов металлов в результате сорбции. Кинетика сорбции выбранных катионов лучше ввсего описывается моделью псевдо-второго порядка и стадия взаимодействия ионов металлов с функциональными группами может вносить вклад в процесс сорбции.
Библиографическая ссылка
Маслова М.В., Герасимова Л.Г., Николаев А.И СОРБЦИОННОЕ ПОВЕДЕНИЕ АМОРФНОГО ФОСФАТА ТИТАНА ПО ОТНОШЕНИЮ К КАТИОНАМ ПЕРЕХОДНЫХ МЕТАЛЛОВ // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-2. С. 356-361;URL: https://applied-research.ru/ru/article/view?id=8971 (дата обращения: 03.03.2026).

