Одним из методов предотвращения массивной тромбоэмболии легочной артерии (ТЭЛА) у больных флотирующим тромбомбозом илеофеморального сегмента является имплантация в нижнюю полую вену (НПВ) кава-фильтров (КФ) различной конструкции. Первые попытки эндоваскулярной профилактики ТЭЛА были сделаны почти полвека тому назад [1], когда с этой целью был установлен в НПВ зонтичный фильтр. В дальнейшем техника эндоваскулярной профилактики ТЭЛА совершенствовалась благодаря созданию новых миниатюрных, в основном проволочных моделей КФ, специально предназначенных для чрезкожной имплантации в НПВ. Существует три группы КФ в зависимости от их предназначения и конструкции:
1) постоянные – эндоваскулярное удаление которых невозможно
2) временные – удаление обязательно
3) съемные или удаляемые – удаление возможно, но не обязательно.
Постоянные КФ имплантируют на срок, соответствующий продолжительности жизни пациента. Они предназначены для перманентной защиты больного с потенциальной опасностью возникновения ТЭЛА и неустранимыми факторами риска тромбоэмболических состояний. Конструкция постоянных КФ должна обеспечивать высокую способность улавливать тромбоэмболы при минимальных препятствиях кровотоку; сохранять оптимальные условия гемодинамики после улавливания тромбоэмболов; обладать атромбогенностью, биологической инертностью, механической прочностью, устойчивостью к коррозии; обеспечивать надежную фиксацию с минимальным риском повреждения НПВ и прилегающих к ней органов.
Съемные или удаляемые КФ используют в зависимости от клинической ситуации для постоянной или временной имплантации. Они должны гарантировать возможность простого и безопасного их удаления из НПВ после ликвидации угрозы ТЭЛА. К этим фильтрам предъявляют такие же требования как к постоянным, но с определенными дополнениями. В их конструкцию включены детали, обеспечивающие захват фильтра и отсоединение его фиксаторов от стенок вены.
Временные КФ устанавливают в НПВ, как правило, на 2–3 недели. Одна из основных задач временных КФ – профилактика легочной эмболии во время проведения тромболитической терапии венозных тромбозов и легочной эмболии. В их конструкции нет фиксирующих крючков, которые могли бы стать причиной перфорации вены и образования экстравазальной гематомы в процессе тромболизиса.
Об эффективности имплантации КФ в предотвращении ТЭЛА можно судить по результатам крупного рандомизированного исследования [2]. Имплантация КФ наряду с антикоагулянтной терапией способствовала снижению частоты ТЭЛА по сравнению с применением только антикоагулянтов (1 % и 5 % соответственно). Однако, это различие было достоверно лишь в первые 12 дней, в то время как через два года частота клинически значимой ТЭЛА и смертность от нее в обеих группах не различались, а общая смертность через 8 лет также оказалась одинаковой.
Вместе с тем, у больного с имплантированным КФ имеется потенциальная угроза в отношении развития ряда осложнений, непосредственно связанных с наличием КФ и создающих комплекс проблем в ведении данной категории пациентов. Имплантированный КФ, сохраняющий здоровье и жизнь больного на ранних стадиях, в отдаленные сроки может стать причиной осложнений различной степени тяжести, которые в отдельных случаях оказываются даже более значимыми, чем польза от имплантации КФ. Осложнения имплантации КФ могут возникать непосредственно во время процедуры, спустя несколько дней и через несколько месяцев или лет после имплантации [3]. Подобные ситуации в виде развития осложнений, связанных с имплантацией в организм с лечебно-профилактической целью различных устройств (суставные и сосудистые протезы, искусственные клапаны сердца, водители ритма, кава-фильтры и др.) правомочно расценивать как один из видов ятрогении – «имплантационная ятрогения». Таким образом, имплантация КФ влечёт за собой риск возникновения целого ряда ятрогенных событий, имеющих различное клиническое и прогностическое значение:
– инфекционные осложнения (встречаются в 0,5–20 % случаев. Наиболее вероятная причина их возникновения – якорное устройство и недостаточный уход).
– повреждения кровеносного сосуда с образованием гематом (2–36 % случаев), являющихся следствием постоянного присутствия в вене якорного устройства и тромболитической терапии, которая проводится более чем половине больных с временным КФ. Наличие гематомы, в свою очередь, является дополнительным риском развития другого ятрогенного события – инфекции
– отрыв и миграция КФ с током крови в правые отделы сердца, лёгочную артерию, почечные вены)
– перфорация полых органов и других образований (до 30 %)
– тромбоз КФ (2-10 %)
– тромбоз инфраренального отдела НПВ
– окклюзия нижней полой вены с развитием хронической венозной недостаточности нижних конечностей
– осложнения при извлечении КФ
В одном из исследований [4] анализировались возможные осложнения имплантации КФ у 11 пациентов в возрасте от 18-74 лет (средний возраст 42,25 лет) в разные сроки после имплантации КФ (от 2месяцев до 14 лет). Основным методом верификации осложнений являлась спиральная томография, по данным которой были выявлены следующие осложнения:
– облитерация инфраренального отдела НПВ (2) с максимальным диаметром до 4 мм, и резким расширением мезентериальных, поясничных и почечных вен
– фрагментация КФ (3) с облитерированным просветом НПВ (2) и выраженным стенозом в месте имплантации (1). При этом фрагменты КФ были обнаружены в полости правого желудочка, в правой ветви легочной артерии, в теле поясничного позвонка (L3) и стенке брюшной аорты
– признаки перфорации стенок НПВ (5) «усиками» КФ, которые располагались в боковой стенке брюшной аорты (2), в правой почечной артерии (2), в устье левой почечной вены (1)
– тромбоз НПВ (5), из них в одном случае до уровня почечных вен и в одном случае до верхней полой вены, подтвержденного интраоперационно
По данным ультразвуковых исследований, включая допплерографию, среди 483 пациентов с постоянными КФ, установленными в интервале от 6 месяцев до 5 лет, у 77 обследованных (16 %) выявлены следующие осложнения [5]:
– миграция КФ (4), в одном случае каудально, в трех – краниально, выше устья почечных вен, до входа в грудную полость
– различные перфорации (29), в том числе прободение задней стенки НПВ с явлениями корешкового синдрома (4), прободение передне-медиальной стенки с перфорацией аорты (1), прободение стенки тонкой кишки (24).
– тромбоз фильтра с явлениями синдрома НПВ (35). У 6 пациентов тромб распространялся краниальнее фильтра, сопровождаясь тромбозом устьев почечных вен (4), тромбозом соустья печеночных вен (1), миграции тромба в правое предсердие.
В качестве редкого осложнения имплантации КФ описан случай желудочно-кишечного кровотечения, обусловленного перфорацией 12-перстной кишки [6].
При анализе частоты и характера постимплантационных осложнений в сроки от 1 месяца до 10 лет после имплантации КФ у 266 больных [7] выявлялись ТЭЛА (5.2 %), тромбоз КФ (9,3 %), хроническая окклюзия НПВ (13,9 %), тотальная окклюзия НПВ с развитием синдрома НПВ с тромботическим поражением ниже уровня впадения почечных вен (24,1 %).
Фатальные осложнения имплантации КФ являются большой редкостью и не превышают 1 %. [8]. Основными причинами смертельных осложнений были перфорация правого желудочка сердца, пункция общей сонной артерии, остановка сердца, миграция КФ в правые отделы сердца и легочную артерию, сепсис, острая окклюзия НПВ с явлениями «малого притока».
Нам пришлось наблюдать больного с имплантацией временного КФ в НПВ, осложненной миграцией КФ в правое предсердие и ТЭЛА. Приводим клиническое наблюдение.
Больной С-ов., 52 лет, переведен в ОРИТ ГКБ им. С.С. Юдина 15.01.16 из ГКБ № , где находился с диагнозом правосторонний гнойный артрит коленного сустава, осложненным оклюзивным тромбозом вен нижней конечности. Показанием для имплантаии кава-фильтра, являлось наличие флотируещего тромба в просвете поверхностной бедренной вены с переходом на наружную подвздошную вену длиной 180 мм. 9.01.16 года произведена имплантация временного кава-фильтра. 14.01.16 года через 5 дней после имплантации КФ возникла выраженная одышка, боли за грудиной, сердцебиение. При УЗИ сердца был визуализирован КФ в правом предсердии, в связи с чем 14.01.16 предпринята попытка извлечения КФ эндоваскулярным путем, во время которой произошла перфорация стенки правого предсердия с развитием гемоперикарда.
Состояние больного при поступлении в ГКБ им.С.С.Юдина тяжелое. Медикаментозная седация. Положение пассивное. Кожные покровы обычного цвета, теплые, сухие. Подкожно-жировая клетчатка развита нормально. Периферических отеков нет. Температура тела 36,5 °С. Дыхание ровное ритмичное. Экскурсия грудной клетки равномерная. ЧД 22/мин. При аускультации дыхание жесткое, хрипов нет. Тоны сердца приглушены, ритмичные. ЧСС 130/мин. АД 130/80 мм. рт. т. Язык влажный, обложен белым налетом. Живот симметричный, не вздут, при пальпации мягкий, безболезненный. Перистальтические шумы ослаблены. Перитонеальных симптомов нет. Мочеиспускание по катетеру мочевого пузыря. Моча соломенного цвета.
Ан. крови при поступлении: Нв – 125 г/л., эритроциты – 4,01х1012/л., Гематокрит – 36,2; МСН 31,2 pg., лейкоциты – 17,5х109/л., П 8, С-76,Л-9,М-7. Тромбоциты – 221х109/л.
Биохимическое исследование крови при поступлении: белок общий – 59,4 г/л., альбумин 32,2 г/л., мочевина – 7,5 ммоль/л., креатинин 110 мкмоль/л., билирубин общий – 7,2 мкмоль/л., с-реактивный протеин – 84,5 мг/л., КФК – 206 ЕД/л., КФК МВ-фракция – 19 ЕД/л., альфа-амилаза 102 ЕД/л., АСТ-62 ЕД/л., АЛТ – 56 ЕД/л., щелочная фосфатаза – 166 ЕД/л., ЛДГ – 667.4 ЕД/л., тропонин – 1,85 нг/мл.
Общий ан. мочи при поступлении: Цвет – соломенный. Прозрачность неполная. Относительная плотность – 1022. рН мочи – 55. Белок – 0,42 %о. Реакция на кровь – положительная (+++). Эпителий плоский – 1–3 в п/зр. Лейкоциты – 1–3 в п/зр. Эритроциты неизмененные 1-3 в п/зр.
Коагулограмма. 15.01.16.: фибриноген – 5,90 г/л., АЧТВ – 33.1 сек., МНО-1.30. Протромбиновый индекс по Квику 60,3 %.
ЭХОКГ. 15.01.16: Визуализация резко снижена. Аорта не изменена. Форма раскрытия аортального клапана правильная. Размер раскрытия 1,9 см. Подвижность створок не ограничена. Клапан не изменен. Митральный клапан не изменен. Движение створок разнонаправленное. Трикуспидальный клапан не изменен. Клапан легочной артерии не визуализируется. В правом предсердии близко к устью нижней полой вены визуализируется гиперэхогенная структура (вероятнее всего, кава-фильтр), неподвижная с флотирующим гиперэхогенным образованием лентовидной формы длинной 10 мм на поверхности, обращенной в сторону трикуспидального клапана. Разделение листков перикарда не определяется. Заключение: легочная гипертензия. Миграция кава-фильтра в правое предсердие с фрагментом тромба?
УЗДГ вен нижних конечностей от 15.01.16. – имеется окклюзивный тромбоз суральных вен.
КТ органов грудной клетки от 15.01.16. В правом предсердии определяется инородное тело – раскрытый КФ (рис.1). Дренаж в полости перикарда. Центральный венозный катетер в правой внутренней яремной вене, периферический отдел в верхней полой вене. В S10 нижней доли правого легкого определяется субплевральная зона паренхиматозной инфильтрации с положительной воздушной бронхограммой. Зона уплотнения паренхимы по типу «матового стекла» в S3 левого легкого. Легочный рисунок не изменен. Трахея и крупные бронхи не деформированы. Органы средостения, магистральные сосуды и диафрагма обычно расположены, не деформированы. В полости перикарда жидкость толщиной до 6 мм. Жидкости в плевральных полостях не выявлено. Заключение: инородное тело правого предсердия (раскрытый КФ). КТ-признаки двусторонней инфарктной пневмонии. Малый гидроперикард.
КТ-ангиопульмонография с контрастированием. В области бифуркации легочного ствола определяется центральный тромб – «наездник», распространяющийся в долевые ветви обоих легочных артерий (рис. 2). Заключение: массивная ТЭЛА.
15.01.16. произведена операция удаления инородного тела (кава-фильтра) из полости правого предсердия, тромбэктомия из ветвей легочной артерии в условиях искусственного кровообращения и фармакохолодовой кардиоплегии. Операция. Срединная стернотомия, перикардотомия. В полости перикарда умеренное количество серозно-геморрагической жидкости, нити фибрина на поверхности сердца. При ревизии на крыше правого предсердия, отступя от места впадения верхней полой вены – дефект около 2 мм (перфорация кава-фильтром). В полости правого предсердия визуализируется инородное тело – кава-фильтр с тромботическими наложениями, который был удален. При ревизии выявлен дефект крыши правого предсердия, который ушит нитью пролен 3/0 со стороны полости предсердия. Из ствола легочной артерии и ее ветвей отсосом аспирированы тромботические массы размером до 30 см и диаметром до 2 см («свежие» и «застарелые»). Разрез легочной артерии ушит продольным швом проленом 4/0. Окончание ИК по стандартной методике. Раны зажили первичным натяжением. Швы сняты на 10 сутки. Однако, послеоперационное течение осложнилось развитием двусторонней пневмонии, разрешившейся на фоне антибактериальной терапии.
Данное наблюдение является иллюстрацией осложнений имплантации временного КФ – миграции фильтра в правое предсердие и ТЭЛА. Миграция КФ, определяется как смещение устройства более чем на 1 см в краниальном или каудальном направлении [9]. Из-за недостаточно надежной фиксации, упругости якорного устройства и движения пациента КФ изменяет свое положение в НПВ, попадая в любой участок венозного русла от бедренной вены до правых отделов сердца. По данным двух проспективных и двух ретроспективных исследований, включающих 1047 больных с имплантированным КФ, не было выявлено ни одного случая миграции [10, 11, 12, 13].
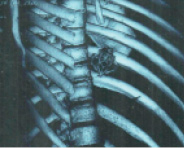
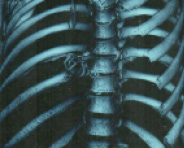
Рис. 1. 3D-реконструкция КТ с визуализацией кава-фильтра в правом предсердии
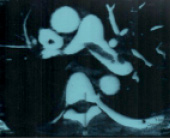
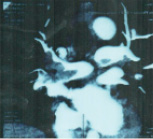
Рис. 2. КТ-ангиопульмонография. Тромб в стволе легочной артерии
Авторы ссылаются лишь на два опубликованных случая миграции КФ в полости сердца. Один больной умер от остановки сердца спустя три дня после имплантации, а на аутопсии КФ был обнаружен в области трикуспидального клапана [14]. У второго пациента через 7 дней после имплантации развилась одышка, гипотензия, спутанность. КФ был хирургически удален и больной выписан на антикоагулянтной терапии [15]. По другим данным, миграция КФ в правое предсердие встречается в 1,3 % случаев [16].
Имеются также сообщения о миграции КФ в правый желудочек, причем за последние 10 лет отмечен рост случаев миграции КФ в правый желудочек по сравнению с частотой миграции в правое предсердие с развитием желудочковых аритмий, смерти [17]. У 52-летнего больного через 8 месяцев после имплантации КФ возникла одышка, синкопальные состояния, почечная недостаточность. При обследовании был выявлена микграция КФ в правый желудочек. Попытка эндоваскулярного удаления КФ была неудачной, в связи с чем потребовалось хирургическое вмешательство с восстановлением структуры поврежденного трикуспидального клапана [18]. Еще одно сообщение миграции КФ в правый желудочек касается 69-летнего пациента с развитием у него желудочковой тахикардии, рефрактерной к антиаритмическим препаратам. После хирургического удаления КФ сердечный ритм восстановился. Авторы подчеркивают, что некупирующаяся желудочковая тахикардия у больных с наличием КФ требует исключения миграции КФ и проведения ЭХОКГ [19].
Несмотря на редкость миграция КФ в правые отделы сердца или легочную артерию, своевременная верификация данного осложнения имеет важное практическое значение в связи с угрозой фатальных нарушений. Симптоматика миграции КФ в полости сердца неспецифична и включает боль в груди, гипотензию, одышку, тахикардию, ЭКГ–нарушения (экстрасистолия, блокада правой ножки пучка Гиса, фибрилляция предсердий, асистолия), боли в шее, спутанность, потливость [20]. Oписаны случаи бессимптомного течения миграции КФ в правое предсердие и правую ветвь легочной артерии [21, 22].
Наше наблюдение представляет собой пример каскада ятрогенных событий, т.е. развитие у больного после врачебного вмешательства «другого качества» болезни, требующего нового врачебного вмешательства с потенциальным риском очередных осложнений. Так, у больного с нагноительным процессом в коленном суставе возникает тромбоз глубоких и поверхностных вен нижних конечностей – довольно типичное осложнение инфекций. С целью предупреждения развития у пациента ТЭЛА принимается решение об имплантации КФ – процедуры необходимой и обоснованной в данной ситуации, но вместе с тем чреватой риском целого ряда осложнений. Независимо от причины (техническая ошибка врача? особенности конструкции КФ?) у больного происходит дислокация КФ (потенциально запрограмированное), который с одной стороны перестает при этом блокировать продвижение венозных тромбов, а с другой – вследствие нарушения фиксации в вене может с током крови передвигаться в проксимальном направлении. В результате КФ оказывается в правом предсердии, а, кроме того, возникает тромбоэмболия в ствол легочной артерии. Возникшие осложнения требуют очередного врачебного вмешательства. При попытке удалить эндоваскулярно КФ возникает перфорация стенки правого предсердия, осложнившаяся гемоперикардом. В итоге клиническая ситуация требует проведения кардиохирургической операции с вытекающим отсюда потенциальным риском новых осложнений, которых однако удалось избежать. Попытки эндоваскулярного удаления КФ из правых отделов сердца не всегда оказываются успешными, в связи с чем требуется хирургическое вмешательство [18].
Другим осложнением у данного больного является ТЭЛА с наличием тромбоэмбола в области бифуркации легочной артерии. Данное осложнение следует расценивать как следствие дислокации КФ, который утрачивает способность улавливать тромбоэмболы. Фактически у данного больного возникло три ятрогенных события – миграция КФ в правое предсердие, ТЭЛА, перфорация стенки предсердия при попытке эндоваскулярного удаления КФ.
Таким образом, представленный больной является клинической иллюстрацией одного из видов ятрогении, которую мы предлагаем обозначать как имплантационную ятрогению. С учетом высокой распространенности и неуклонного роста имплантационных технологий в лечебной практике врачи должны быть ориентированы в отношении реальности постимплантационных осложнений у больных с наличием КФ, хотя и относительно редких, но потенциально опасных. В то же время при принятии решения об имплантации КФ необходимо учитывать риск развития осложнений, который не должен превышать пользу от подобных инвазивных вмешательств.
Библиографическая ссылка
Кандауров А.Э., Назарян К.Э., Акимов И.В., Тихонов А.В., Баяндин Н.Л., Дядьков И.H., Дворецкий Л.И. КЛИНИЧЕСКИЙ СЛУЧАЙ УСПЕШНОЙ ТРОМБЭКТОМИИ ИЗ ЛЕГОЧНОЙ АРТЕРИИ И УДАЛЕНИЯ МИГРИРОВАВШЕГО КАВА-ФИЛЬТРА ИЗ ПРАВОГО ПРЕДСЕРДИЯ // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-3. С. 557-562;URL: https://applied-research.ru/ru/article/view?id=9012 (дата обращения: 06.03.2026).

