В процессе дифференцировки на мембранах клеток системы иммунитета появляются макромолекулы-маркеры, соответствующие определенной стадии развития. Они получили название CD-антигенов (от английского-clustersofdifferentiation – кластер дифференцировки). В настоящее время их известно более 200.
CD68 (кластер дифференцировки 68, макросиалин) – гликопротеин из семейства LAMP (лизоцим ассоциированный мембранный протеин), относится к интегральным трансмембранным белкам, содержит 333 аминокислоты, экспрессируется на поверхности моноцитов и макрофагов и используется для выявления макрофагов в тканях крыс и мышей [6, 7, 8].
CD68 играет роль в фагоцитарной активности тканевых макрофагов как во внутриклеточном лизосомальном метаболизме, так и во внеклеточных взаимодействиях клетка-клетка и клетка-патоген. Связывается с лектинами и селектинами, что позволяет макрофагу заякориваться в определенном участке ткани. Способен быстро рециркулировать между эндосомами и лизосомами, благодаря чему макрофаг передвигается по селектин-содержащей субстратной поверхности или по поверхности других клеток.
Экспрессируется CD68 преимущественно на мембране поздних эндосом [6]. Считается, что наличие у данного маркера ферментной активности препятствует повреждению мембран лизосомальными энзимами вследствие их деградации [7]. Кроме того, показано, что данная молекула процессирует антиген путем постепенного ферментативного расщепления фагоцитируемых клеткой объектов [8]. После процессинга макрофаги презентируют антиген Т-лимфоцитам. Если при этом состоятся все необходимые и достаточные корецепторные взаимодействия с антигенпрезентирующей клеткой, то Т-лимфоцит получит активационный сигнал, и с этого момента начнется собственно антиген-зависимый иммунный ответ [9].
Исследование воздействия фармакологических препаратов «Галавита» и «Т-активина» на популяцию антигенпрезентирующих клеток, способных к экзогенной презентации антигена, представляется нам весьма актуальной. С этой целью нами изучалась экспрессия молекул CD68 в тканях тимуса и селезенки при введении иммунномодуляторов «Галавита» и «Т-активина». Препарат Галавит – современный иммуномодулятор, который мобилизует на борьбу с возбудителями инфекций все звенья иммунной системы. Основное действующее вещество препарата Галавит – аминодигидрофталазиндион натрия. Лекарственное средство производится отечественной компанией ООО «Сэлвим», имеющей свое собственное фармацевтическое производство в городе Белгород. Т-активин – полипептидный препарат, получаемый из тимуса крупного рогатого скота и обладающий иммуностимулирующим действием. При иммунодефицитных состояниях препарат нормализует количественные и функциональные показатели иммунитета, стимулирует продукцию лимфокинов, восстанавливает активность Т-киллеров, функциональную активность стволовых гемопоэтических клеток, активирует макрофагальную систему. В медицинской практике используется в виде прозрачного бесцветного раствора. Лекарственное средство производится отечественной компанией «Биомед имени Мечникова» в России.
Объектом исследования служили селезенка и тимус 120 мышей-самцов массой 22–24 г в возрасте 6–7 недель. Животные были разделены на 4 групп: первая – интактные животные (n = 30); вторая группа – контрольная, включала 30 животных, которым внутримышечно вводили физиологический раствор в дозе 0,2 мг/животное один раз в день в течение 1, 3, 7, 14 суток; третья группа – опытные животные (n = 30) с внутримышечным введением «Т-активина» по 0,2 мг на животное один раз в день в течение 1, 3, 7, 14 суток; четвертая группа – опытные животные (n = 30) с внутримышечным введением «Галавита» по 0,2 мг на животное один раз в день в течение 1, 3, 7, 14 суток. Введение препаратов проводилось с соблюдением правил асептики и антисептики. Все действия, предусматривающие контакты с экспериментальными животными, проводились согласно «Правилам проведения работ с использованием экспериментальных животных» (приказ МЗ РФ от 19.06.2003 г. № 267), требованиям «Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целях» (Страсбург, 1986) и принципы Хельсинской декларации о гуманном отношении к животным. Выведение животных из эксперимента проводилось путем декапитации. Селезенку и тимус животных фиксировали 10 % нейтральным формалином, обезвоживали и заливали в парафин по стандартной методике. Парафиновые срезы обрабатывались иммуногистохимическим методом для выявления CD68+ клеток с использованием anti-CD-68 мышиных моноклональных антител [3]. Срезы толщиной 5 мкм готовились в ротаторном микротоме МПС-2 и после депарафинирования и регидратации в этаноле нисходящей концентрации срезы органов погружали в восстанавливающий цитратный буфер (pH = 6,0). Затем проводили высокотемпературную обработку прогреванием на водяной бане при 90–95 °С в течение 30 минут с целью демаскировки искомых антигенов в тканях. После ингибирования эндогенной пероксидазы 3 % раствором перикиси водорода на метаноле проводили иммуногистохимическую реакцию методом трехэтапного непрямого иммуноферментного анализа с использованием первичных моноклональных антител (МКАТ) к антигенному маркеру CD68 (CloneKP1) в разведении 1:50 согласно рекомендации фирмы изготовителя (Dako, Дания). Визуализацию связавшихся первичных МКАТ проводили стандартными биотин-стрептавидин-пероксидазным методом с использованием набора LSAB-2 (Labeled Streptavidin Biotin System Peroxidase) [4]. Для оценки специфичности иммунного окрашивания в каждом случае делали отрицательный контроль (обработка вместо первичных моноклональных антител контрольными антителами), результатом чего было отсутствие специфического иммунного окрашивания. Морфометрический анализ включал измерение размеров CD68 позитивных клеточных структур (при увеличении объектива 10, 40, 90 и окуляр 15) под световым микроскопом МИКМЕД-5 с винтовым окулярным микрометром МОВ-1. Расчет площадей клеток проводился с использованием компьютерной программы «SigmaScanPro 5.0». О количественном распределении клеток судили по подсчету их в 10 полях зрения при увеличении объектива 40 и окуляра 15. Статистическая обработка полученных цифровых данных проводилась с помощью программы MicrosoftOfficeExcel с учетом критерия Стьюдента.
В ходе исследований в тимусе и селезенке нами были выявлены 2 группы CD68+ клеток с двумя субпопуляциями внутри каждой из них. Первую группу составляют крупные, а вторую – мелкие клетки. Как среди крупных, так и среди мелких выявлены субпопуляции ярких и бледных по окраске клеток. Выявленные у исследуемых животных СD68+ клетки были подразделены на 4 морфологические группы: 1 – крупные яркие (I тип); 2 – крупные бледные (II тип); 3 – мелкие яркие (III тип); 4 – мелкие бледные (IV тип). Площадь крупных клеток в тимусе колеблется от 83,65–318,95 мкм2, а площадь мелких – от 16,65 до 83,65 мкм2. В селезенке площадь крупных клеток находится в пределах от 61,43 до 215,28 мкм2, мелких – 19,35–61,43 мкм2. Попытка сделать подобную классификацию СD68+ клеток была продиктована их возможностью относиться либо к макрофагам, либо к моноцитам, в зависимости от размеров.
На 7-е и 14-е сутки после введения иммуномодулятора Галавита обнаружено резкое увеличение количества CD68-позитивных клеток в красной пульпе селезенки (в контроле – 38,8 шт., в опыте – 55,4 шт. в десяти полях зрения). На всех остальных сроках введения Галавита значимых изменений количества вышеупомянутых исследуемых клеток не наблюдается. В белой пульпе CD68+ клетки на введение Галавита реагируют обратно пропорционально по отношению к красной пульпе. При этом увеличение количества исследуемых клеток в белой пульпе наблюдается на 1-е (16,4 шт.) и 14-е (9,6 шт.) сутки эксперимента.
Характеристика численности выделенных нами четырех типов CD68+ клеток показала, что чаще всего выявляются мелкие клетки, относящиеся к III и IV типам. Их резкое увеличение фиксируется на 7-е сутки эксперимента. Крупные как яркие, так и бледные CD68+ клетки, то есть клетки I и II типов выявляются в морфофункциональных зонах селезенки в гораздо меньших количествах, чем клетки III и IV типов. Число крупных и мелких СD68+ клеток в тканях селезенки на всех сроках эксперимента меняется обратно пропорционально (рис. 1).
В ответ на введение Т-активина более значимые изменения количества CD68+ клеток также замечены в красной пульпе селезенки. По сравнению с контролем их число к суточному сроку эксперимента снижается в 1,5 раза (в контроле – 38,8 шт., в опыте – 26,2 шт.), на 14-е сутки – повышается в 1,2 раза (в контроле – 38,8 шт., в опыте – 48,2 шт. в среднем в десяти полях зрения). Для маргинального синуса и белой пульпы селезенки характерны практически одинаковые колебания численности CD68+ клеток. При этом наибольшее количество CD68+ клеток регистрируется на 7-е сутки введения Т-активина, что в 1,2 раза превышает контрольные значения (в контроле – 9,2 шт., в опыте – 11,2 шт. в среднем в десяти полях зрения).
При введении Т-активина в морфо-функцииоональных зонах селезенки в основном преобладают мелкие бледные CD68+ клетки, принадлежащие IV-й субпопуляции. Различия в колебании численности этих клеток более значимы на 7-е сутки эксперимента. В целом на начальных сроках эксперимента (с 1 по 7 сутки) количество как мелких, так и крупных клеток увеличивается, но на 14 сутки мелких клеток становится почти столько же, что и при контроле, в то время как число крупных клеток становитсяв 1,5 раза выше контрольных значений (в контроле – 11,4 шт., в опыте – 17,6 шт. в среднем в десяти полях зрения) (рис. 2).
В тимусе при введении Галавита резкие изменения количества CD68+ клеток наблюдаются на 7-е сутки эксперимента. При этом в корковом веществе и на границе коркового и мозгового вещества долек количество исследуемых клеток меняется обратно пропорционально. К 7-ым суткам эксперимента наиболее часто обнаруживаются клетки IV типа (мелкие, бледные) и реже III типа (мелкие, яркие) с последующим снижением их численности на 14-е сутки введения Галавита.
При введении Т-активина значительные изменения количества CD68+ клеток наблюдаются в корковом веществе и на границе коркового и мозгового вещества долек тимуса. Их количество стабильно на всех сроках эксперимента, за исключением 14 суток, где наблюдается рост численности исследуемых клеток в корковом веществе в 4,6 раза (в контроле – 5,4 шт., в опыте – 24,8 шт.), кортикомедуллярной зоне в 3,5 раза (в контроле – 4 шт., в опыте – 14,2 шт. в среднем в десяти полях зрения). При анализе количественного соотношения выделенных морфологических групп CD68+ клеток тканей тимуса выявляются их однонаправленные реакции на разные сроки введения Т-активина. По сравнению с контролем на 1-е и 7-е сутки действия Т-активина количество всех типов клеток уменьшается, а на 3-и и 14-е сутки – увеличивается. Более выраженные изменения происходят клетками IV типа на 14 сутки эксперимента. Их становится в 3,7 раза больше по сравнению с контролем (в контроле – 6,4 шт., в опыте – 24 шт. в среднем в десяти полях зрения).
В селезенке CD68+ клетки чаще выявляются в красной пульпе. При этом большая часть этих клеток приходится на III и IV типы. Предположительно клетки этих типов относятся к моноцитарно-макрофагальным клеткам, так как именно в красной пульпе селезенки, представляющей собой ретикулярную ткань богатую элементами крови, чаще выявляются моноциты крови.
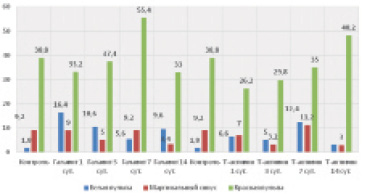
Рис. 1. Общее количество СD68-позитивных клеток в морфо-функциональныхзонах селезенки в разные сроки введения физиологического раствора, Галавита и Т-активина
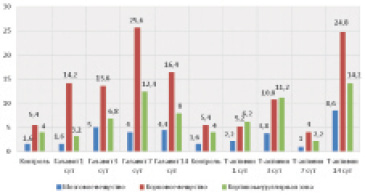
Рис. 2. Общее количество СD68-позитивных клеток в морфо-функциональныхзонах долек тимуса в разные сроки введения физиологического раствора, Галавита и Т-активина
В белой пульпе степень выявляемости всех морфологических групп CD68+ клеток относительно низкая.
Крупные клетки, возможно, принадлежат к внутрифолликулярным дендритным макрофагам, образующимся из моноцитов и участвующих в презентации антигенов в селезенке.
Как в красной, так и в белой пульпе селезенки, макрофагов гораздо меньше по сравнению с моноцитами, что подтверждается результатами наших исследований.
В тимусе CD68+ клеток больше в корковом веществе и при этом преобладают клетки III и IV типов, идентифицирующиеся как моноциты. Крупные клетки I и II типов, соответствующие макрофагам, в корковом веществе долек тимуса обнаруживаются редко, что соответствует литературным данным [1].
В мозговом веществе тимуса наиболее часто выявляются CD68+ клетки III и IV типов.
Результаты наших исследований позволяют нам сделать следующие выводы:
1) введение иммуномодуляторов Галавита и Т-активина приводит к увеличению количества CD68+ клеток в красной пульпе селезенки и корковом веществе долек тимуса;
2) количество CD68+ клеток, как в тимусе, так и в селезенке резко увеличивается на 7 сутки введения как Галавита, так и Т-активина;
3) более высокая степень выявляемости CD68+ проявляется в морфо-функциональных зонах селезенки по сравнению с тимусом;
4) как в тканях селезенки, так и в тканях долек тимуса наиболее часто выявляемыми являются CD68+ клетки мелкие, яркие (III типа) и мелкие, бледные (IV типа);
5) при введении Галавита наиболее значимые повышения количества CD68+ клеток происходят на 7-е сутки, а при введении Т-активина – на 14-е сутки;
6) для иммуностимуляции более оптимальными сроками введения Галавита являются 7-е, а для Т-активина – 14-е сутки.
Библиографическая ссылка
Ястребова С.А., Илларионова С.В., Зайцева Н.А., Сергеева В.Е. РЕАКЦИЯ CD68 ПОЗИТИВНЫХ КЛЕТОК СЕЛЕЗЕНКИ И ТИМУСА НА ВВЕДЕНИЕ ИММУНОМОДУЛЯТОРОВ // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-3. С. 589-593;URL: https://applied-research.ru/ru/article/view?id=9020 (дата обращения: 02.02.2026).

