Спектроскопия гигантского комбинационного рассеяния (ГКР, SERS) может быть использована для изучения структуры биомолекул [3]. Наиболее ценную информацию можно было бы получить из спектров биомолекул, находящихся в своём природном окружении, но биологические жидкости обычно обладают высокой ионной силой, приводящей к дестабилизации наночастиц, вводимых в образцы с целью усиления сигнала в спектре ГКР. Поэтому спектры часто снимают в разбавленных буферных растворах [3, 4] или высушивают растворы белков на островковых плёнках и получают спектры сухих образцов [8]. Таким образом, необходимо развитие методик синтеза наночастиц серебра и золота, обладающих повышенной устойчивостью.
Цель исследования
Получение наночастиц золота, обладающих повышенной устойчивостью в 0,9 % NaCl, и демонстрация применения полученных наночастиц в спектроскопии гигантского комбинационного рассеяния белков в растворе (на примере гемоглобина).
Материалы и методы исследования
Подготовка поверхности стекла. Образцы стекла погружали в смесь концентрированной соляной кислоты и 30 % пероксида водорода. После окончания реакции и остывания раствора до комнатной температуры образцы промывали водой и сушили в потоке азота. Образцы хранили в герметично закрытой таре.
Получение наночастиц золота методом Френса [6]. К 50 мл кипящего 0,01 % раствора HAuCl4 добавляли 750 мкл 1 % цитрата натрия. В течение минуты появлялась красная окраска. Затем раствору давали остыть до комнатной температуры, не снимая с нагревателя.
Концентрирование наночастиц. Полученным раствором заполняли 8 пластиковых пробирок объёмом 1,5 мл и центрифугировали на центрифуге Eppendorf 5810R с ротором FA-45-30-11 в течение 20 мин при 3000 об/мин. Осадок ресуспендировали в новой порции раствора наночастиц, затем 4 пробирки полученного раствора центрифугировали и ресуспендировали в растворе, взятом из оставшихся 4 пробирок. Две пробирки полученного раствора центрифугировали и ресуспендировали осадок в растворе, полученном из 2 оставшихся пробирок. После каждого центрифугирования супернатант отбрасывали.
Получение наночастиц золота с использованием ПЭГ-1000. Раствор, содержащий 83 мл воды, 7 мл раствора ПЭГ-1000 с концентрацией 622,4 мг/мл и 104 мкл раствора KOH с концентрацией 121,9 мг/мл, довели до кипения и постепенно добавили 12 мкл 0,1 % HAuCl4. Вскоре раствор приобрёл синюю окраску, после чего нагревание сразу прекратили. Затем цвет раствора быстро сменился на винно-красный. Раствор сняли с нагревателя и дали остыть при комнатной температуре.
Проведение автометаллографии. К 200 мкл полученного раствора наночастиц добавили 250 мкл 0,1 % HAuCl4 и 200 мкл 30 % H2O2. Раствор перемешивали в течение 30 мин. При проведении автометаллографии в присутствии соли к раствору до начала перемешивания дополнительно добавили 200 мкл 622,4 мг/мл ПЭГ-1000 и 750 мкл 0,9 % NaCl. Раствор перемешивали в течение 15 мин.
Ресуспендирование осадков и перемешивание растворов проводили с использованием вортекса TMI-100H (E-Chrom Tech Co., Ltd., Сингапур) путём орбитального перемешивания на скорости 2000 об/мин в течение 5 мин при комнатной температуре.
Спектры поглощения получали в кварцевых кюветах на спектрофотометре USB2000+ (OceanOptics, США) с источником света DH-2000. Использовалась только галогеновая лампа (300 – 1500 нм). Обработку спектров проводили в программе GRAMS Research 3.01A Level II.
Спектры ГКР получали на многоцелевом приборе WITec alpha 300 R (WITec GmbH, Германия) с 20-кратным объективом и лазером с длиной волны 532 нм. После каждого включения прибора снимали спектр комбинационного рассеяния кремния с временем накопления 0,05 с и выбирали такую мощность лазера, чтобы интенсивность сигнала в области 900 см‾¹ превышала 450 условных единиц. Непосредственно перед получением спектров гемоглобина раствор человеческого гемоглобина (3,55·10‾4 M, содержащий 0,9 % NaCl) смешивали с раствором наночастиц и наносили 30 мкл полученной смеси на подготовленную поверхность стекла или свежесколотую поверхность слюды (мусковита). Время накопления составляло 10 с. При появлении признаков высыхания капли образец не использовали. Обработка спектров производилась в программе WITec Project 2.10, входящей в комплект поставки прибора.
Результаты исследования и их обсуждение
Широкое распространение метода Френса для синтеза наночастиц золота обусловлено его двумя основными достоинствами: простотой (не требуется следить за ходом реакции; предсказуемость размеров получаемых наночастиц [1]) и стабилизацией получаемых наночастиц (на их поверхности присутствуют цитрат-ионы, придающие наночастицам отрицательный заряд и таким образом препятствующие агрегации). В связи с этим представлялось целесообразным проверить применимость полученных методом Френса наночастиц золота для получения спектров ГКР при высокой ионной силе. С этой целью были получен раствор наночастиц с оптической плотностью в максимуме поглощения (534 нм) 1,41. Диаметр наночастиц, определённый из коэффициента экстинкции по калибровочной формуле [2], составил 43 нм.
Для определения устойчивости полученных наночастиц производилось их центрифугирование в течение 10 мин со скоростью 14000 об/мин с последующим ресуспендированием в воду, 50 мM NH4HCO3, 0,2 M боратный буферный раствор, 1 % цитрат натрия, 1 M калий-фосфатный буферный раствор и 25 мM трис-буфер. Только в случае ресуспендирования в воду раствор имел красную окраску, а в его спектре поглощения присутствовал характеристический максимум при 534 нм. В остальных случаях растворы оказывались бесцветными, и максимумы в их спектрах поглощения отсутствовали. Таким образом, полученные наночастицы оказались нестабильными во всех проверенных буферных растворах. Интенсивность максимумов в спектрах комбинационного рассеяния гемоглобина, смешанного с полученным раствором наночастиц в соотношении 1:3, оказалась ниже, чем у исходного раствора гемоглобина (содержащего 0,9 % NaCl), т.к. наночастицы сразу выпадали в осадок, и фактически происходило простое разбавление раствора гемоглобина. Однако в спектре ГКР раствора гемоглобина, нанесённого на островковую плёнку, полученную высушиванием 50 мкл концентрированного раствора полученных наночастиц, некоторые полосы проявляются более чётко и даже присутствует новый максимум (рис. 1). Данные признаки подтверждают наличие эффекта ГКР [1]. Предварительная обработка поверхности стекла меркаптоэтанолом, призванная сделать связывание образующих островковую плёнку наночастиц с поверхностью стекла более прочным, приводит к обратному эффекту: наблюдается лишь незначительное усиление сигналов. Это связано с тем, что раствор наночастиц при нанесении на обработанную меркаптоэтанолом стеклянную поверхность растекается по значительно большей площади, чем при использовании необработанной поверхности, что приводит к изменению параметров образующейся островковой плёнки. При использовании для создания островковой плёнки наночастиц, сконцентрированных по другой методике (6 центрифугирований и последующих ресуспендирований в новых порциях исходного раствора), эффект ГКР также не наблюдается.
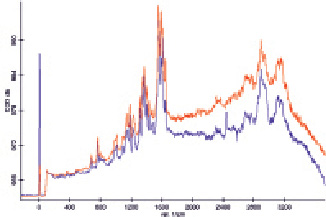
Рис. 1. Спектры ГКР раствора гемоглобина, нанесённого на необработанную поверхность стекла (красный) и на островковую плёнку (синий)
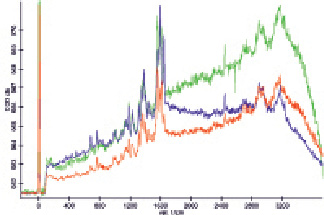
Рис. 2. Спектры ГКР раствора гемоглобина, не содержащего наночастиц (красный) и смешанного с модифицированными ПЭГ-1000 наночастицами золота в соотношении 1:3. Для модификации взят исходный раствор наночастиц (синий спектр) и концентрированный раствор наночастиц (зелёный спектр)
С целью повышения устойчивости используемых наночастиц была проведена модификация их поверхности меркаптоэтанолом или ПЭГ путём центрифугирования с последующим ресуспендированием в 670 мг/мл ПЭГ-1000. Однако в случае использования меркаптоэтанола интенсивность максимумов в спектрах комбинационного рассеяния гемоглобина уменьшалась, как и в случае использования немодифицированных наночастиц, т.е. модификация меркаптоэтанолом не давала требуемой стабильности. При использовании ПЭГ усиление сигналов в спектре ГКР наблюдается, а также изменяется соотношение интенсивности максимумов (рис. 2). Для проявления эффекта необходимо предварительное отделение наночастиц от избытка ПЭГ путём центрифугирования с последующим ресуспендированием в воде, т.к. в присутствии несвязанного ПЭГ раствор становится очень вязким, что сильно затрудняет диффузию молекул гемоглобина. Качество спектров ГКР, полученных с использованием такого раствора, оказывается даже более низким, чем в случае обычных спектров комбинационного рассеяния того же образца гемоглобина. Если же после отделения от полученных наночастиц избытка ПЭГ ресуспендировать их непосредственно в раствор гемоглобина, эффект ГКР наблюдается, но коэффициент усиления оказывается ниже.
Существует возможность упрощения методики, связанная с восстановительными свойствами ПЭГ [9, 10]. Однако при воспроизведении этой методики с использованием ПЭГ-1000 наблюдалось осаждение полученных наночастиц вследствие их быстрого роста. При опускании стадии 5-минутного кипячения скорость автометаллографии падает, что позволило получить устойчивый раствор наночастиц с оптической плотностью в максимуме поглощения (524 нм) 1,16. Диаметр наночастиц, определённый из коэффициента экстинкции по калибровочной формуле [2], составил 21 нм. Полученный раствор наночастиц пенится при встряхивании, что свидетельствует об образовании побочного продукта, обладающего свойствами ПАВ и играющего роль дополнительного стабилизатора наночастиц. Возможно выделение наночастиц из полученного раствора с помощью центрифугирования со скоростью 9000 об/мин в течение 20 мин, при этом супернатант приобретает слабую синюю окраску. Однако полученные наночастицы не обладают способностью усиления сигнала в спектре ГКР вследствие малого диаметра, так как оптимальный диаметр для проявления эффекта ГКР составляет, по разным данным, около 50 нм [7] или 120 – 135 нм [5].
С целью увеличения диаметра наночастиц была проведена автометаллография, что позволило достичь усиления сигналов в спектре ГКР (рис. 3), хотя при смешивании растворов гемоглобина и наночастиц наблюдалось выделение газа вследствие псевдокаталазной активности гемоглобина, т.е. раствор наночастиц содержал остаточное количество пероксида водорода. Проведение автометаллографии в присутствии ПЭГ и хлорида натрия позволяет проводить направленную эволюцию наночастиц, так как наночастицы, не обладающие устойчивостью в данной среде, осаждаются, и в растворе растут только устойчивые зародыши. В то же время оказалось, что полученные таким образом наночастицы приводят к существенному увеличению фона, что потребовало уменьшения продолжительности автометаллографии до 15 мин, что позволило наблюдать усиление сигнала в спектре ГКР (рис. 4).
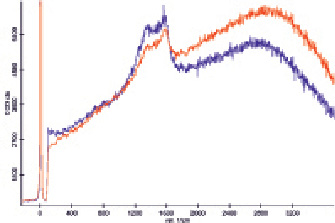
Рис. 3. Спектры комбинационного рассеяния раствора гемоглобина, не содержащего наночастиц (красный) и смешанного с раствором подвергшихся автометаллографии наночастиц золота в соотношении 1:1 (синий), полученные при малой мощности лазера (интенсивность сигнала кремния в области 900 см‾¹ составляет около 150 условных единиц)
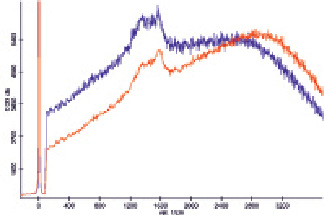
Рис. 4. Спектры комбинационного рассеяния раствора гемоглобина, не содержащего наночастиц (красный) и смеси растворов гемоглобина и подвергшихся автометаллографии в присутствии хлорида натрия наночастиц золота в соотношении 1:1 (синий), полученные при малой мощности лазера
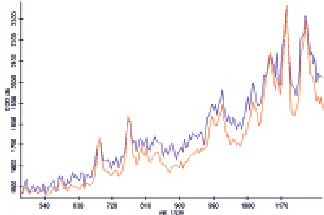
Рис. 5. Спектры комбинационного рассеяния раствора гемоглобина, не содержащего наночастиц (красный) и смеси раствора гемоглобина и подвергшегося длительному кипячению раствора наночастиц золота в соотношении 1:1 (синий)
Другим возможным вариантом увеличения размеров полученных наночастиц является длительное кипячение раствора без использования обратного холодильника и без добавления каких-либо дополнительных реагентов. В этом случае происходит концентрирование раствора, сопровождающееся автометаллографией за счёт присутствия непрореагировавшего ПЭГ. Окраска раствора при этом изменяется с винно-красной на синюю, но положение максимума в спектре поглощения сместилось только до 525 нм, что соответствует размеру наночастиц 22,4 нм [2]. Таким образом, изменение окраски раствора вызвано не увеличением размера наночастиц, а их агрегацией под действием повысившейся ионной силы, вызванной наличием щёлочи. Спектры ГКР показали, что полученные наночастицы не дают увеличения интенсивности сигналов, но появляются дополнительные сигналы (рис. 5). При центрифугировании подвергшегося кипячению раствора наночастиц со скоростью 4000 об/мин в течение 20 мин стенки пробирки окрашиваются в синий цвет, т.е. образуется островковая плёнка, но ресуспендировать её не удаётся. Наночастицы можно частично выделить путём центрифугирования со скоростью 3000 об/мин в течение 20 мин, однако большая часть наночастиц остаётся в супернатанте, а ресуспендирование осадка непосредственно в раствор гемоглобина приводит к настолько существенному увеличению фона, что спектр ГКР зарегистрировать не удаётся. Спектр ГКР гемоглобина, смешанного в соотношении 1:1 с полученным супернатантом, близок к спектру, полученному с использованием раствора, не подвергавшегося центрифугированию, приведённому на рис. 5. Частичное выделение наночастиц из супернатанта возможно путём центрифугирования со скоростью 14000 об/мин в течение 2 мин.
Заключение
Осуществлён синтез наночастиц золота, обладающих повышенной устойчивостью в растворе с физиологической концентрацией хлорида натрия. Получены спектры ГКР гемоглобина в растворе в присутствии синтезированных наночастиц и островковой плёнки, полученной из них. Показано, что по сравнению со спектрами комбинационного рассеяния в спектрах ГКР происходит усиление интенсивности сигналов и изменение соотношения их интенсивностей. Полученные результаты позволяют считать целесообразными дальнейшие работы по синтезу наночастиц золота с иммобилизованными незаряженными полимерами. Такая модификация поверхности придаёт наночастицам повышенную устойчивость, предотвращает связывание исследуемых биомолекул с наночастицами, гарантируя таким образом сохранение нативной конформации биомолекул, и практически не вносит новых сигналов в спектр. Особый интерес представляют биосовместимые полимеры, такие как ПЭГ. Продемонстрирована возможность использования полимера, обладающего требуемыми свойствами, в качестве восстановителя при синтезе наночастиц, что приводит к существенному упрощению методики.
Библиографическая ссылка
Пестовский Ю.С. УВЕЛИЧЕНИЕ СТАБИЛЬНОСТИ НАНОЧАСТИЦ ЗОЛОТА ДЛЯ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ БЕЛКОВ В РАСТВОРЕ // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-6. С. 1077-1082;URL: https://applied-research.ru/ru/article/view?id=9136 (дата обращения: 23.01.2026).

