Играя важную роль в развитии врожденных механизмов иммунного ответа, в частности, в неспецифической защите организма от разнообразных инфекционных агентов, IL-1/TOLL-сигнальный путь обеспечивает рецепцию потенциально патогенных для организма компонентов с последующим запуском саногенетического ответа [5, 10, 15]. Проводя сигналы от паттерн-распознающих рецепторов, в частности, толл-подобных рецепторов – TLR, распознающих различные по своей химической природе паттерны патогенности, IL-1/TOLL-сигнальный путь обеспечивает активацию механизмов врожденного иммунного ответа, в частности, инициацию ответа острой фазы [5, 15, 19]. Кроме того, данный сигнальный путь играет определяющую роль в реактивности клеток цельной крови в отношении цитокинов семейства интерлейкина-1 (ИЛ-1, ИЛ-18, ИЛ-33) [5].
Ключевыми компонентами рассматриваемого молекулярного каскада являются адапторные протеины, непосредственно связанные с соответствующими рецепторами, из семейства ИЛ-1 и TLR. В частности, такими протеинами являются MyD88, TIRAP, TRAM, а так же ряд других молекул [15, 19]. Основную роль в передаче сигнала с рецептора внутрь клетки играют MyD88/TIRAP, обеспечивающие непосредственную активацию внутриклеточных молекулярных каскадов, приводящую в итоге к активации транскрипционного фактора NF-κB [16, 17, 19]. В месте с тем, противовирусный ответ обеспечивается за счет функционирования адапторного протеина TRAM, способного активировать интерферон-регулируемые транскрипционные факторы, в частности, IRF3 и IRF7, запуская продукцию клетками интерферонов (ИФН) I типа [5, 16].
В реализации механизмов активации клеточной реактивности на компоненты инфекционных агентов, а так же цитокины большое значение играют молекулы, активируемые адапторными протеинами, способные непосредственно активировать эффекторные внутриклеточные механизмы. Такими факторами, в рассматриваемом сигнальном пути, в частности, являются протеинкиназы IRAK1, IRAK4, TRAF3 [16, 17].
Активность процессов саногенеза, в частности, благоприятный исход острой инфекционной патологии находится в зависимости от состояния IL-1/TOLL-сигнального пути, обеспечивающего проведение информационного сигнала цитокинов, компонентов патогенов до исполнительного аппарата клетки, активирующих ответ острой фазы [5, 17].
При этом воздействие на организм достаточно мощных стрессоров, в частности, компонентов патогенных микроорганизмов и вирусов, зачастую приводит к дизрегуляции внутриклеточных молекулярных механизмов саногенеза, что определяет необходимость поиска новых факторов, способных стимулировать восстановление нормальных межмолекулярных взаимодействий [4, 6, 10, 14]. Одним из таких факторов является низкоинтенсивное электромагнитное излучение (ЭМИ) крайневысокочастотного и сверхвысокочастотного диапазона [1, 2, 13, 14]. В частности, ЭМИ частотой 1 ГГц (микроволновый диапазон частот) проявляет выраженную биотропную активность, способствуя нормализации иммуноэндокринных взаимосвязей при острой воспалительной патологии органов дыхания, а так же метаболических изменений у пациентов с патологией сердечно-сосудистой системы [3, 7, 13].
Учитывая высокую актуальность поиска новых факторов регуляции внутриклеточных процессов, целью настоящего исследования являлось оценка содержания в мононуклеарных лейкоцитах практически здоровых лиц, а так же пациентов перенесших острый инфекционно-воспалительный процесс нижних отделов респираторного тракта (внебольничную пневмонию), молекул MyD88, TIRAP, TRAM, IRAK1, IRAK4, TRAF3, TAB1 на фоне облучения цельной крови низкоинтенсивными микроволнами частотой 1 ГГц.
Материалы и методы исследования
В соответствии с целью настоящей работы были обследованы 30 пациентов мужского пола с бактериальной внебольничной пневмонией нетяжелого течения на 15–17-е сутки заболевания в возрасте от 20 до 35 лет, составившие основную группу. Контрольную группу составили 15 практически здоровых молодых человек из числа доноров крови в возрасте от 20 до 33 лет. Материалом для исследования служила венозная кровь, забиравшаяся в утренние часы (с 7:00 до 7:30) из локтевой вены.
При работе с образцами использовали наборы для культивирования и митогенной стимуляции клеток цельной крови «Цитокин-Стимул-Бест» (ЗАО «Вектор Бест», г. Новосибирск). В ходе проведения исследования 1 мл цельной крови в стерильных условиях вносили во флакон, содержащий 4 мл поддерживающей среды (DMEM), гепарин (2,5 ЕД/мл), гентамицин (100 мкг/мл) и L-глютамин (0,6 мг/мл), после чего флаконы помещали в термостат (37 °С). Спустя 24 часа на градиенте плотности фиколл-верографина (ρ = 1,077) выделяли МНК с последующим приготовлением лизатов по рекомендованной производителем тест-систем для иммуноферментного анализа (ИФА) методике. Для приготовления лизатов МНК использовали 1 мл клеточной суспензии, содержащей 5×106 клеток. Подсчет клеток и анализ их жизнеспособности производили с использованием автоматического счетчика клеток TC20 (Biorad, США).
Облучение образцов крови проводили с помощью генератора сигналов HP8664A с использованием излучающей антенны магнитного типа в дальней зоне облучателя, непосредственно перед их помещением в термостат [6, 12, 13].
В клеточных лизатах МНК методом ИФА оценивали содержание молекул, в частности, адапторных протеинов MyD88, TIRAP, TRAM, ассоциированных с рецепторами киназ – IRAK1, IRAK4, TRAF3, а так же протеинкиназы TAB1 (MAP3K7IP1).
При проведении ИФА использовали наборы реактивов CUSABIO BIOTECH (Китай). Анализ проводили на анализаторе Personal LAB (Adaltis Italia S.p.A., Италия).
Статистическую обработку проводили с помощью программы Statistica 7.0. Результаты исследования представлены в виде: среднее значение признака (x) ± выборочное стандартное отклонение (s) Статистическую значимость (р) межгрупповых различий в несвязанных выборках оценивали с помощью Критерия Колмогорова-Смирнова, в связанных – с использованием критерия знаков.
Результаты исследования и их обсуждение
Содержание в МНК компонентов IL-1/TOLL сигнального пути у практически здоровых лиц и реконвалесцентов ВП, а так же оценка статистической значимости выявленных межгрупповых различий, представлены в табл. 1.
Результаты исследования содержания в агранулоцитах обследованных лиц компонентов IL-1/TLR сигнального пути выявил статистически значимое снижение внутриклеточного уровня адапторных протеинов TIRAP на 36,0 %, киназ IRAK1 на 31,5 %, TRAF3 на 43,5 %. Так же у реконвалесцентов ВП отмечена тенденция к снижению уровня адапторного белка MyD88 на 7,9 %, а IRAK4 на 4,8 %. Вместе с тем, в МНК основной группы отмечено статистически значимое повышение уровня TAB1 на 44,4 %, а так же тенденция к повышению уровня TRAM на 7,8 %.
Влияние СВЧ-облучения на уровень в МНК исследованных факторов в группе контроля представлено в табл. 2.
Проведенный анализ показал, что спустя сутки после однократного облучения культуры клеток цельной крови низкоинтенсивным излучением частотой 1 ГГц прирост TIRAP составил 3,4 ‰, TRAM – 82,4 ‰, IRAK1 – 5,5 ‰, IRAK4 – 4,8 ‰, TRAF3 – 6,4 ‰, TAB1 – 4,9 ‰, MyD88 – 3,4 ‰.
Таким образом, в облученных культурах практически здоровых лиц имело место более выраженное повышение содержания в МНК адапторной молекулы TRAM – обеспечивающей внутриклеточную передачу сигнала от TLR4 и запуск продукции ИФН I типа. Вместе с тем, облучение в минимальной степени влияло на уровень в МНК адапторных протеинов MyD88 и TIRAP, активирующих фактор транскрипции NF-κB и протеинкиназы сигнального пути MAPK/SAPK-сигнального пути.
Влияние СВЧ-облучения на уровень исследованных факторов в основной группе представлено в табл. 3.
Таблица 1
Содержание факторов IL-1/TOLL-сигнального пути в группах
|
Фактор, нг/мл |
Группы |
Δ, % |
Уровень значимости, p |
|||
|
Основная группа |
Контрольная группа |
|||||
|
х |
s |
х |
s |
|||
|
TIRAP |
0,57 |
0,383 |
0,89 |
0,423 |
36,0 |
p < 0,05 |
|
MyD88 |
0,82 |
0,311 |
0,89 |
0,312 |
7,9 |
p > 0,1 |
|
TRAM |
0,55 |
0,289 |
0,51 |
0,115 |
– 7,8 |
p > 0,1 |
|
IRAK1 |
0,63 |
0,441 |
0,92 |
0,463 |
31,5 |
p < 0,05 |
|
IRAK4 |
0,6 |
0,15 |
0,63 |
0,238 |
4,8 |
p > 0,1 |
|
TRAF3 |
0,35 |
0,146 |
0,62 |
0,293 |
43,5 |
p < 0,05 |
|
TAB1 |
1,17 |
0,166 |
0,81 |
0,403 |
– 44,4 |
p < 0,05 |
Примечание. Δ, % – различие между контрольной группой и основной ( %), р – уровень значимости межгрупповых различий.
Таблица 2
Влияние СВЧ-излучения на уровень исследованных компонентов IL1/TOLL-сигнального пути в контрольной группе
|
Фактор, нг/мл |
Время, ч |
Естественное содержание |
СВЧ-облучение |
||||||
|
х |
Q25 |
Me |
Q75 |
х |
Q25 |
Me |
Q75 |
||
|
TIRAP |
0 |
0,893 |
0,56 |
1,039 |
1,227 |
0,895 |
0,561 |
1,04 |
1,229 |
|
24 |
0,894 |
0,561 |
1,04 |
1,228 |
0,899 |
0,565 |
1,044 |
1,233 |
|
|
TRAM |
0 |
0,51 |
0,425 |
0,495 |
0,595 |
0,52 |
0,435 |
0,505 |
0,605 |
|
24 |
0,513 |
0,425 |
0,51 |
0,6 |
0,565 |
0,475 |
0,555 |
0,655 |
|
|
IRAK1 |
0 |
0,918 |
0,49 |
0,932 |
1,346 |
0,919 |
0,491 |
0,934 |
1,348 |
|
24 |
0,918 |
0,491 |
0,931 |
1,346 |
0,924 |
0,495 |
0,938 |
1,353 |
|
|
IRAK4 |
0 |
0,63 |
0,43 |
0,68 |
0,831 |
0,632 |
0,431 |
0,682 |
0,832 |
|
24 |
0,631 |
0,431 |
0,681 |
0,831 |
0,636 |
0,436 |
0,687 |
0,837 |
|
|
TRAF3 |
0 |
0,624 |
0,357 |
0,666 |
0,891 |
0,625 |
0,359 |
0,667 |
0,892 |
|
24 |
0,625 |
0,359 |
0,667 |
0,892 |
0,63 |
0,364 |
0,671 |
0,897 |
|
|
TAB1 |
0 |
0,809 |
0,43 |
0,802 |
1,189 |
0,81 |
0,431 |
0,803 |
1,19 |
|
24 |
0,809 |
0,43 |
0,802 |
1,189 |
0,814 |
0,434 |
0,807 |
1,195 |
|
|
MyD88 |
0 |
0,889 |
0,627 |
0,976 |
1,152 |
0,891 |
0,628 |
0,977 |
1,153 |
|
24 |
0,89 |
0,627 |
0,977 |
1,153 |
0,895 |
0,632 |
0,982 |
1,158 |
|
Таблица 3
Влияние облучения на уровень исследованных компонентов IL1/TOLL-сигнального пути в основной группе
|
Фактор, нг/мл |
Время, ч |
Естественное содержание |
СВЧ-облучение |
||||||
|
х |
Q25 |
Me |
Q75 |
х |
Q25 |
Me |
Q75 |
||
|
TIRAP |
0 |
0,565 |
0,298 |
0,415 |
0,821 |
0,566 |
0,299 |
0,416 |
0,822 |
|
24 |
0,567 |
0,3 |
0,416 |
0,822 |
0,57 |
0,303 |
0,419 |
0,826 |
|
|
TRAM |
0 |
0,541 |
0,27 |
0,46 |
0,81 |
0,554 |
0,285 |
0,47 |
0,82 |
|
24 |
0,549 |
0,28 |
0,465 |
0,815 |
0,593 |
0,325 |
0,505 |
0,855 |
|
|
IRAK1 |
0 |
0,633 |
0,259 |
0,532 |
1,01 |
0,634 |
0,26 |
0,533 |
1,011 |
|
24 |
0,634 |
0,26 |
0,533 |
1,012 |
0,638 |
0,264 |
0,537 |
1,017 |
|
|
IRAK4 |
0 |
0,599 |
0,461 |
0,617 |
0,718 |
0,6 |
0,462 |
0,618 |
0,719 |
|
24 |
0,6 |
0,461 |
0,617 |
0,72 |
0,604 |
0,467 |
0,621 |
0,724 |
|
|
TRAF3 |
0 |
0,351 |
0,231 |
0,374 |
0,473 |
0,352 |
0,232 |
0,375 |
0,474 |
|
24 |
0,352 |
0,232 |
0,374 |
0,473 |
0,357 |
0,236 |
0,379 |
0,48 |
|
|
TAB1 |
0 |
1,166 |
1,064 |
1,138 |
1,338 |
1,167 |
1,065 |
1,139 |
1,339 |
|
24 |
1,166 |
1,066 |
1,138 |
1,338 |
1,17 |
1,07 |
1,143 |
1,342 |
|
|
MyD88 |
0 |
0,824 |
0,6 |
0,759 |
1,005 |
0,825 |
0,601 |
0,76 |
1,006 |
|
24 |
0,825 |
0,602 |
0,76 |
1,006 |
0,829 |
0,606 |
0,764 |
1,011 |
|
Таблица 4
Анализ статистической значимости эффектов СВЧ-облучения
|
Фактор |
Группы |
|||||
|
Контрольная группа |
Основная группа |
|||||
|
% v < V |
p |
Δ, ‰ |
% v < V |
p |
Δ, ‰ |
|
|
TIRAP |
100 |
0,013 |
3,4 |
100 |
0,013 |
3,5 |
|
MyD88 |
100 |
0,013 |
3,4 |
100 |
0,013 |
3,6 |
|
TRAM |
100 |
0,013 |
82,4 |
100 |
0,013 |
57,3 |
|
IRAK1 |
100 |
0,013 |
5,5 |
100 |
0,013 |
5,0 |
|
IRAK4 |
100 |
0,013 |
4,8 |
100 |
0,013 |
7,3 |
|
TRAF3 |
100 |
0,013 |
6,4 |
100 |
0,013 |
11,4 |
|
TAB1 |
100 |
0,013 |
4,9 |
100 |
0,013 |
2,6 |
Примечание. % v < V – доля значений в облученных культурах, превышающая соответствующий уровень необлученных ( %), Δ – различие между контрольной группой и основной ( ‰), р – уровень значимости межгрупповых различий.
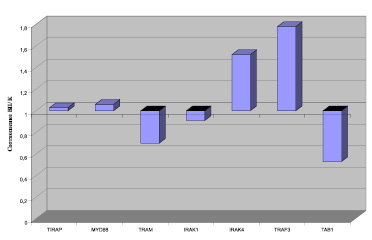
Соотношение эффектов облучения в основной группе и группе контроля
Проведенный анализ показал, что спустя сутки после однократного облучения культуры клеток цельной крови низкоинтенсивным излучением частотой 1 ГГц прирост TIRAP составил 3,5 ‰, TRAM – 57,3 ‰, IRAK1 – 4,7 ‰, IRAK4 – 5,0 ‰, TRAF3 – 11,4 ‰, TAB1 – 2,6 ‰, MyD88 – 3,6 ‰.
Результаты анализа статистической значимости различий исследованных показателей в группах, подвергнутых воздействию микроволн частотой 1ГГц представлены в табл. 4.
Проведенный статистический анализ свидетельствует о статистически значимом характере изменений в облученных МНК. На рисунке представлено соотношение средних значений наблюдаемых в исследовании эффектов воздействия микроволн на МНК в основной группе и группе контроля.
Проведенный анализ показал, что в основной группе, в сравнении с группой контроля, облучение более существенно влияет на уровень цитозольной киназы IRAK4 и TRAF3. На этом фоне уровень адапторного протеина TIRAP и MyD88 под влиянием облучения изменялся в основной группе и крупе контроля практически одинаково. При этом влияние облучения на уровень в МНК адапторного протеина TRAM, TRAF1, TAB1, IRAK1 было более выражено у практически здоровых лиц.
Таким образом, результаты проведенного исследования указывают на формирование у пациентов, перенесших острый инфекционно-воспалительный процесс выраженных изменений в МНК, определяющих изменение реактивности к различным внешним воздействиям, включая цитокины ответа острой фазы и чужеродных компонентов. При этом, у реконвалесцентов ВП отмечается выраженное повышение уровня в МНК протеина ТАВ1, обеспечивающего сопряжение IL-1/TOLL-сигнального пути с МАРК/SAPK-сигнальным путем. Менее выражено, в виде тенденции, в основной группе повышался уровень адапторного белка TRAM, обеспечивающего сопряжение IL-1/TOLL-сигнального пути с сигнальным путем интерферонов I-типа (IRF/IFN), независимое от адапторной молекулы MyD88. Роль данной молекулы особенно важна реализации противовирусной защиты, осуществляемой при активации TLR3 [15].
Уровень таких протеинов, как TIRAP, IRAK1, TRAF3 в основной группе был существенно ниже, чем в группе контроля. Указанное обстоятельство позволяет говорить о формировании у реконвалесцентов ВП условий для гипореактивности или ареактивности МНК в отношении цитокинов семейства ИЛ-1 (ИЛ-1, ИЛ-18, ИЛ-33) и молекул патогенности, распознаваемых, в частности TLR1-6. Снижение уровня IRAK4, одного из ключевых факторов, определяющих активацию неспецифической защиты в отношении грамположительных патогенов, способствуя уязвимости организма перед повторным инфицированием, в частности, streptococcus pneumoniae [16, 18].
На этом фоне однократное облучение клеток цельной крови микроволновым излучением частотой 1 ГГц, способствует повышению исходно сниженного уровня цитозольных киназ IRAK1 и TRAF3 в основной группе, в большей степени, чем в контрольной. Кроме того, облучение способствует увеличению уровня в МНК основной группы адапторных протеинов TIRAP и MyD88, в меньшей степени влияя на уровень TRAM и TAB1.
Учитывая, что под влиянием облучения наблюдается повышение уровня фосфорилирования терминальных протеинкиназ MAPK/SAPK-сигнального пути, в частности, р38 и ERK, можно полагать, что микроволновое излучение обладает модулирующим воздействием на уровень неспецифической клеточной реактивности, реализующимся за счет системного изменения внутриклеточных биохимических процессов. При этом результаты проведенных исследований свидетельствуют о том, что под влиянием микроволн имеет место сравнительно быстрая активация немедленных генов предранней реакции, очевидно, так же связанная, с активацией IL-1/TOLL-сигнального пути с вовлечением в процесс MAPK/SAPK-сигнального пути, за счет повышения активности протеинкиназы ТАВ1 [20]. При этом очевидно, что резонансные микроволны частотой 1 ГГц, обладая системным эффектом, обеспечивают более тесное сопряжение функциональной активности сигнальных путей, реализующих неспецифическую резистентность МНК с молекулярными каскадами, регулирующими адаптивные иммунные реакции. Указанные эффекты, возможно, реализуются за счет активации цитозольной киназы IRAK4 [16, 18].
Результаты биофизических исследований свидетельствуют о том, что первичной мишенью микроволн частотой 1 ГГц являются молекулы воды, поглощающие резонансное излучение [9]. Формирующиеся при этом структурные изменения водного матрикса, очевидно, являются определяющим фактором, способствующим изменению транскрипции соответствующих генов, изменению содержания в клетке рассматриваемых молекулярных мишеней, модификации функциональной активности МНК [2, 13].
Заключение
Постклиническая фаза острого инфекционно-воспалительного процесса сопровождается снижением содержания в МНК адапторных протеинов TIRAP, MyD88, цитозольных киназ IRAK1, IRAK4, TRAF3, а так же повышением уровня киназы ТАВ1.
Облучение культуры клеток цельной крови сопровождается более выраженным, чем в основной группе, повышением уровня в МНК адапторного протеина TRAF3, киназы IRAK4. В облученных МНК основной группы отмечается более выраженное, чем в группе контроля, повышение адапторного протеина TRAM. Влияние микроволн частотой 1 ГГц на уровень адапторных протеинов MyD88 и TIRAP оставалось одинаковым.
Полученные результаты позволяют рассматривать низкоинтенсивное микроволновое излучение частотой 1 ГГц в качестве фактора иммунореабилитации пациентов, перенесших острое инфекционно-воспалительное заболевание нижних отделов респираторного тракта.
Библиографическая ссылка
Бондарь С.С., Терехов И. В. СОСТОЯНИЕ IL1/TOLL-СИГНАЛЬНОГО ПУТИ В МОНОНУКЛЕАРНЫХ ЛЕЙКОЦИТАХ В ПОСТКЛИНИЧЕСКУЮ ФАЗУ ОСТРОГО ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА НИЖНИХ ОТДЕЛОВ РЕСПИРАТОРНОГО ТРАКТА ПОД ВЛИЯНИЕМ НИЗКОИНТЕНСИВНОГО ИЗЛУЧЕНИЯ ЧАСТОТОЙ 1 ГГЦ // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-6. С. 1088-1093;URL: https://applied-research.ru/ru/article/view?id=9138 (дата обращения: 02.01.2026).
DOI: https://doi.org/10.17513/mjpfi.9138

