Гистологическое исследование позволяет определить морфологическое строение опухоли, степень злокачественности, отсутствие или наличие метастазов в лимфатических узлах, опухолевых клеток в кровеносных и/или лимфатических сосудах и другие прогностические факторы [2].
В наибольшей степени изучены и комплексно исследованы часто встречающиеся морфологические формы – инфильтрирующий протоковый и дольковый раки молочной железы. Однако существуют и, так называемые, редкие формы РМЖ, которые выделены в отдельную нозологическую единицу благодаря особенностям гистологического строения, своеобразной морфологической картине, отличительным чертам в клиническом течении и прогнозе заболевания [2, 3].
Частота редких форм рака этой локализации, по данным разных авторов, колеблется в пределах 4,1-25 %. По данным онкоцентра им. Н.Н. Блохина редкие формы рака составляют 12,7 % от всех случаев рака молочных желез [3, 4, 5]. Это медуллярный, коллоидный, тубулярный, папиллярный, криброзный и другие формы (апокринный, слизистый, аденокистозный, секреторный рак, болезнь Педжета) рака. Они, в подавляющем числе случаев, редко метастазируют в регионарные лимфатические узлы, могут быть гормоночувствительными и эндокринонечувствительными [4, 5].
Цель исследования
Оценить влияние особых морфологических структур на исход комбинированного и комплексного лечения рака молочной железы.
Материалы и методы исследования
Проведен ретроспективный анализ 2-х групп больных, получавших лечение в РНИОИ. В основную группу вошли 89 пациенток, имевших редкие морфологические формы рака – медуллярный рак диагностирован в 23,6 % случаев, тубулярный рак в 35,9 %, папиллярный рак – 14,7 %, слизистый – в 25,8 % случаях. Контрольную группу составили 101 больная РМЖ с традиционным инфильтративно-протоковым морфологическим процессом. Проведенный анализ показал, что больные основной и контрольной групп по основным клиническим параметрам, таким как возраст, стадия заболевания, локализация очага поражения, степень дифференцировки опухоли и ее иммуно-гистохимическим характеристикам были сопоставимы. Со стадией II А-II В было 48 из 89 (53,9 %) больных в основной группе и 55 (58,3 %) в контроле. Стадия III А, В, С соответственно в 46,1 % и в 41,6 % случаях наблюдения. Средний возраст больных 53,9 ± 4,2 лет и 54,1 ± 3,8 лет по группам.
Всем больным хирургическое лечение проводилось в виде радикальной мастэктомии (РМЭ) или органосохраняющей операции. Полихимиотерапия осуществлялась по показаниям в нео – или в адъювантных режимах. Лучевая терапия как компонент комбинированного и комплексного лечения проводилась через 1 месяц после операции, либо через 3-4 недели после завершения последнего курса адъювантной полихимиотерапии.
Трехмерная конформная лучевая терапия (3DCRT), проводилась на ЛУЭ Varian Unique 6 МэВ или гамма-терапевтическом аппарате «Theratron» (Со – 60). Предлучевая топометрическая подготовка осуществлялась с использованием компьютерного томографа «SIEMENS SOMATOM», с подбором фиксирующего приспособления, с использованием системы Eclipse conturing и планирующей системы Eclipse beam planning [1, 6].
Результаты исследования и их обсуждение
Многочисленные рандомизированные исследования, проведенные в онкологических центрах России, Великобритании, Канады показали, что гипофракционированный режим лучевой терапии оказывается более эффективным при лечении различных злокачественных опухолей, в том числе и при РМЖ [5, 7].
Jagsi R, Griffith KA, Boike TP, и другие члены Консорциума по качеству лучевой терапии Мичигана, США, в 2015 году, оценили проспективные данные, касающиеся ранней токсичности при использовании различных вариантов фракционирования дозы у 2309 пациенток, включенных в анализ, из которых 578 получали гипофракционированные курсы лучевой терапии. Оценка результатов показала, что помимо несомненного удобства, гипофракционирование ассоциировано с меньшим риском развития лучевых дерматитов [8].
В рекомендациях St.Gallen 2015 года упоминается, что ряд экспертов считают гипофракционирование вполне приемлемым и для пациенток с метастазами в подмышечных лимфоузлах. Однако зоны регионального лимфооттока традиционно не облучают в гипофракционированном режиме. Но, по мнению авторов, это предубеждение перестанет быть препятствием к применению укороченных курсов облучения для подавляющего большинства пациенток [6].
После РМЭ, в основной и контрольной группах, мы проводили облучение с разовой очаговой дозой (РОД) 2,4 Гр на послеоперационный рубец и мягкие ткани передней грудной стенки, а также по показаниям на зоны регионарного метастазирования – аксиллярную и шейно-надподключичную зоны до суммарной очаговой дозы (СОД) 48-50 изоГр. Расчёт суммарной изоэффективной дозы осуществлялся согласно методическим рекомендациям ВДФ.
Общая тенденция в развитии современных технологий облучения: 3D конформная лучевая терапия (3DCRT), лучевая терапия с модуляцией интенсивности (IMRT), лучевая терапия, направляемая по изображению (IGRT) и др. – как можно более точное «наведение» пучка ионизирующего излучения на зоны – мишени, создание конформного распределения дозы в тканях. 3DCRT на ЛУЭ с интегрированным многолепестковым коллиматором диафрагмы позволяла оптимизировать дозное распределение в зоне-мишени и лимфоколлекторах; уменьшала гетерогенность дозы; снижала средние дозы на сердце, легкие, щитовидную железу, плечевой сустав на стороне поражения [4].
При подготовке к лечению, на этапе оконтуривания, выборе программ для лучевой терапии, мы руководствовались международными рекомендациями. Так, планирование мишени и органов риска у больных РМЖ проводилось в соответствии с Breast Cancer Atlas for RadiationTherapy Planning; дозиметрическое планирование – в соответствии с рекомендациями ICRU-50 и ICRU-62; с 2010 г. толерантные дозы определялись по рекомендациями QUANTEC [9].
На рис. 1 представлены примеры дозного распределения для реализации лечебного плана адъювантного облучения мягких тканей передней грудной стенки после РМЭ на ЛУЭ Varian Unique 6 МэВ.
После органосохраняющих операций лучевую терапию проводили на оставшуюся часть молочной железы и, по показаниям, на зоны лимфооттока.
Количество, размеры и взаиморасположение полей, во всех случаях подбирались индивидуально для каждой пациентки с учетом анатомического строения, с экранированием критических для облучения органов [4, 5].
На рис. 2 представлены направления тангенциальных полей при облучении оставшейся части молочной железы после органосохраняющей операции. Облучение проводилось на гамма-терапевтическом аппарате «Theratron» (Со-60). Пациенткам после органосохраняющей операцией с использованием эндопротеза, облучение также проводили на оставшуюся часть молочной железы. В данной клинической ситуации РОД составляла 2,0 Гр, СОД – 50 Гр.
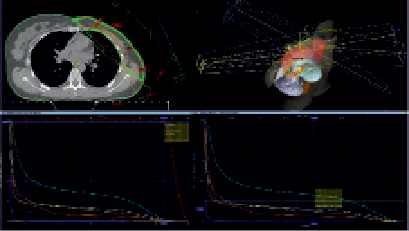
Рис. 1. Лечебный план на ЛУЭ при 3D – лучевой терапии после РМЭ
Дополнительным средством оценки качества плана облучения обязательным является использование гистограмм доза-объем (DVH – Dose Volume Histogram). DVH представляет собой график распределения дозы в облучаемом объеме. Согласно рекомендациям QUANTEC, планируемый объём зоны-мишени должен лежать в пределах 98 %. Изодоза 110 % и выше, не превышать 2 % объема, PTV должен входить в 95 % изодозу для конформного облучения, и покрываться 80-90 % изодозой при использовании гамма-терапевтических аппаратов. Дозовая нагрузка 20 Гр не должна превышать 30 % объема обоих легких. Дозовая нагрузка 30 Гр и 25 Гр не должна превышать 46 % и 10 % объема сердце соответственно [7, 9]. В обеих группах больных оценка плана лечения нами проводилась с обязательным учетом требований QUANTEC. Так, на гистограммах доза-объем (рис. 1), видно, что при облучении на ЛУЭ планируемый 98 % объём зоны-мишени охвачен 95 % изодозой. При этом на гистограммах доза-объем для гамма-терапевтического аппарата «Theratron», планируемый 98 % объём зоны-мишени охвачен 80 – 90 % изодозой (рис. 2).
При верифицированных метастазах в регионарных лимфоузлах, лучевое воздействие с одного переднего поля фотонами различных энергий проводилось на шейно-надподключичную зону РОД 2,4 Гр до СОД 46 изоГр.
Ипсилатеральные парастернальные лимфоузлы облучали в случаях клинического или морфологического подтверждения их поражения, или с учетом конкретной клинической ситуации. При планировании обязательно учитывался вклад на эту область от облучения передней грудной стенки [3].
Частота ранних побочных общетоксических и гематологических реакций была равноценна в обеих группах больных и не превышала данных литературы [4, 5]. Ранние повреждения кожи в виде эритемы, зарегистрированы в 31,4 % случаях в основной группе и у 32,6 % в контроле. При этом влажный эпителиит имел место только в ситуациях с органосохраняющими операциями. Пульмониты возникли в 14,6 и в 15,8 % случаях соответственно в основной и в группе контроля. Имелась четкая корреляция реакций с методом облучения, с возрастом, наличием сопутствующей патологии и с фактором «доза – эффект».
В рамках нашего исследования мы оценили общую 3-х летнюю общую выживаемость больных основной и контрольной групп, и другие показатели (таблица).
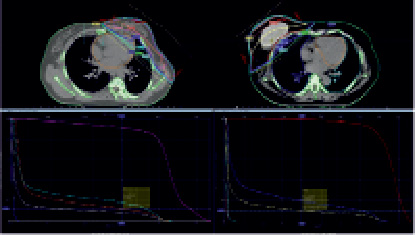
Рис. 2. Лечебный план на «Theratron» (Со – 60) при 3D – лучевой терапии после органосохраняющих операций
Результаты исследования в анализируемых группах
|
Показатели |
Группы |
|
|
Основная, % |
Контрольная , % |
|
|
Общая 3-х летняя выживаемость |
76,1 ± 1,7 |
74,6 ± 1,1 |
|
Диаметр опухоли < 5 см |
81,3 ± 1,9 |
79,7 ± 1,3 |
|
Диаметр опухоли > 5 см |
65,6 ± 1,8 |
62,4 ± 2,1 |
|
N 0 |
82,8 ± 1,1 |
79,3 ± 1,7 |
|
N 1-3 |
79,3 ± 1,7 |
68,5 ± 2,2 |
|
Местный рецидив в течение года |
1,1 ± 0,9 (р < 0,05) |
4,9 ± 1,1 |
Общая 3-х летняя выживаемость больных, вне зависимости от стадии процесса, в основной группе составила76,1 ± 1,7 %, в контрольной – 74,6 ± 1,1 %. Как и предполагалось, выживаемость четко коррелировала с размерами первичного очага. Для больных с опухолью менее 5 см она составила 81,3 ± 1,9 % и 79,7 ± 1,3 % соответственно по группам. При большем размере первичной опухоли соответственно 65,6 ± 1,8 и 62,4 ± 2,1 %.
Выживаемость больных, не имевших метастазы в регионарные лимфоузлы, была в основной группе выше на 11,9 %, а в контроле выше на 10,8 %, по сравнению с пациентками, имевших поражение лимфоузлов.
Обратило внимание существенное снижение числа локальных рецидивов в основной группе больных. Локальные рецидивы в течение года манифестировались в основной группе существенно, а именно, в 4,4 раза реже, чем в контроле. Соответственно в 1,1 % случаев против 4,9 %, (р < 0,05). Вероятно, это связано с биологическими особенностями редких форм рака молочной железы.
Заключение
Таким образом, с нашей точки зрения, редкие морфологические формы рака молочной железы следует облучать по общепринятым стандартам.
Редкие морфологические формы не являются негативным прогностическим фактором для выживаемости больных раком молочной железы.
В клинической практике режимы гипофракционированной адъювантной лучевой терапии после радикальной мастэктомии с разовой очаговой дозой 2,4 Гр на мягкие ткани передней грудной стенки, на зоны регионарного лимфооттока, включая шейно-надподключичную зону, при фракционировании 5 раз в неделю являются безопасными и могут являться альтернативой стандартным методикам.
Библиографическая ссылка
Кошелева Н.Г., Гусарева М.А., Розенко Л.Я., Стасов В.В., Зинькович М.А., Фатькина Н.Б., Солнцева А.А., Маркова Н.В., Павлятенко И.В., Карнаухова Е.А. ЛУЧЕВАЯ ТЕРАПИЯ В КОМБИНИРОВАННОМ И КОМПЛЕКСНОМ ЛЕЧЕНИИ РЕДКИХ ФОРМ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ (РМЖ) // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-6. С. 1099-1103;URL: https://applied-research.ru/ru/article/view?id=9140 (дата обращения: 03.02.2026).

