Под электрохимической активацией систем понимают процесс перевода растворов в метастабильное состояние, вызванное структурно-энергетическими и электрохимическими изменениями в электрическом поле, в результате которых растворы в течение периода релаксации проявляют аномальные свойства в физико-химических превращениях [1]. В результате электрохимической активации окислительно-восстановительный потенциал (ОВП) католита и анолита резко изменяются по сравнению с ОВП исходной воды. Вода из анодного пространства (анолит) имеет высокие положительные значения, обладает окислительными свойствами и находит применение для дезинфекции в различных областях человеческой деятельности. Вода из катодного пространства (католит) имеет отрицательные значения окислительно-восстановительного потенциала, измерение которых связаны с определенными трудностями. Отрицательные значения ОВП активированных вод связывают с их антиоксидантной активностью (АОА) [2-3]. Однако целый ряд экспериментальных данных не подтверждают это предположение. Так католит дистиллированной воды не восстанавливает феррицианид калия и 5,5’-дитиобис-(2-нитробензойную кислоту) [4], активированные растворы бихромата калия приобретают отрицательный ОВП без потери окислительных свойств [5]. Показано, что отрицательные значения ОВП на платиновом электроде не отражают окислительно-восстановительных свойств активированных растворов [6]. В настоящее время причина отрицательных значений ОВП католита неизвестна [3]. Также остается открытым вопрос об антиоксидантных свойствах электрохимически активированной воды. Ранее для определения АОА был использован кинетический метод, основанный на регистрации скорости накопления продукта аутоокисления адреналина в щелочной среде, предложенный в работе [7]. Однако исследования антиоксидантной активности воды этим методом обнаружили ряд недостатков и противоречий [8]. Поэтому необходимо привлечение других методов для надежного определения этого параметра.
Цель работы состояла в изучении антиоксидантной активности электрохимически активированных растворов, потенциометрическим и спектрофотометрическим методами и анализе полученных результатов.
Материалы и методы исследования
рН и ОВП исследуемых образцов измеряли с помощью иономера «Экотест-120». Для измерения рН использовали ионселективный стеклянный электрод с твердым контактом «ЭКОМ-рН» (НПП «Эконикс». Окислительно-восстановительный потенциал измеряли при помощи платинового электрода ЭПВ-1ср., ЭО-1 (РУП «Гомельский завод измерительных приборов», Беларусь). В качестве электрода сравнения для потенциометрических измерений использовали хлорсеребряный электрод ЭВЛ-1М3.1 (РУП «Гомельский завод измерительных приборов», Беларусь). Спектры поглощения растворов измеряли на спектрофлуориметре СМ 2203 (ЗАО «Солар», Беларусь) и спектрофотометре UV-1800 Shimadzu (Япония) в кварцевых кюветах с толщиной поглощающего слоя 1 и 5 см.
Электрохимически активированную воду получали на промышленно выпускаемых активаторах: АП-1 (ЧНПУП «Акваприбор», Беларусь), «Здрава 3.3» (Дальприбор, Владивосток), «Мелеста» ( ) и фильтра электрохимической очистки «Изумруд» (НИЦ «Икар», Ижевск).
Реактивы Na2CO3 (х.ч.), NaOH (х.ч.), NaHCO3 (ч.д.а.), K3[Fe(CN)6] (х.ч.), K4[Fe(CN)6] (ч.д.а.), гидрохинон (ч.д.а), аскорбиновую кислоту (мед.) использовали без предварительной очистки. Эксперименты проводили на воде мембранной очистки (Владимир). В качестве медиаторной системы использовали систему K3[Fe(CN)6]/ K4[Fe(CN)6].
Статистическая обработка результатов и терминология. АОА определяли как среднее значение 3-5 экспериментов. Доверительный интервал рассчитывали с использованием критерия Стьюдента для вероятности 95 %. Положительные значения АОА обозначали антиоксидантную активность, а отрицательные – прооксидантную.
Результаты исследования и их обсуждение
Оценка антиоксидантной активности потенциометрическим методом основана на изменении окислительно-восстановительного потенциала раствора, содержащего медиаторную пару при введении в него антиоксиданта [9]. При взаимодействии оксиданта или антиоксиданта, содержащегося в вводе, с одним из компонентов системы ОВП раствора изменяется. По величине сдвига потенциала рассчитывают АОА по формуле:
АОА = ± (СOX – αCRed) (1 + α)-1
α = 10(E1 – E)/b CRed/COx
b = 2,3RT/nF,
где Е и Е1 – значения окислительно – восстановительного потенциала до и после введения исследуемого вещества; CRed и COx – концентрации восстановленной и окисленной форм медиатора. АОА выражена в моль-экв/л.
Для определения интегральной активности сложных смесей показал свою эффективность потенциометрический метод с использованием медиаторной системы K3[Fe(CN)6]/K4[Fe(CN)6]. Показано, что этот метод имеет коэффициент корреляции близкий к 1 с такими методами определения АОА, как метод перекисного окисления липидов, хемилюминесценции, Randox и фотометрического с использованием стабильного свободного радикала 2,2-дифенил-1-пикрилгидразина [10]. Потенциометрический метод с использованием медиаторных систем используется для определении АОА вин и безалкогольных напитков [9], а также крови и ее фракций [11]. Показано, что разные индикаторные электроды, в том числе, гладкий платиновый электрод, имеют очень близкие характеристики и могут быть успешно использованы для определения АОА различных объектов.
Перечисленные выше объекты характеризуются довольно высокими значениями АОА (1 – 50 мМоль-экв/л). Для активированных вод разного типа с низкой степенью минерализации можно было предположить невысокие значения АОА. С учетом особенностей объекта исследования определение проводили следующим образом: в химический стакан, вместимостью 100 – 150 мл помещали 50 мл исследуемого образца, добавляли 10 мл раствора, содержащего медиаторную систему в в 0,1 М фосфатном буфере, раствор перемешивали, выдерживали 40 минут и измеряли ОВП раствора. За единицу отсчета принимали ОВП раствора, разбавленного водой мембранной очистки. Были изучены медиаторные системы в диапазоне концентраций 5х10-5 – 1х10-3 М ферро- и феррицианида калия. В качестве оптимальной была выбрана эквимолярная система с концентрацией 2 х10-4 М. Данная система с одной стороны, достаточно чувствительна, а с другой стороны, обладает достаточной емкостью.
Для определения зависимости потенциала раствора, содержащего медиаторную систему [K3Fe(CN)6]/ [K4Fe(CN)6] от концентрации антиоксиданта использовали аскорбиновую кислоту и гидрохинон. Найденные значения концентрации гидрохинона хорошо согласуются с добавленными количествами (близки к 100 %), в то время как, рассчитанные значения аскорбиновой кислоты немного занижены и составляют 91 – 97 %.
Поскольку в уравнении Нерста отношения концентраций находятся под знаком логарифма, строят зависимости в координатах (E1 – E0) – lg Cox/Cred, которые линейны в пределах двух порядков lg Cox/Cred для исследуемых медиаторных систем [11]. Оказалось, что зависимости E и (E1 – E0) от концентрации модельного антиоксиданта имеют прямолинейные участки, пригодные для графического определения АОА. На рис. 1 представлены зависимости сдвига потенциала индикаторного электрода от концентрации аскорбиновой кислоты для медиаторных систем различной концентрации.
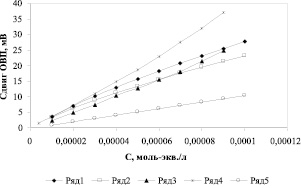
Рис. 1. Зависимость сдвига ОВП от концентрации аскорбиновой кислоты для медиаторных систем K4[Fe(CN)6]/ K3[Fe(CN)6]: 1 – 5х10-5/2х10-4М; 2 – 5х10-5/5х10-4М; 3 – 2х10-4/2х10-4М; 4 – 7,5х10-5/7,5х10-5М; 5 – 5х10-4/5х10-4М
По мере накопления экспериментальных данных стало ясно, что отрицательный потенциал активированных растворов, который устанавливается на платиновом электроде при прямых измерениях, мешает определению АОА потенциометрическим методом. Так, при добавлении к анализируемому католиту медиаторной системы наблюдали отрицательный ОВП, который в системе K3[Fe(CN)6]/ K4[Fe(CN)6] невозможен при любом соотношении окисленной и восстановленной форм. Также были отмечены нестабильные значения потенциала, динамика которых была сходна с релаксацией ОВП в активированных растворах. Данные обстоятельства заставили усомниться в правильности результатов определения АОА активированных вод потенциометрическим методом и потребовали поиска новых подходов к решению задачи.
Поскольку отрицательные значения ОВП активированных растворов устанавливаются только на платиновых электродах, в то время как на электродах ЭО-1 они остаются положительными [10], была предпринята попытка использовать вместо гладкого платинового электрода ЭПВ-1 электрод из электронопроводящего стекла ЭО-1. При использовании разных электродов для растворов с медиаторной системой следует ожидать одинаковых значений ОВП на индикаторном электроде, поскольку система K3[Fe(CN)6]/ K4[Fe(CN)6] в фосфатном буфере используется в качестве стандартного раствора для проверки редокс электродов.
Были проведены параллельные определения АОА католитов с использованием электродов ЭПВ-1 и ЭО-1. Электроды ЭО-1 действительно позволили избежать мешающего влияния отрицательного ОВП активированных растворов, однако время установления равновесия на индикаторном электроде оказалось длительным: от 15 до 30 минут, а воспроизводимость хуже, чем для платинового электрода (стандартное отклонение 0,69, против 0,18 для платинового электрода). Поскольку сдвиги ОВП для исследуемого диапазона значений АОА невелики, метрологические характеристики потенциометрических измерений с электродом ЭО-1 были признаны неудовлетворительными.
Были измерены спектры поглощения ферро- и феррицианида калия. K3[Fe(CN)6] имеет максимум в видимой области спектра при 420 нм, в то время как K4[Fe(CN)6] при этой длине волны не поглощает. Рассчитанный коэффициент молярного погашения K3[Fe(CN)6] 1035 хорошо согласуется с литературными данными. В результате взаимодействия окислителя (восстановителя) с ферро- или феррицианидом калия изменяется соотношение [Fe(CN)6]4-/[Fe(CN)6]3- и, соответственно, окислительно-восстановительный потенциал и оптическая плотность раствора, содержащего медиаторную пару. Спектрофотометрическое определение АОА проводили с использованием эквимолярной медиаторной системы, концентрацией 2х10-4 М следующим образом. В мерные колбы, вместимостью 50 мл помещали 10 мл медиаторной системы, концентрацией 0,001 М, доводили до метки исследуемым раствором, перемешивали, выдерживали в течение 40-60 минут и измеряли оптическую плотность при 420 нм в кюветах с толщиной поглощающего слоя 1 – 5 см. Параллельно готовили холостую пробу на дистиллированной воде. Затем определяли разность оптических плотностей исследуемого раствора и холостой пробы. Уменьшение оптической плотности свидетельствует о том, что исследуемый раствор обладает восстановительными свойствами, увеличение – окислительными. Изменение оптической плотности при 420 нм обусловлено изменением концентрации K3[Fe(CN)6] и соответствует концентрации окислителя (восстановителя), выраженной в моль-экв/л: АОА = (D0 – Di)/1035. Зависимость оптической плотности растворов, содержащих медиаторную пару, от концентрации восстановителя носит линейный характер (рис. 2). Чувствительность метода при использовании кювет с длиной оптического пути 5 см – 2х10-6 моль-экв./л.
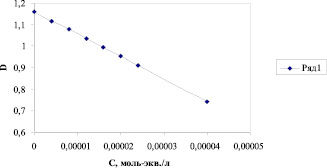
Рис. 2. Зависимость оптической плотности раствора K3[Fe(CN)6]/ K4[Fe(CN)6] (начальная концентрация K3[Fe(CN)6]=2,24х10-4) от концентрации гидрохинона. l = 5 см
Результаты определения АОА потенциометрическим и спектрофотометрическим методами представлены в таблице.
Антиоксидантная активность электрохимически активированной воды
|
Образец |
рН |
ОВП, мВ |
АОА, моль-экв./л х105 |
|
|
ПМ |
СфМ |
|||
|
Католит дистиллированной воды АП-1 |
10,63 |
– 118 |
8,58 ± 0,09 |
0 |
|
Католит дистиллированной воды АП-1 |
10,65 |
– 270 |
4,78 ± 0,08 |
0 |
|
Анолит дистиллированной воды АП-1 |
3,0 |
342 |
0 |
0 |
|
Католит водопроводной воды АП-1 |
10,48 |
– 140 |
3,81 ± 0,07 |
0 |
|
Анолит водопроводной воды АП-1 |
2,83 |
974 |
– 4,2 ± 0,07 |
– 7,77 ± 0,12 |
|
Католит водопроводной воды Мелеста |
10,50 |
– 8 |
– |
0 |
|
Анолит водопроводной воды Мелеста |
2,76 |
1037 |
– |
– 9,78 ± 0,14 |
|
Водопроводная вода, активированная в «Здраве» |
9,19 |
– 296 |
– |
– 0,75 ± 0,38 |
Примечание. *ПМ – потенциометрический метод (электрод ЭПВ-1ср.); СфМ – спектрофотометрический метод.
Из данных таблицы следует, что при спектрофотометрическом определении АОА католит не обнаруживает восстановительных свойств, в то время как прооксидантные свойства анолита согласуются с концентрацией, содержащихся в ней анионов. Обращает на себя внимание тот факт, что значения АОА, полученные потенциометрическим методом не корелируют со значениями ОВП, полученными путем прямых измерений на платиновом электроде.
Выводы
Результаты определения АОА католита потенциометрическим методом с использованием гладкого платинового электрода ЭПВ-1ср. оказываются завышенными вследствие возмущающего действия активированного состояния раствора, которое выражается в понижении потенциала индикаторного электрода.
Определение АОА потенциометрическим методом возможно с использованием электрода из электронопроводящего стекла ЭО-1, однако время установления равновесия на этом электроде велико, а метрологические характеристики хуже, чем для платинового электрода.
Оптимальным методом для определения АОА электрохимически активированных растворов является спектрофотометрический метод.
Библиографическая ссылка
Некрасова Л.П., Михайлова Р.Н., Рыжова И.Н. ОПРЕДЕЛЕНИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ЭЛЕКТРОХИМИЧЕСКИ АКТИВИРОВАННОЙ ВОДЫ ПОТЕНЦИОМЕТРИЧЕСКИМ И СПЕКТРОФОТОМЕТРИЧЕСКИМ МЕТОДАМИ // Международный журнал прикладных и фундаментальных исследований. 2016. № 5-4. С. 559-563;URL: https://applied-research.ru/ru/article/view?id=9450 (дата обращения: 03.03.2026).

