Проблема ресурсосбережения в химико-технологических процессах крайне важна в связи с истощением доступных природных ресурсов и разомкнутостью большинства технологических циклов, приводящих к рассеиванию ценных компонентов. Для создания эффективных химико-технологических процессов на каждой стадии должен достигаться максимальный выход продукта и сводиться к минимуму его потери.
В настоящее время все процессы, происходящие при переработке металлосодержащих компонентов, непосредственно связаны с процессами выщелачивания из них ценных компонентов и последующем их извлечением, фракционированием и регенерацией выщелачивающего агента для создания замкнутого цикла.
Гальванические производства в силу использования в них токсичных компонентов различной природы (тяжелые металлы, комплексообразователи, ПАВ и т.д.) являются одним из значимых источников загрязнения окружающей среды. Очистка стоков гальванических производств ведет к образованию значительных количеств сложных по составу шламов.
С гальваношламами (ГШ) теряется значительное количество ценных цветных металлов. Поэтому проблема извлечения их из щламов является актуальной задачей как с экологической, так и с экономической точек зрения.
Задача рационального использования металлосодержащих отходов может быть решена только при разработке нестандартных энергосберегающих методов и конструирования нестандартного технологического оборудования. Это может быть достигнуто созданием научно – теоретически обоснованных технологических решений, разработки ресурсосберегающих химико-технологических процессов и регенерации технологических сред.
Этим требованиям отвечает разработанная в НГТУ им. Р.Е. Алексеева малоотходная и ресурсосберегающая технология комплексной утилизации гальваношламов, обогащенных медью [4]. Данная технология включает следующие стадии: – сернокислое выщелачивание тяжелых металлов из гальваношлама; – отделение нерастворимой части; – селективное электрохимическое извлечение металлов и их соединений с одновременной регенерацией выщелачивающего агента. Разработан метод противоточного перколяционно-осцилляторного выщелачивания металлов из твердых металлосодержащих сред, способ регенерации выщелачивающих растворов, содержащих серную кислоту и соответствующего оборудования [3]. Отличительной особенностью разрабатываемых технологических циклов комплексной утилизации ГШ является, во-первых, селективное извлечение тяжелых металлов из шламов в виде продуктов/полупродуктов и, во-вторых, регенерация выщелачивающего агента ГШ – раствора серной кислоты – позволяет вернуть в производство не менее 80 %.
Использование электрохимического метода позволило совместить и одновременно проводить катодное извлечение металлов и их соединений из выщелачивающих растворов и регенерацию серной кислоты.
Достаточно существенной проблемой стадии электрохимического извлечения металлов из сернокислых растворов выщелачивания является нестабильность свинцовых анодов диафрагменных электролизеров и их износ.
В настоящей работе проведены исследования возможного использования перспективных коррозионностойких композиционных анодов для электролиза сернокислых выщелачивающих растворов.
Важными показателями работоспособности анодного материала являются его каталитическая активность и селективность по отношению к основному процессу, коррозионная стойкость, технологичность изготовления. Вследствие высокой коррозионной активности среды и в условиях анодной поляризации выбор материалов, пригодных для изготовления, довольно ограничен.
В качестве электродного материала широко применяют свинец (например, в сернокислых электролитах), но из-за износа происходит попадание свинца в электролит, что не всегда положительно влияет на показатели процесса и качество очистки. Перспективное направление исследований – композиционные аноды, активный слой которых нанесен на титановую токоподводящую основу. Электрохимические и каталитические свойства анода определяет покрывающий основу активный слой. Такая композиция обладает необходимой для анода комбинацией электрокаталитических, коррозионных и электрохимических свойств. Между металлическим титаном и нанесенным на него окислом всегда имеется прослойка из нестехиометрических окислов титана, поведение которых во многом определяет характеристику электрода, в частности, увеличение анодного потенциала, наблюдающегося на некоторых вида электродов, например, анодов с покрытиями из двуокиси марганца и свинца [5].
В последнее время много внимания уделяется созданию металлокерамических и композиционных металлических материалов на основе титана. В зависимости от условий прессования и спекания возможно получить материал и изделия различной пористости, вплоть до компактных керамических и композиционных материалов. Перспективным направлением является создание электрода на пористой основе с активным слоем из оксидов железа. Использование пористой основы титана целесообразно по следующим причинам:
а) активный слой из магнетита будет хорошо задерживаться в порах;
б) анод на пористой основе имеет более развитую рабочую поверхность.
Варьируя способы нанесения магнетита на титановую основу можно получить достаточно стойкий слой из магнетита. Магнетит обладает существенным преимуществом в цене и распостраненности железа в природе.
По основным электрохимическим характеристикам, определяющим склонность металла к пассивности, титан следует отнести к металлам с очень высокой пассивируемостью, превосходящей пассивируемость железа, никеля, нержавеющей стали и даже в некоторых отношениях хрома.
Пассивное состояние титана при поляризации в серной кислоте не нарушается даже при достижении очень высоких положительных значений потенциала.
Независимость скорости анодного растворения титана от потенциала в пассивном состоянии можно объяснить на основе представлений, развитых Франком и Вейлем применительно к пассивации железа в серной кислоте. В этой области потенциалов стадией, определяющей скорость растворения металла, является скорость химического растворения окисла, не зависящая от величины электродного потенциала.
По мере повышения положительного значения потенциала, т.е. окислительных условий, состав пассивирующей пленки на титане изменяется, переходя от низших ступеней окисления к высшим.
Толщина окисной пленки возрастает по мере смещения потенциала в положительную сторону.
Выделение кислорода на титане наступает при достаточно большом перенапряжении примерно 3В. Оксидная пленка, образующая на титане при анодной поляризации, обладает низкой проводимостью, вследствие чего уже при небольших токах возникают очень высокие электродные потенциалы.
При нанесении окислов железа на титан возможно образование смешанных оксидов железа и титана.
Исследовалось удельное сопротивление системы FeO – Fe2O3 с добавкой 5 % TiO2. При увеличении количества окиси железа в образце она начинает определять электропроводность композиции, растворение двуокиси титана в окиси железа уменьшает удельное сопротивление.
Стойкость электродов из электропроводной (с добавкой TiO2) окиси железа значительно выше чем электродов из магнетита.
Окись железа с добавкой двуокиси титана имеет ценные электродные свойства – низкие анодные потенциалы при выделении кислорода и высокую коррозионную стойкость. Окись железа может быть рекомендована для изготовления анодов только в виде покрытий на хорошо электропроводном, кислотостойком материале. Наиболее подходящим для этой цели является титан [5].
Таким образом, в системе FeO – Fe2O3 – TiO2 довольно высокая коррозионная стойкость сохраняется в широком диапазоне концентраций компонентов.
Ф.В. Купович с сотрудниками предложили [1] использовать при электролизе водных растворов хлоридов металлов оксидножелезный титановый анод (ОЖТА).
ОЖТА представляет собой титановую основу с нанесенным на нее методом плазменного напыления каталитически активным слоем, состоящим в основном из магнетита с небольшими примесями гематита и вюстита.
Цель исследования – повышение срока службы анодов активированием металлокерамической титановой основы, полученной спеканием порошка титана, с последующей пропиткой ее в растворе хлорного железа и термообработкой.
Исследования проводились на монолитном титане марки ВТ1-0 и металлокерамической титановой основе. Металлокерамическая основа получена вальцеванием порошка титанового мелкого (ПТМ) с последующим спеканием при температуре 600-700 °С в среде аргона. Толщина основ – 0,5-0,6 мм, пористость – 30-35 %, средний диаметр пор – 7-12 микрометров.
Образцы перед каждым опытом травились в смеси концентрированных кислот H2SO4:HF:HNO3 в объемном соотношении 3:4:4.
Для установления коррозионной стойкости титана в исследуемом растворе образцы из монолитного и порошкового титана, промытые в дистиллированной воде и высушенные взвешивали и выдерживали в исследуемом растворе один месяц. После истечения срока образцы отмывались от раствора, высушивались и взвешивались. Наблюдали за изменением окраски электрода, т.к. соединения титана имеют яркую интенсивную окраску благодаря которым их легко идентифицировать.
Активирование осуществлялось пропиткой в растворе FeCl3. В химический стакан наливали 50 мл раствора хлорида железа FeCl3. Подогревали раствор до температуры пропитки в соответствии с условиями опыта. Электроды выдерживали в растворе в соответствии с временем, исходя из матрицы планирования. Пропитанные образцы без предварительной кристаллизации подвергались термообработке в электропечи при температуре и времени в соответствии с условиями опыта. До и после пропитки и термообработки электроды взвешивались.
Эффективность анодирования определялась по количеству электричества пропущенного через электрод до достижения потенциала равного +5,0 В.
Гальваностатические исследования проводились при постоянной заданной плотности тока. В ячейки с 10 % раствором серной кислоты, вставляли предварительно зачищенные катоды из нержавеющей стали и исследуемые электроды. Электродом сравнения служил насыщенный хлорсеребряный электрод.
Поляризационные измерения осуществлялись в стандартной трехэлектродной ячейке на потенциостате П-5848. Значения тока поляризации записывались с помощью потенциометра КСП-4. В качестве рабочего электрода использовались монолитный титан, пористая титановая основа. Потенциодинамические кривые снимались в растворе серной кислоты со скоростями развертки потенциала 1, 2, 5, 10, 20 мВ/с. Кривые на аналогичных образцах снимались не меньше трех раз.
Исследуемый раствор анализировался на содержание катионов атомно-адсорбционным методом. Погрешность метода – 1 %.
Предварительно были проведены коррозионные испытания на монолитном титане. Образец из монолитного титана, в течение одного месяца находился в исследуемом растворе. После испытаний у образца не изменился цвет поверхности и масса.
Было выяснено поведение в серной кислоте пористой титановой основы. Для этого был выбран гальваностатический метод исследования.
Определяющим фактором смещения потенциала в электроположительную сторону является окисление титана. При пропускании электричества в количестве 3 А∙ч/дм2 потенциал титановой основы возрос до 8,5 В. Цвет электродов изменился, стал золотисто-бронзовым. Такая окраска образцов свидетельствует о наличии на поверхности титана его оксида TiO2. При дальнейшей поляризации потенциал электродов продолжает возрастать, и при протекании 7 А∙ч/дм2 достигает 13,3 В. При таком потенциале рабочая поверхность анодов окрашена в темно-фиолетовый цвет, что характерно для Ti2O3.
Толщина пленки характеризуется увеличением анодной поляризации. Можно сделать предположение, что при высоких анодных потенциалах превалирующее влияние имеет оксид TiO2, который имея проводимость 10-13 Ом-1∙см-1, по-видимому, и «запирает» анодную поверхность [2].
Сравнительная характеристика поведения монолитной и металлокерамической основ приведена на рис. 1. Потенциал пористой титановой основы электроотрицательнее потенциала монолитного титана. При протекании через электроды одинакового количества электричества, оксидная пленка на пористой основе меньшей толщины, чем на монолитном титане. Это связано с более развитой поверхностью пористой титановой основы.
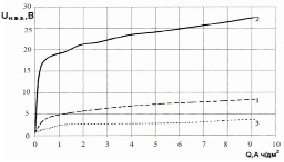
Рис. 1. Сравнительная характеристика поведения титановых основ под анодной поляризацией в 10 % растворе H2SO4: 1 – пористая титановая основа, j = 2,8 А/дм2; 2 – монолитная основа, j = 0,45 А/дм2; 3 – пористая титановая основа, j = 0,45 А/дм2
Гальваностатическим методом выяснено, что на пористой титановой основе при анодной поляризации растет оксидная пленка. Для выявления лимитирующей стадии применен потенциодинамический метод.
На кривых j – E, снятых на разных основах, появляется один максимум.
При увеличении потенциала плотность тока возрастает до определенного значения. В этот период процесс идет с кинетическим контролем. Дальнейшее увеличение поляризации приводит к переключению с кинетического контроля на смешанный: кинетический и диффузионный. Это свидетельствует о запирании электродной поверхности, на границе электрод-раствор, плохо проводящими окислами титана. Причем, величина тока пика jn, при скоростях развертки 1-20 мВ/с, не зависит от скорости развертки. Это означает, что толщина пленки линейно увеличивается во времени и изменяется по тому же закону, что и обратная емкость. Такая связь между изменением обратной емкости и приростом толщины пленки характеризует линейный рост плохо проводящих диэлектрических слоев.
Величина тока пика на пористой титановой в 3,5 раза выше, чем на монолитном титане. Потенциал тока пика сдвинут к более положительным значениям. Снижение плотности тока после пика происходит гораздо медленнее. Это свидетельствует о более развитой поверхности пористого металлокерамического порошкового титанового электрода. Из-за более развитой поверхности рост оксидной пленки на пористой титановой основе происходит медленнее, чем на монолитном титане (рис. 2).
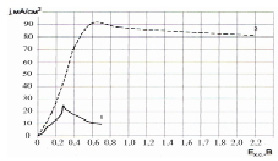
Рис. 2. Потенциодинамические кривые, снятые в 0,35н. растворе H2SO4 при скорости развертки, 10 мВ/с: 1 – монолитном титане, 2 – пористой титановой основе
Рост анодной окисной пленки сопровождается небольшим видимым выделением кислорода. Нанести активный слой на титановую основу можно несколькими методами: электрохимическое осаждение, напыление, намазывание, пропитка. Перспективным направлением в применении методов химического осаждения является использование так называемого термического осаждения. При термическом осаждении путем нагревания кислых растворов солей металлов протекает реакция гидролиза. В одних случаях гидролиз приводит к образованию гидрооксидов металлов. В других случаях термическое осаждение ведет к образованию оксигидратов и оксидов металлов. Зависимость тока пика от логарифма скорости развертки для монолитной и пористой титановой основы представлены на рис. 3.
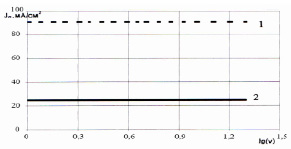
Рис. 3. Зависимости тока пика от логарифма скорости развертки lg(v): 1 – монолитная основа; 2 – пористая титановая основа
Для изготовления электродов выбрали соль FeCl3∙6H2O, так как по данным она обладает «высокой подвижностью» и хорошо термически осаждается.
После пропитки и последующей термообработки электроды приобретали темно-бурую окраску, в то же время как до начала опыта были серые. Такая окраска соответствует магнетиту.
Пористая титановая основа, активированная соединениями железа, обладает лучшими электрохимическими свойствами в исследуемом растворе, чем не активированная (рис. 4).
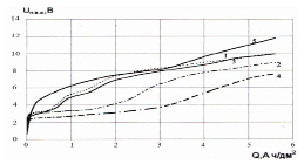
Рис. 4. Изменение потенциала электродов под анодной поляризацией при разных режимах пропитки и термообработки: 1 – основа, пропитанная в растворе FeCl3∙6H2O 150 г/л, в течение часа, при температуре 200 °С, 2 – основа, пропитанная в растворе FeCl3∙6H2O 150 г/л, в течение часа, при температуре 250 °С, 3 – основа, пропитанная в растворе FeCl3∙6H2O 50 г/л, в течение часа, при температуре 200 °С, 4 – основа, пропитанная в растворе FeCl3∙6H2O 50 г/л, в течение часа, при температуре 250 °С; 5 – пористая титановая основа
На пропитанных основах потенциал ниже, чем на не пропитанной пористой титановой основе. Более низкое значение объясняется тем, что активный слой, покрывающий поверхность титана, затрудняет доступ кислорода к нему. А перенапряжение выделения кислорода на магнетите ниже, чем на оксидах титана. Скорость окисления титана уменьшается [5]. Для оптимизации условий пропитки и термообработки пористой основы использовался метод математического планирования эксперимента. Температура пропитки (60-90 °С) взята с учетом того, что при низких температурах раствор обладает большей вязкостью и плохо заходит в поры, а при температуре 100 °С и выше заметно улетучивается. При температуре термообработки ниже 250 °С раствор не подвергается полному термическому разложению до оксидов железа. При температурах порядка 350 °С и выше происходит интенсивное окисление поверхности титана.
Была проведена серия из 32 опытов, результатом которой стал срок службы анодов с разными параметрами пропитки и термообработки.
Результаты были обработаны и получено уравнение регрессии:
у = 20,81 + 4,73 • х1 +11,82 • х2 + 3,54 • х4 +1,23 • х5 + 4,62 • xt -х2 + (1) + 3,15 • jc, • х4 + 1,04 • х2 • х3 + 3,60 • х2 • х4
Здесь х1 – температура пропитки, х2 – число пропиток, х3 – температура термообработки, х4 – время пропитки, х5 – время термообработки.
Наибольшее влияние имеют температура (х1) и число пропиток (х2). Коэффициенты, имеющие значение меньше единицы, вносят небольшой вклад в общее значение выходного параметра, не вошли в уравнение регрессии.
Срок службы анодов, пропитанных при увеличении температуры до 90 °С (рис. 5), времени пропитки с 30 до 90 минут и числа пропиток до трех возрастает примерно в два раза. Вероятно, за 90 минут поры титановой основы пропитываются на большую глубину, чем за 30 минут, т.е. увеличивается степень заполнения пор титановой основы активным слоем. Что также характеризуется увеличением привеса электродов.
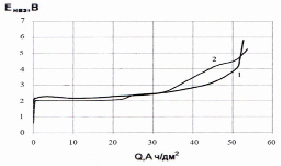
Рис. 5. Изменение потенциала электродов в процессе эксплуатации в 10 % растворе H2SO4: 1 – пропитка при температуре 90 °С в течение 90 минут, термообработка при температуре 250 °С в течение 120 минут, число циклов – 3; 2 – пропитка при температуре 90 °С в течение 90 минут, термообработка при температуре 250 °С в течение 30 минут. число циклов – 3
На всех обработанных образцах стационарный потенциал в 10 % растворе H2S04 был 0,61 В по н.в.э,, на непропитанной порошковой титановой основе после термообработки при температуре 300 °С в течение 2 часов +0,61 В по н.в.э. Такой же потенциал был и у не термообработанной пористой титановой основы. Из этого можно сделать вывод, что титановая основа определяет потенциал электрода.
Под током потенциалы пропитанных электродов примерно на 1-1,5 В ниже, чем у непропитанной пористой титановой основы. Это может быть связано с меньшим перенапряжением выделения кислорода на активном слое. Активный слой состоит из оксидов железа и титана, а так же из некоторого количества ильменита FeO-TiO2 [6].
Увеличение анодного потенциала в процессе электролиза можно условно разбить на 2 участка. На первом потенциал электрода остается постоянным и его значение составляет для разных электродов 2 – 2,7 В. По-видимому, это происходит из-за того, что в этот промежуток времени активный слой полностью закрывает поверхность титановой основы. Разное значение потенциала является следствием образования разного по составу каталитически активного слоя на разных электродах. Титан не окисляется ионами кислорода, так как они почти не проникают через толщину активного слоя. В процессе электролиза происходит постоянное подрастворение активного слоя. Об этом свидетельствуют результаты анализа исследуемого раствора атомно-адсорбционным методом. Концентрация железа в исследуемом растворе после электролиза была 0,27 г/л. До электролиза раствор железо не содержал. Второй участок характеризуется медленным ростом потенциала. Начало роста потенциала, по-видимому, связано с частичным обнажением основы и начавшимся окислением титана.
Электролиз прекращали при значении потенциала 5 В. При этом значении потенциала, на поверхности электрода, практически полностью отсутствует активный слой. Окисление титана произошло в незначительной степени. Подтверждением этому служит отсутствие изменение массы образцов и цвета во время эксперимента. Можно сделать вывод, что за время электролиза основными процессами были растворение активного слоя и выделение кислорода.
В целом удалось снизить начальный потенциал такого анода до 2,0-2,7 В по сравнению с пористой титановой основой (5-7 В) и значительно стабилизировать его при дальнейшей анодной поляризации. Для сравнения, железный электрод полностью растворился за шесть часов электролиза.
Выводы
Потенциодинамическим и потенциостатическим методом исследовано поведение монолитного титана и пористой титановой основы в серной кислоте. Отмечено, что скорость пассивации пористой титановой основы меньше, чем монолитного титана.
Выбран способ и оптимизированы режимы пропитки пористой титановой основы в растворе FeCl3 и термообработки. Отмечено, что температура, время пропитки и число пропиток являются решающими факторами в процессе образования активного слоя на пористой титановой основе.
Определено, что срок службы активированных титановых анодов зависит от развития поверхности основы и содержания железа в активном слое.
Библиографическая ссылка
Бачаев А.А., Пачурин Г.В., Смирнова В.М., Шаманин М.В. РАЗРАБОТКА КОМПОЗИЦИОННЫХ АНОДОВ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ ТЕХНОЛОГИИ РЕГЕНЕРАЦИИ СЕРНОКИСЛЫХ РАСТВОРОВ // Международный журнал прикладных и фундаментальных исследований. 2016. № 6-2. С. 228-234;URL: https://applied-research.ru/ru/article/view?id=9586 (дата обращения: 03.03.2026).

